神香苏合丸对心肌梗死大鼠肠道菌群的影响*
2022-03-04魏兴解天钟鑫勤赵鑫王小莹
魏兴 ,解天 ,钟鑫勤 ,赵鑫 ,王小莹
(1.天津中医药大学中药学院,天津 301617;2.天津中医药大学中医药研究院,天津 301617)
心肌梗死是冠状动脉急性、持续性缺血、缺氧所引起的心肌坏死,多发生于冠状动脉粥样硬化狭窄基础上[1]。根据《中国心血管病报告2019》数据显示,中国约有3.3亿人患有心血管疾病,其中冠心病患者约有1 100万[2]。对于冠心病的治疗,中医药典籍中早有记载,《金匮要略》中记载瓜蒌薤白半夏汤可治冠心病,《太平圣惠方》中记载治疗胸痹多用芳香、温通、辛散之品与益气、养血、滋阴药物相互为用,《医林改错》首创血府逐瘀汤等活血化瘀名方为治疗胸痹之经典方,沿用至今[3-4]。神香苏合丸源于《太平惠民和剂局方》卷三中的苏合香丸[5],有温通开窍、行气止痛之效,主治寒邪、秽浊或气郁闭阻机窍之证。该药由麝香、冰片、苏合香、安息香、乳香、丁香、广木香、沉香、白术、香附、水牛角共11味药物组成,用于寒凝心脉、气机不畅所致的胸痹,症见心痛、胸闷、胀满、遇寒加重,冠心病心绞痛见上述症状者,具有良好的疗效。前期研究基于超高效液相色谱-飞行时间质谱联用技术(UPLC-Q-TOF-MS/MS)对神香苏合丸中的化学成分进行检测,共检测到麝香酮等38种有效成分,通过Lipinski五原则进一步筛选得到18个可吸收成分[6]。现代药理学初步研究表明,神香苏合丸能够缓解实验性大鼠心肌梗死[7],且对斑马鱼的心功能、缺氧运动耐受能力具有改善作用[8]。
前期实验对大鼠进行冠状动脉左前降支结扎造成大鼠心肌缺血,诱导大鼠心肌梗死[9-10]。神香苏合丸给药剂量为0.126 g/kg,连续给药2周能显著改善大鼠心肌梗死状态。运用小动物超声心动检测等方法进行了神香苏合丸治疗心肌梗死的药效学验证,显示大鼠心肌梗死后心脏左心室前壁运动幅度减弱,心肌收缩力下降,射血分数降低,左心室短轴缩短率降低。心肌梗死大鼠心肌细胞结构被破坏,间质出现大量炎性细胞浸润,给予神香苏合丸后,上述药效指标均有显著改善。随着基因组测序技术和生物信息学的发展,肠道微生物在心血管疾病发病机制中的组成和潜在作用得到了深入研究[11-13]。其中有关“肠渗漏”的概念认为心肌梗死后会导致肠缺血、水肿,进而导致肠道稳态遭到破坏,体循环中的肠源细菌和有害代谢产物(如内毒素)发生移位,加重机体炎症状态[14]。因此,有效恢复肠道稳态、重塑菌群结构是药物治疗疾病的重要途径之一。截至目前,神香苏合丸对心肌梗死疾病的治疗作用是否与肠道菌群相关尚不明确,因此本研究通过高通量测序技术探讨神香苏合丸对心肌梗死大鼠肠道菌群的改善作用。
1 仪器与材料
1.1 仪器 小动物超声实时影像系统、MISEQ测序仪、HISEQ 测序仪 (Illumina);Covaris M220(Gene Company Limited);聚合酶链反应(PCR)仪(Applied Biosystems);高速台式冷冻离心机、超微量分光光度计(Eppendorf);电泳仪(北京市六一仪器厂);酶标仪(Biotek);微型荧光计(TurnerBioSystems);生化培养箱(上海一恒科学仪器有限公司);酶标仪(Tecan);超净工作台(苏州净化厂);移液器(Eppendorf);电子天平(天津亿诺科学仪器有限公司);快速混匀器(江苏新康医疗器械有限公司)。
1.2 菌种和试剂 约氏乳杆菌EU03(Lactobacillus johnsoniiEU03,登记号 CPCC101288)、鼠乳杆菌 EU04(Lactobacillus murinus EU04,登记号CPCC101290)由天津中医药大学微生物实验室自主分离鉴定并保藏于中国药学微生物菌种保藏管理中心(CPCC)。DNA抽提试剂盒(Omega Bio-tek,Norcross,GA,美国);DNA聚合酶(FastPfu,TransGen);DNA 凝胶回收试剂盒(Axygen,美国);MRS肉汤、营养琼脂粉、甘油(北京索莱宝生物科技有限公司);脱脂乳培养基(山东拓普生物工程有限公司);神香苏合丸(杭州胡庆余堂有限公司)。
1.3 实验动物 清洁级Sprague-Dawley雄性大鼠,体质量为(220±10)g,该批动物由天津中医药大学实验动物中心提供,饲养于天津中医药大学实验动物中心SPF级动物房,饲养条件为室温20~25℃,相对湿度40%~60%,饲养用灭菌颗粒饲料由动物实验中心提供,饲养用清洁饮用水由实验动物中心提供且每日更换饮水,所有大鼠自由饮水,实验室光照环境为明暗环境各12 h交替。运用结扎冠状动脉左前降支的方法制备大鼠心肌梗死模型[15]。将造模成功的实验动物分为假手术组、模型组、神香苏合丸组,每组8只。各组大鼠灌胃给予神香苏合丸,剂量为0.126 g/kg,连续给药14 d,给药后运用小动物超声实时影像系统检测各组大鼠的左心室功能。
给药14 d后在无菌环境下操作取粪便样本,包括假手术组、模型组和神香苏合丸组。用酒精消毒的镊子和无菌离心管捡取新鲜的大鼠粪便2~3粒放于-80℃冰箱保存备用。
2 方法
2.1 DNA抽提和PCR扩增 根据DNA提取试剂盒说明书进行总DNA抽提,DNA浓度和纯度利用NanoDrop 2000进行检测,利用1%琼脂糖凝胶电泳检测DNA的提取质量;用338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和 806R(5’-GGACTACHVGGGTWTCTAAT-3’)引物对V3~V4可变区进行PCR扩增,扩增程序为:95℃预变性3 min,27个循环(95℃变性30 s,55℃退 30 s,72℃延伸30 s),最后 72℃延伸10min。扩增体系为20μL,包括4μL5×FastPfu缓冲液,2 μL 2.5 mmol/L dNTPs,0.8 μL 引物(5μmol/L),0.4 μL FastPfu聚合酶及10 ng DNA模板,用无菌水补足剩余体积。
2.2 Illumina Miseq测序 PCR产物利用Axy Prep DNA Gel Extraction Kit进行纯化,三羟甲基氨基甲烷盐酸盐(Tris-HCl)洗脱,2%琼脂糖凝胶电泳检测。利用Quanti FluorTM-ST进行检测定量。根据Illumina MiSeq平台标准操作规程将纯化后的扩增片段构建PE 2×300的文库(上海美吉生物医药科技有限公司)。
2.3 生物信息学分析 本研究根据所扩增的16S区域特点,基于Illumina HiSeq测序平台,构建小片段文库进行双末端测序。通过对Reads拼接过滤,使用 UPARSE 软件(version 7.1,http://drive5.com/uparse/),根据97%的相似度对序列进行操作分类单元(OTU)聚类,并在聚类过程中去除单序列和嵌合体。利用 RDP classifier(http://rdp.cme.msu.edu/)对每条序列进行物种注释及丰度分析,比对Silva数据库(SSU123),设置比对阈值为70%,揭示样品物种构成;进一步的α多样性分析、β多样性分析用于挖掘样品之间的差异。
2.4 细菌生长曲线测定 将冻存的Lactobacillus johnsonii EU03、Lactobacillus murinus EU04 转移至灭菌的脱脂乳培养基中,42℃培养4h,反复活化3代,使菌种活力恢复,置于4℃冰箱保存备用。将活化的菌液分别转种至MRS肉汤培养基中,37℃静置培养16 h,以此作为种子液。运用平板计数法对不同稀释倍数的 100 μL Lactobacillus johnsonii EU03、Lactobacillus murinus EU04进行涂布,对菌落数30~300个的平板计数,以CFU/mL为单位得到菌落计数结果。其中CFU/mL指的是每毫升种子液中含有的细菌菌落计数,菌落计数=(C/V)×M,其中C代表某一稀释液环境平板上生长的平均菌落数,V代表涂布平板时所用的稀释液体积,M代表稀释倍数。
用灭菌水配制0.1 mg/mL神香苏合丸药液,超声溶解过滤膜。Lactobacillus johnsonii EU03、Lactobacillus murinus EU04活化后,分别每次10倍稀释至107倍稀释液,在96孔板中分别加入实验组100 μL不同稀释倍数菌液以及100 μL药液,加药对照组100 μL药液加入100 μL MRS肉汤培养基,菌液对照组100 μL不同稀释倍数菌液加入100 μL灭菌水,空白对照组100 μL MRS肉汤培养基加入100 μL灭菌水,放入酶标仪中,设置时间为每循环2 h,共13个循环,吸光度检测波长600 nm,温度37℃,确定促进菌体最佳稀释倍数。按以下公式计算细菌生长率并绘制生长曲线(生长率的计算原则为实验组净生长量/对照组净生长量):生长率(%)=([A加药实验组-A加药对照组)(/A菌液对照组-A空白对照组)]×100%。
2.5 神香苏合丸对益生菌生长的影响 配制1mg/mL神香苏合丸,分别稀释不同浓度至0.75、0.5、0.25、0.1 mg/mL,在96孔板中分别加入实验组100 μL最佳稀释倍数为104的Lactobacillus johnsonii EU03、Lactobacillus murinus EU04菌液以及100 μL药液,加药对照组100 μL药液加入100 μL MRS肉汤培养基,菌液对照组100 μL不同稀释倍数菌液加入100μL灭菌水,空白对照组100μLMRS肉汤培养基加入100 μL灭菌水,放入酶标仪中,设置时间为每循环2 h,共25个循环,吸光度检测波长600 nm,温度37℃,确定促进益生菌生长的最佳药物浓度。
2.6 统计学方法 采用SPSS 20.0统计软件进行数据统计分析,实验数据以均数±标准差(±s)表示,采用单因素方差分析进行组间比较,当方差齐时选用LSD检验方法,方差不齐选择Dunnett’s T3检验方法。P<0.05为差异有统计学意义。
3 实验结果
3.1 神香苏合丸对心肌梗死大鼠肠道菌群多样性的影响 射血分数(EF)和短轴缩短率(FS)是评价左心室功能的关键指标,给药14 d后运用小动物超声实时影像系统对各组大鼠进行左心室功能检测,结果见图1。图1A为给药14 d后各组大鼠左心室EF变化情况,模型组大鼠左心室EF显著降低(P<0.05),给药后显著升高(P<0.05);图 1B 为给药 14 d后各组左心室FS的变化情况,模型组大鼠左心室FS显著降低(P<0.05),给药后显著升高(P<0.05)。表明神香苏合丸对心肌梗死大鼠左心室功能具有明显的改善作用。
给药后取各组大鼠粪便样本进行检测,各组样品复杂度分析结果提示分组合理,测序数据合理,各样本分布均匀且多样性丰富。图1C为Rank-Abundance曲线图,Rank-Abundance曲线可用来解释多样性的两个方面,即物种丰富度和群落均匀度。在水平方向,曲线宽度反映物种丰富度,曲线在横轴上的范围越大,物种的丰富度就越高;曲线的形状(平缓程度)反映了样本中群落的均匀度,曲线越平缓,物种分布越均匀。Rank-Abundance曲线结果显示假手术组物种丰富度最低,模型组和神香苏合丸组均增加,神香苏合丸组丰富度最高;神香苏合丸组群落均匀度分布最均匀。图1D为稀释曲线,是从样本中随机抽取一定数量的序列,统计这些序列对应样本的Alpha多样性指数,以抽取的数据量为横坐标,以Alpha多样性指数值为纵坐标绘制曲线,根据曲线是否达到平缓来判断本次测序数据的数量是否足够。图中各组数据均达到平缓,表明测序数据合理。Alpha多样性主要指一个特定区域或者生态系统内的多样性,Shannon指数可以确定物种多样性。图1E为Alpha多样性组间差异检验,结果显示假手术组与模型组多样性低,在给药神香苏合丸后肠道菌群多样性显著增加。Beta多样性分析通过对不同生境或微生物群落间的物种多样性进行组间比较分析,探索不同分组样本间群落组成的相似性或差异性。图1F通过基于Bray-Curtis算法的主坐标分析(PCoA),分析各组间差异所展现的肠道菌群Beta多样性,图中假手术组与模型组有一定程度离散,给予神香苏合丸后群落与模型组比较有一定离散程度,且群落相似度趋近于假手术组。
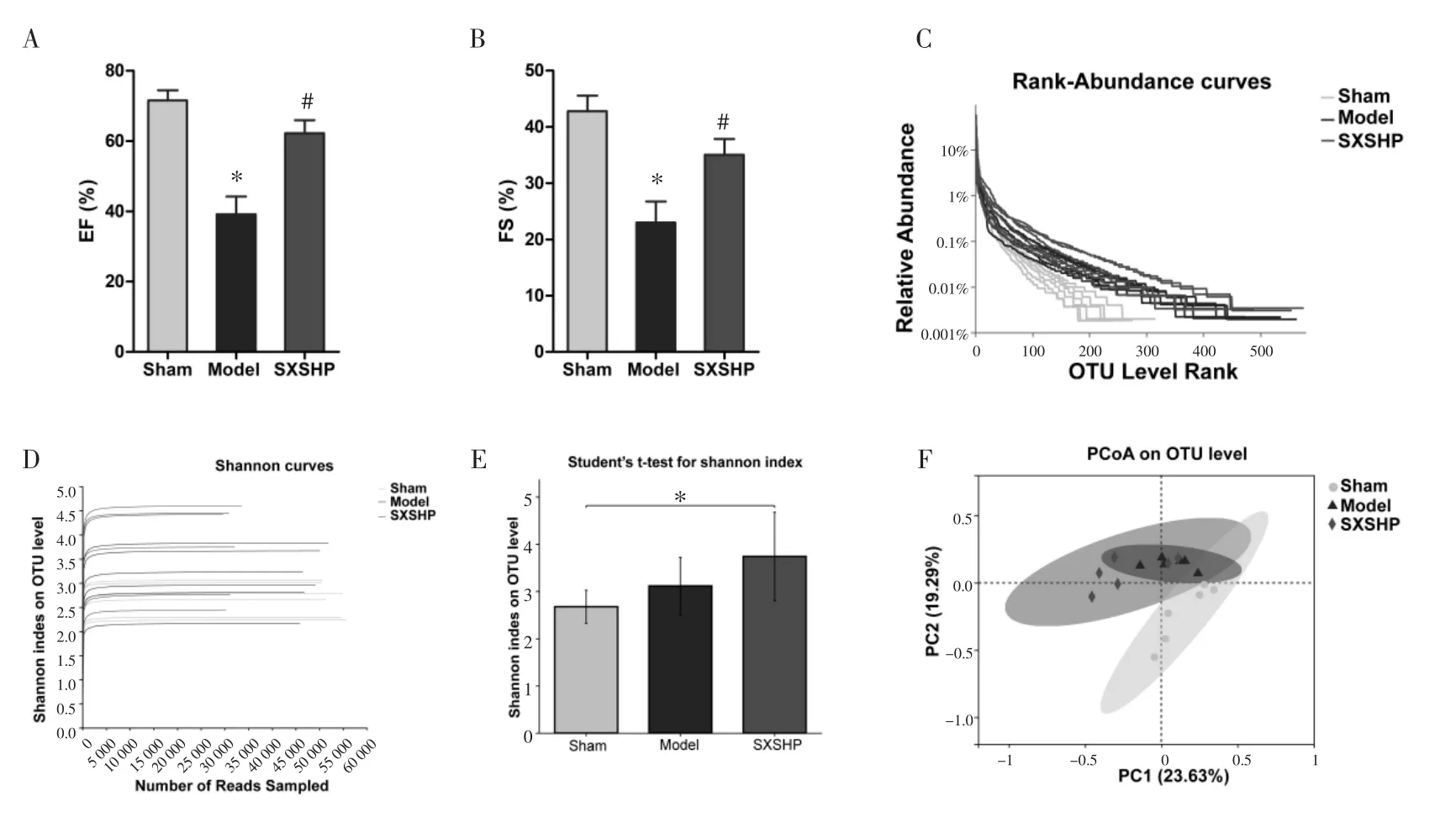
图1 药效评价及样本多样性分析
3.2 神香苏合丸对心肌梗死大鼠肠道中微生物物种丰度的调节作用 厚壁菌门和拟杆菌门是主要的门,占存在细菌90%以上。图2为肠道菌群门水平的丰度分析,与假手术组比较,模型组厚壁菌门丰度增加,拟杆菌门丰度减少,厚壁菌门/拟杆菌门比值增大;神香苏合丸组与模型组比较,厚壁菌门丰度减少,拟杆菌门丰度增加,厚壁菌门/拟杆菌门比值减小。与假手术组比较,模型组Patescibacteria丰度显著上升(P<0.05),给予神香苏合丸后有下降趋势但无统计学差异(P>0.05)。

图2 门水平上的物种丰度分析(±s)
进一步对肠道菌群属水平的菌群进行丰度分析,结果见图3。与假手术组比较,模型组链球菌、罗姆布茨菌、毛螺菌科、单球菌属丰度显著升高(P<0.05),给予神香苏合丸后显著降低(P<0.05);与假手术组比较,模型组理研菌科、普雷沃氏菌科丰度显著升高(P<0.05),给予神香苏合丸后有降低趋势但无统计学差异(P>0.05);给药后罗斯氏菌和乳球菌属丰度与模型组比较明显升高(P<0.05),假手术组与模型组比较无统计学差异(P>0.05);神香苏合丸还能增加心肌梗死大鼠肠道中乳杆菌属丰度,但无统计学差异(P>0.05)。

图3 属水平上的物种丰度分析(±s)
乳杆菌作为益生菌的重要成员之一,对心血管具有良好的保护作用,能够通过调节机体免疫、炎症等过程缓解心血管疾病的发生与发展。其属水平上,约氏乳杆菌和鼠乳杆菌占乳杆菌属中大部分细菌丰度,且神香苏合丸能在一定程度上促进约氏乳杆菌和鼠乳杆菌生长,见图4。
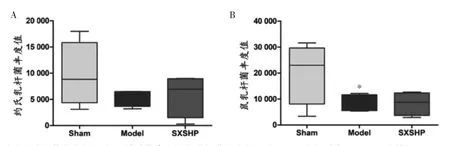
图4 神香苏合丸对两种乳杆菌种益生菌丰度的影响(±s)
采用基于OTU的韦恩图对给药14 d后假手术组、模型组与神香苏合丸组样品进行聚类分析,以查找组间特有菌,见图5。结果显示假手术组有71种特有菌,模型组有93种特有菌,神香苏合丸组有72种特有菌。神香苏合丸组的特有菌主要有毛螺菌科和克里斯滕森菌科,属水平上有罕见小球菌属、罗斯氏菌属、粪球菌属和阿洛巴氏菌属。结果提示神香苏合丸能够改变心肌梗死大鼠的肠道菌群结构。
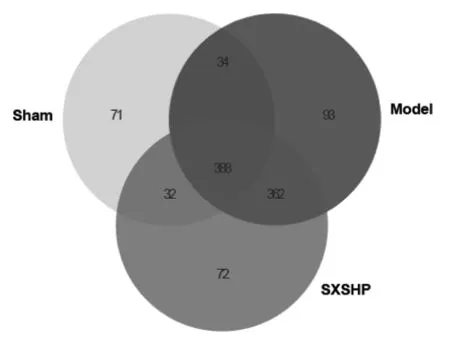
图5 基于OTU的组间分布丰度分析
3.3 体外检测神香苏合丸对益生菌生长的影响 图6为平板计数法对稀释倍数为104的Lactobacillus johnsonii EU03、Lactobacillus murinus EU04各100μL的涂布结果,计算得出Lactobacillus johnsonii EU03菌液浓度为 3×109CFU/mL,Lactobacillus murinus EU04菌液浓度为4×108CFU/mL。
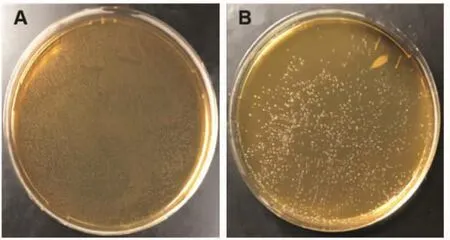
图6 104稀释倍数下益生菌生长情况(涂布量 100 μL,培养 24 h)
统计生长率结果显示菌株在104稀释倍数下,实验组吸光度较大、生长率高,说明在此菌株生长浓度下药物能较好地促进其生长,见图7。

图7 菌株最适宜生长条件筛选
统计生长曲线结果显示神香苏合丸可提高Lactobacillus johnsonii EU03生长率,浓度为0.1mg/mL时促进作用最大;神香苏合丸还可提高Lactobacillus murinus EU04生长率,浓度为0.5 mg/mL时促进作用最大,见图8。

图8 神香苏合丸作用于不同益生菌的生长曲线
4 讨论
肠道菌群及其代谢产物参与了心肌梗死早期的心肌修复。作为肠道菌群的代谢产物之一,短链脂肪酸可以诱导髓样细胞募集进入心脏参与修复,对心肌梗死有益。心肌梗死通过饮食补充短链脂肪酸或静脉输注单核细胞系RAW264.7可显著降低抗生素所致的病死率,缓解心脏损伤[16]。肠道菌群结构被破坏可能会引起心肌梗死预后不良。除此之外,肠道菌群还可以通过调节脂质代谢、血压、细胞凋亡等多种方式干预心肌梗死病程。肠道菌群能够调节与炎症、心肌梗死发病机制相关的宿主信号传导,进而减小心肌梗死面积,改善心肌梗死[17]。
肠道微生物群及其代谢产物作为心血管疾病的整体介质,已成为预防和治疗心血管疾病的新治疗靶标,肠道微生态平衡在维持健康的心血管功能中发挥关键作用[18-19]。本研究通过16S扩增子测序技术检测神香苏合丸给药后对心肌梗死大鼠肠道菌群组成的影响,结果表明神香苏合丸可以恢复心肌梗死大鼠肠道微生物组的丰富度和均匀度,增加物种多样性。研究表明动脉粥样硬化、高血压病、肥胖和2型糖尿病等心血管相关疾病中,来源于厚壁菌门的肠道微生物丰度显著增加[20]。给予神香苏合丸后肠道菌群结构得到改善,主要表现在减小厚壁菌门/拟杆菌门比值,降低毛螺菌科、理研菌科、普雷沃氏菌科、链球菌属、罗姆布茨菌属等与心血管危险因素相关的菌群丰度[21-24]。其中,链球菌属还可引起主动脉炎症,加速动脉粥样硬化发展[25]。除此之外,给予心肌梗死大鼠神香苏合丸后,罗斯氏菌、乳球菌属、乳杆菌属等72种优势肠道微生物丰度增加。罗氏菌属作为肠道中能产生丁酸盐的特有菌属,可通过产生短链脂肪酸发挥抗炎作用,与小鼠的动脉粥样硬化病变发展呈负相关[26-27]。用乳球菌属菌株发酵的食品可以抗氧化,抗血栓形成,降低血压和胆固醇活性[28-30]。乳杆菌作为肠道益生菌中数量较多的一类,在心血管相关疾病预防和治疗中得到广泛研究,其主要机制是影响脂质胆固醇代谢、免疫炎症反应、氧化应激反应以及所涉及的肠道代谢物(包括氧化三甲胺、短链脂肪酸、脂多糖和胆汁酸)[31-34]。
现有研究表明除了多样化和均衡的饮食外,使用益生元和益生菌也可预防心血管疾病[35]。因此本研究重点关注乳杆菌等益生菌,推测神香苏合丸可能通过增加肠道益生菌的丰度而改善大鼠体内代谢物质的水平,起到改善心肌梗死的作用。临床研究显示,人体在摄入益生菌(或益生元)后,益生菌会在人体的肠道定植,参与到人体的消化、吸收、代谢过程中,从而发挥分解脂肪等功效。肥胖及代谢性疾病患者采用益生菌治疗可降低体质量[36]。通过合理的给药方式也可以间接增加肠道菌群中的益生菌,进而改善抗氧化能力与脂质分布,起到保护冠心病的作用[37]。体外验证表明可显著促进活性的菌株是从肠道中分离的Lactobacillus murinus EU04,提示直接补充鼠乳杆菌可恢复乳杆菌在肠道菌群内的比例,重塑菌群结构,进而调节血压[38]。
5 结论
本研究通过分析神香苏合丸体内给药对心肌梗死大鼠肠道菌群结构的影响及体外实验验证神香苏合丸对益生菌生长的作用,证明了神香苏合丸对心肌梗死大鼠肠道菌群具有改善作用,尤其是促进肠道益生菌的生长,推测肠道益生菌可能是神香苏合丸改善心肌梗死的潜在靶标。在后续研究中会进行粪菌移植实验进一步明确肠道菌群对神香苏合丸治疗心肌梗死的靶点作用,阐明药物直接依赖的肠道菌群调节机制,为后续益生菌的开发和利用提供理论依据。
