参芎葡萄糖注射液在正常和急性心肌缺血大鼠体内的药动学差异
2022-03-04张静雅刘利琴李容陆苑潘洁刘亭孙佳
张静雅 刘利琴 李容 陆苑 潘洁 刘亭 孙佳


中圖分类号 R969.1 文献标志码 A 文章编号 1001-0408(2022)04-0433-06
DOI 10.6039/j.issn.1001-0408.2022.04.09
摘 要 目的 比较参芎葡萄糖注射液(SGI)中盐酸川芎嗪、丹参素、迷迭香酸在正常和急性心肌缺血(AMI)模型大鼠体内的药动学差异。方法 将雄性SD大鼠随机分为正常组和模型组,每组9只。模型组大鼠采用盐酸异丙肾上腺素造模法复制AMI模型。每组各取3只大鼠进行模型验证后,剩余6只大鼠尾静脉注射SGI(12 mL/kg)或等体积生理盐水,并分别于给药后0.083、0.167、0.333、0.5、0.75、1、1.5、2、3、5 h经眼眶静脉丛采血0.3 mL。以木犀草苷为内标,采用超高效液相色谱-串联质谱法检测血浆中盐酸川芎嗪、丹参素、迷迭香酸的质量浓度,采用WinNonlin 8.1软件拟合药动学参数,采用SPSS 18.0软件进行统计学分析。结果 盐酸川芎嗪、丹参素、迷迭香酸检测质量浓度的线性范围分别为0.06~29.96、0.01~5.15、0.006~3.09 μg/mL(r均大于0.99),方法学考察结果均符合2020年版《中国药典》的相应要求。与正常大鼠比较,AMI模型大鼠体内盐酸川芎嗪的CLz显著升高(P<0.05);丹参素的t1/2和Vz均显著延长或升高(P<0.05),但cmax和AUC0-5 h均显著降低(P<0.05);迷迭香酸的AUC0-5 h显著降低(P<0.05)。结论 SGI中的丹参素、迷迭香酸在AMI模型大鼠体内的暴露量均低于正常大鼠,盐酸川芎嗪在AMI模型大鼠体内的消除强于正常大鼠。
关键词 参芎葡萄糖注射液;急性心肌缺血;超高效液相色谱-串联质谱法;药动学;大鼠
Pharmacokinetic difference of Shenxiong glucose injection in normal and acute myocardial ischemia rats
ZHANG Jingya1,2,LIU Liqin1,2,LI Rong1,2,LU Yuan1,PAN Jie3,LIU Ting1,SUN Jia1(1. Guizhou Key Laboratory of Pharmaceutics/State Key Laboratory of Efficacy and Utilization of Medicinal Plants, Guizhou Medical University, Guiyang 550004, China; 2. School of Pharmacy, Guizhou Medical University, Guiyang 550004, China; 3. Engineering Research Center for Development and Application of Ethnic Medicine and Traditional Chinese Medicine of Ministry of Education, Guizhou Medical University, Guiyang 550004, China)
ABSTRACT OBJECTIVE To compare the pharmacokinetics of ligustrazine hydrochloride, salvianic acid and rosemarinic acid from Shenxiong glucose injection (SGI) in normal and acute myocardial ischemia (AMI) rats. METHODS Male SD rats were randomly divided into normal group and model group, with 9 rats in each group. AMI model was established by isoproterenol hydrochloride modeling method. Three rats in each group were selected for model verification. The remaining 6 rats in each group were given SGI (1.2 mL/kg) or equal volum of normal saline via tail vein; 0.3 mL blood was collected through orbital venous bush 0.083, 0.167, 0.333, 0.5, 0.75, 1, 1.5, 2, 3, 5 h after administration. Using luteoloside as internal standard, the plasma concentrations of ligustrazine hydrochloride, salvianic acid and rosemarinic acid were determined by ultra performance liquid chromatography-tandem mass spectrometry. Pharmacokinetic parameters were fitted by WinNonlin 8.1 software, and statistical analysis was performed by SPSS 18.0 software. RESULTS The linear ranges of ligustrazine hydrochloride, salvianic acid and rosmarinic acid were 0.06-29.96, 0.01-5.15 and 0.006-3.09 μg/mL (all r>0.99), respectively. The results of methodological investigation were all in line with the requirements of Chinese Pharmacopoeia (2020 edition). Compared with normal rats, CLz of ligustrazine hydrochloride in AMI model rats was significantly increased (P<0.05); t1/2 and Vz of salvianic acid were significantly prolonged or increased (P<0.05); but the cmax and AUC0-5 h were significantly decreased (P<0.05); AUC0-5 h of rosmarinic acid was significantly decreased (P<0.05). CONCLUSIONS The exposure levels of salvianic acid and rosmarinic acid in SGI are lower in AMI model rats than in normal rats, and the elimination of ligustrazine hydrochloride in AMI model rats is stronger than that in normal rats.
KEYWORDS Shenxiong glucose injection; acute myocardial ischemia; ultra performance liquid chromatography-tandem mass spectrometry; pharmacokinetic; rat
根据《<中国心血管病与疾病报告2020>概述》,我国现有心血管疾病患者约为3.3亿,病死率居各病因首位,占居民疾病死亡构成的40%以上[1]。急性心肌缺血(acute myocardial ischemia,AMI)是指由各种原因引起的心肌相对或绝对供血不足、心肌细胞缺氧,是心血管疾病的一种常见类型。参芎葡萄糖注射液(Shenxiong glucose injection,SGI)常用于临床治疗心血管疾病,对心绞痛、冠心病、急性脑梗死、无症状心肌缺血等具有显著疗效。SGI是由盐酸川芎嗪和丹参配伍而成的中药注射剂,其化学成分主要为盐酸川芎嗪、丹参素、迷迭香酸等水溶性成分。其中,川芎嗪是从川芎中分离提取的生物碱单体,具有保护脑组织(包括抑制脑缺血再灌注损伤、抗偏头痛、保护脑神经)、抑制血栓形成和血小板聚集、抗心肌缺血及抑制子宫平滑肌收缩等作用[2];丹参素是丹参最重要的水溶性成分,被广泛用于冠心病心绞痛的临床治疗,具有显著改善微循环、抗内皮损伤、抗氧化、抗炎、抗血小板聚集等药理活性[3-4],同时也可通过清除自由基和降低心肌损伤标志物水平而起到心肌保护的作用[5];迷迭香酸也是丹参的主要活性成分之一,具有抗氧化、抗炎等作用,可减少活性氧的产生,调节机体脂质过氧化物及抗氧化酶水平,从而减轻心肌细胞损伤[6]。
现代研究表明,疾病会影响药物在机体内的药动学行为,比如:川芎嗪在子宫内膜异位症模型大鼠体内的吸收较正常大鼠有增加的趋势,消除也有所加快[7];丹参素在脑缺血再灌注模型大鼠体内的滞留时间较正常大鼠长,消除减慢[8]。基于此,本研究通过建立测定大鼠血浆中川芎嗪、丹参素、迷迭香酸的超高效液相色谱-串联质谱法,分别测定上述成分在正常和AMI模型大鼠体内的血药浓度并进行药动学参数拟合,从而比较SGI在正常和AMI模型大鼠体内的药动学特征,为提高中药注射剂SGI在临床使用的有效性和安全性提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括Acquity UPLC-TQD型超高效液相色谱-三重四极杆质谱串联仪、Acquity UPLC Ⅰ-Class/Xevo TQ-S型超高效液相色谱-三重四极杆质谱串联仪(美国Waters公司,以下分别简称“仪器Ⅰ、Ⅱ”),MTN-2800D型氮吹浓缩装置(天津奥特赛恩斯仪器有限公司),CQ250A-TS型超声波清洗机(上海跃进医用光学器械厂),ZH-2型涡旋混合器(天津药典标准仪器厂),EL204/AE240型电子天平[梅特勒-托利多仪器(上海)有限公司],WP-UP-Ⅱ-20型超纯水机(四川沃特尔科技发展有限公司),Allegra 64R型低温高速离心机(美国Beckman Coulter公司),Multiskan Ascent型多功能酶标仪(美国Thermo Fisher Scientific公司),CX41型显微镜(日本Olympus公司)等。
1.2 主要药品与试剂
SGI(批号07200801,规格100 mL ∶ 盐酸川芎嗪100 mg,丹参相当于丹参素20 mg)购自贵州景峰注射剂有限公司;盐酸异丙肾上腺素原料药(批号G2028261,纯度≥99%)购自上海阿拉丁生化科技股份有限公司;丹参素、盐酸川芎嗪、迷迭香酸、木犀草苷(内标)对照品(批号分别为H09N10S102463、X08O9C71471、Y16A9K-
67403、AF20072618,纯度均不低于98%)均购自上海源叶生物科技有限公司;氯化钠注射液(批号E121081301,规格100 mL ∶ 5 g,作生理盐水用)购自贵州科伦药业有限公司;苏木精-伊红染液(批号P10011)购自武汉市皮诺飞生物科技有限公司;天冬氨酸转氨酶(aspartate aminotransferase,AST)试剂盒、肌酸激酶同工酶(creatine kinase-isoenzyme MB,CK-MB)试剂盒(批号分别为20200318、20200419)均购自南京建成生物工程研究所;乙腈为色谱纯,其余试剂均为分析纯或实验室常用规格,水为蒸馏水。
1.3 动物
SPF级雄性SD大鼠共18只,体质量为(230±20) g,由贵州医科大学实验动物中心提供,实验动物生产许可证号为SCXK(黔)2018-0001。
2 方法與结果
2.1 溶液的配制
2.1.1 对照品溶液和内标溶液的配制 精密称取盐酸川芎嗪、丹参素、迷迭香酸、内标对照品各适量,用甲醇溶解并定容至10 mL,制成质量浓度分别为0.999、1.030、1.029、1.052 mg/mL的贮备液,置于-20 ℃下保存,备用。临用前,取上述贮备液适量,用50%甲醇稀释成所需质量浓度,即得对照品溶液和内标溶液。
2.1.2 盐酸异丙肾上腺素溶液的配制 精密称取盐酸异丙肾上腺素原料药0.1 g,置于10 mL量瓶中,用生理盐水溶解并定容,制成质量浓度为10 mg/mL的盐酸异丙肾上腺素溶液,临用前配制。
2.2 分组、造模与给药
将18只大鼠随机分为正常组和模型组,每组9只。模型组大鼠皮下注射盐酸异丙肾上腺素溶液(50 mg/kg)以复制AMI模型,正常组大鼠皮下注射等体积生理盐水,每天1次,连续2 d[9]。于末次注射后24 h,随机在正常组和模型组中各取3只大鼠进行模型验证:于尾静脉取血,测定血清中AST、CK-MB水平;另取心脏,用10%甲醛溶液固定后,以石蜡包埋、常规切片,经苏木精-伊红染色后观察心肌组织的病理变化(图1)。数据以 x±s表示,采用SPSS 18.0软件进行t检验,检验水准α=0.05。模型验证结果显示,正常组和模型组大鼠血清中AST水平分别为(1.70±0.11)、(9.88±1.09) U/L(n=3),CK-MB水平分别为(11.08±0.56)、(13.57±0.54)ng/mL(n=3),模型组AST、CK-MB水平均显著高于正常组(P<0.05)。由图1可见,与正常组比较,模型组大鼠心肌变性坏死病灶广泛,可见部分炎症细胞浸润、成纤维细胞增生、血栓形成,说明AMI模型造模成功。
取正常组和模型组剩余6只大鼠,单次尾静脉注射SGI(12 mL/kg,参照临床SGI成人单日静脉滴注剂量100~200 mL进行换算,相当于盐酸川芎嗪9.880 mg/kg、丹参素2.772 mg/kg、迷迭香酸0.036 mg/kg)或等体积生理盐水。分别于给药后0.083、0.167、0.333、0.5、0.75、1、1.5、2、3、5 h经眼眶静脉丛取血约0.3 mL,置于涂有肝素的塑料离心管中,以6 000 r/min离心6 min,取上层血浆,于-20 ℃下保存,备用。
2.3 血浆样品处理
取血浆样品50 μL,加入甲醇25 μL、乙腈200 μL和内标溶液(测定盐酸川芎嗪时,内标溶液的质量浓度为10.52 μg/mL;测定丹参素、迷迭香酸时,内标溶液的质量浓度为0.105 μg/mL)10 μL,涡旋混匀3 min,超声(功率300 W,频率40 kHz,下同)10 min,以14 000 r/min离心10 min,弃去上清液,沉淀加入1 mol/L盐酸15 μL、乙酸乙酯500 μL,涡旋混匀3 min,超声10 min,以14 000 r/min离心10 min,取上清液,再重复“加入1 mol/L盐酸15 μL……离心10 min”操作2次,合并3次上清液,于30 ℃下以氮气流吹干,残渣加8%乙腈150 μL复溶,取上清液进样分析。
2.4 色谱与质谱条件
2.4.1 色谱条件 以Waters BEH C18(2.1 mm×50 mm,1.7 μm)为色谱柱,Waters Van Guard BEH C18(2.1 mm×50 mm,1.7 μm)为保护柱;以0.1%甲酸溶液(A)-0.1%甲酸乙腈溶液(B)为流动相进行梯度洗脱(0~1.0 min,8%B;1.0~1.5 min,8%B→30%B;1.5~2.0 min,30%B→40%B;2.0~2.5 min,40%B→90%B;2.5~3.0 min,90%B;3.0~4.0 min,90%B→8%B);流速为0.35 mL/min;柱温为40 ℃;进样量为1 μL。
2.4.2 质谱条件 由于SGI中各化合物的含量差異较大,同一仪器不能兼顾所有成分的测定,故本研究采用仪器Ⅰ测定盐酸川芎嗪,采用仪器Ⅱ测定丹参素、迷迭香酸。具体条件如下:离子源均为电喷雾电离源,离子源温度均为120 ℃;毛细管电离电压均为3 kV;去溶剂气流速均为650 L/h,去溶剂气温度均为350 ℃;反吹气均为氮气,流速均为50 L/h;碰撞气均为氩气,流速均为0.16 mL/min;扫描方式均为选择离子检测;质谱数据采集及处理软件均为Masslynx 4.1工作站。仪器Ⅰ中,用于定量分析的离子对分别为m/z 137.1→55.1(盐酸川芎嗪)、m/z 449.1→250.9(内标),锥孔电压分别为40、25 V,碰撞电压分别为20、30 V;仪器Ⅱ中,用于定量分析的离子对分别为m/z 197.5→162.7(丹参素)、m/z 359.0→197.0(迷迭香酸)、m/z 449.1→250.9(内标),锥孔电压分别为25、20、25 V,碰撞电压分别为20、20、30 V。
2.5 方法学考察
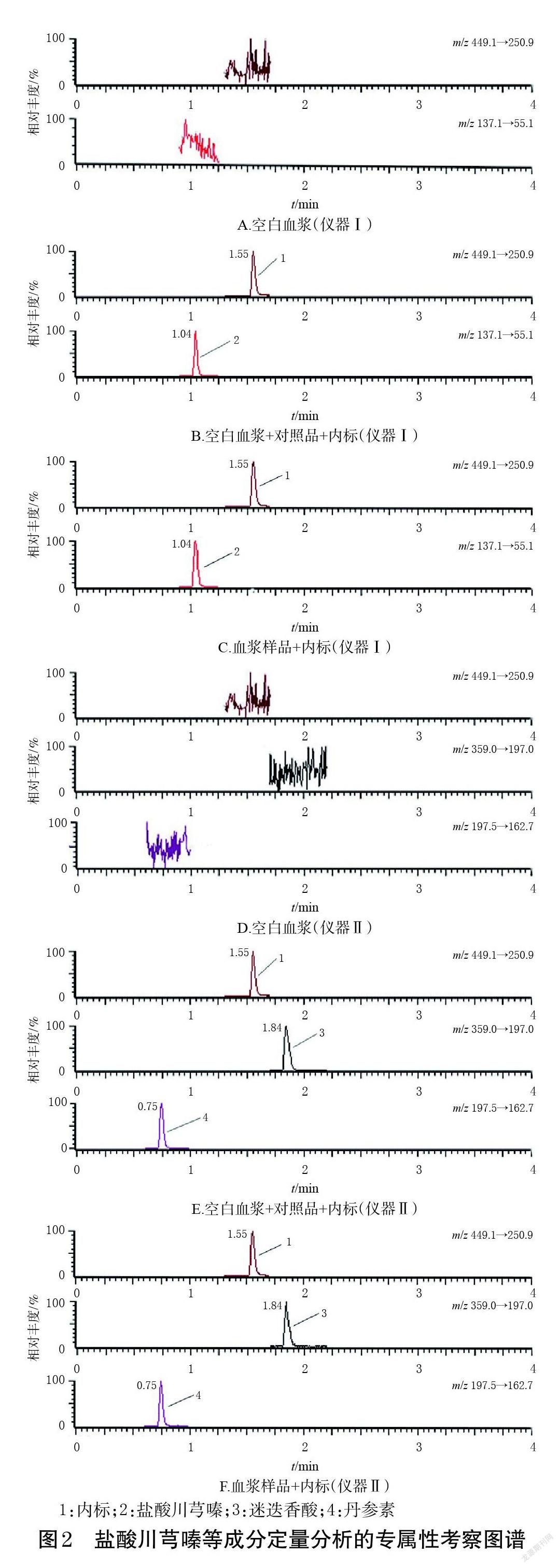
2.5.1 专属性考察 取大鼠空白血浆,除不加内标外其余按“2.3”项下方法处理后,再按“2.4”项下条件进样分析,记录色谱图(图2A、图2D);将盐酸川芎嗪、丹参素、迷迭香酸质量浓度分别为1.87、0.32、0.19 μg/mL的对照品溶液加至空白血浆中,按“2.3”项下方法处理后,再按“2.4”项下条件进样分析,记录色谱图(图2B、图2E);取模型组大鼠注射SGI后5 min采集的血浆样品,按“2.3”项下方法处理后,再按“2.4”项下条件进样分析,记录色谱图(图2C)。由图2可见,盐酸川芎嗪、丹参素、迷迭香酸及内标的保留时间分别为1.04、0.75、1.84、1.55 min,各色谱峰分离良好,内源性杂质不干扰待测成分的检测,符合2020年版《中国药典》的相应要求[10]。
2.5.2 标准曲线绘制和定量下限考察 按“2.1.1”项下方法配制不同质量浓度的系列对照品溶液,分别移取各对照品溶液50 μL至1.5 mL离心管中,加入空白血浆50 μL,依次制成盐酸川芎嗪质量浓度分别为0.06、0.12、0.23、0.47、0.94、1.87、3.74、7.49、14.98、29.96 μg/mL,丹参素质量浓度分别为0.01、0.02、0.04、0.08、0.16、0.32、0.64、1.29、2.57、5.15 μg/mL,迷迭香酸质量浓度分别为0.006、0.01、0.02、0.05、0.10、0.19、0.38、0.77、1.54、3.09 μg/mL的系列标准血浆样品,按“2.3”项下方法处理后,再按“2.4”项下条件进样分析,记录峰面积。以各成分质量浓度(x)为横坐标、各成分与内标的峰面积比值(y)为纵坐标,应用最小二乘法(权重系数为1/x2)进行线性回归。结果显示,盐酸川芎嗪的回归方程为y=7.790 6x+2.315 2(r=0.992 2),线性范围为0.06~29.96 μg/mL,定量下限为0.06 μg/mL;丹参素的回归方程为y=2.334 6x-0.067 9(r=0.998 8),线性范围为0.01~5.15 μg/mL,定量下限为0.01 μg/mL;迷迭香酸的回归方程为y=9.321 4x-0.400 4(r=0.995 7),线性范围为0.006~3.09 μg/mL,定量下限为0.006 μg/mL。
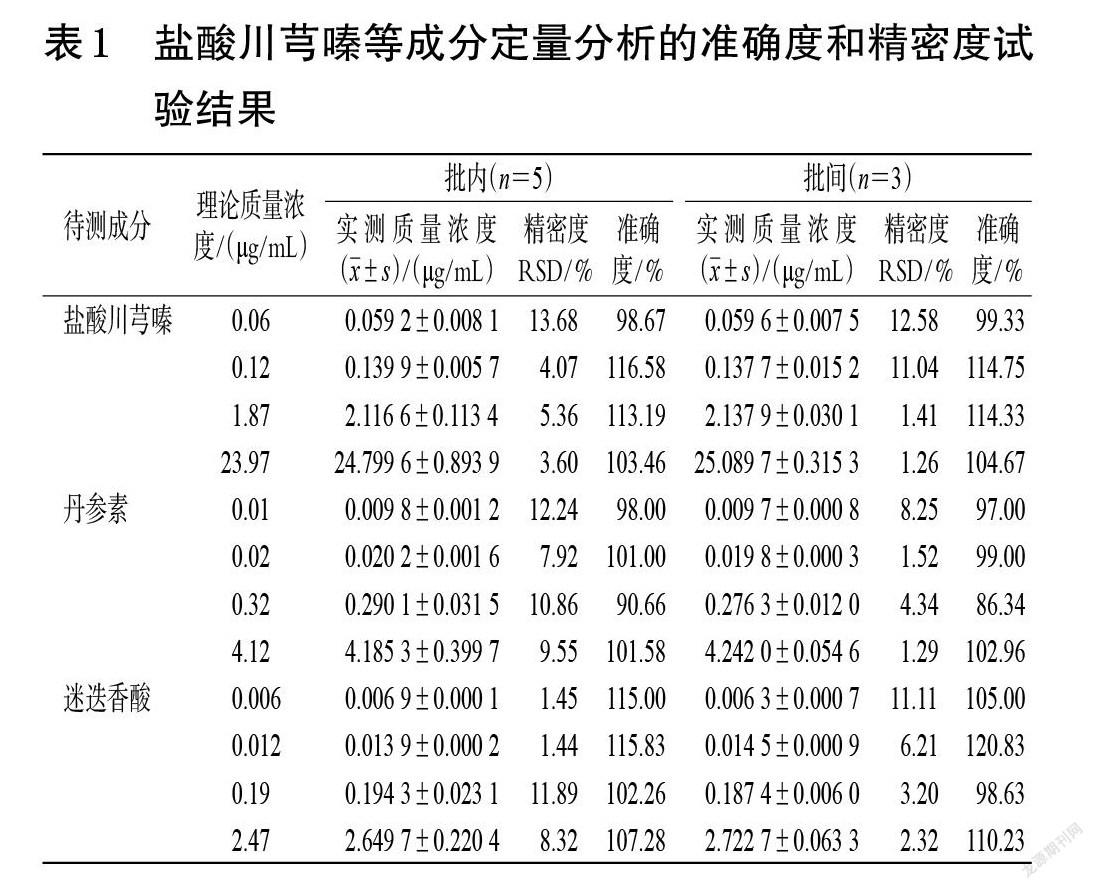
2.5.3 准确度和精密度试验 按“2.5.2”项下方法配制各成分定量下限和低、中、高质量浓度(盐酸川芎嗪:0.06、0.12、1.87、23.97 μg/mL,丹参素:0.01、0.02、0.32、4.12 μg/mL,迷迭香酸:0.006、0.012、0.19、2.47 μg/mL)的标准血浆样品,按“2.3”项下方法处理后,再按“2.4”项下条件进样分析,每个分析批次平行操作5份样品,连续测定3 d,考察准确度和精密度。结果显示,本方法准确度和精密度试验结果均符合2020年版《中国药典》的相应要求[10],见表1。
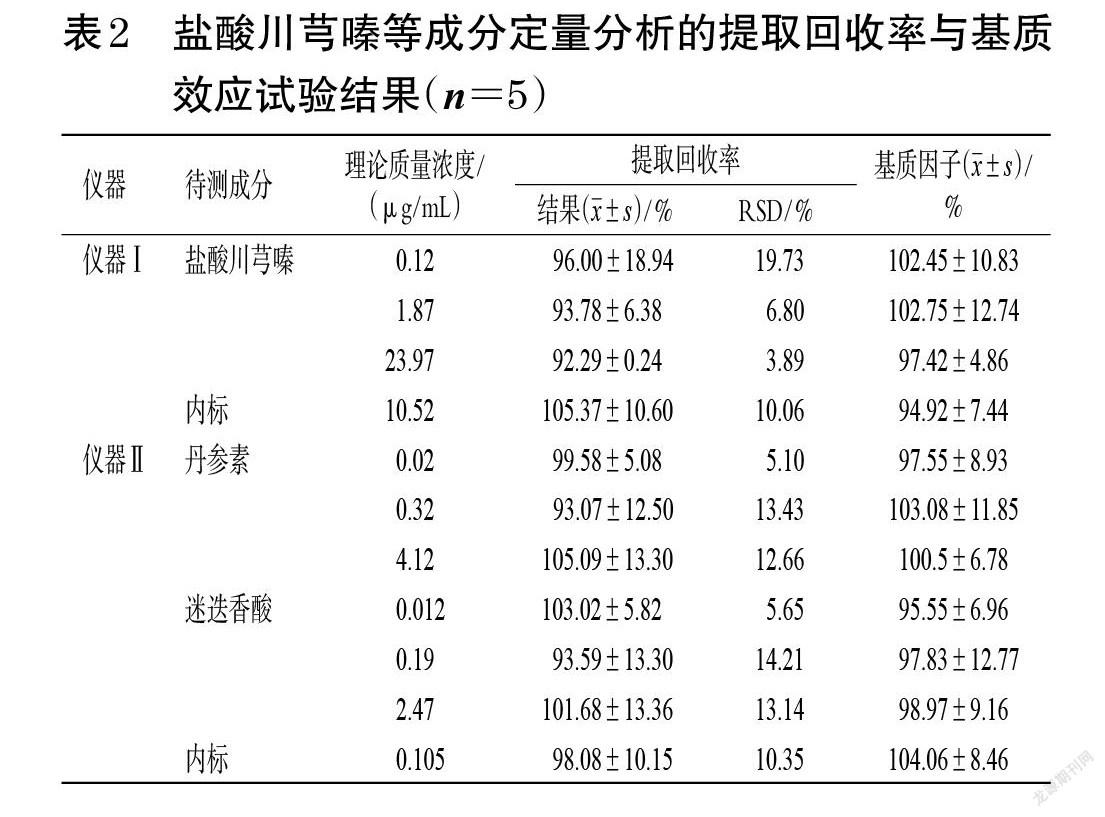
2.5.4 提取回收率和基质效应试验 按“2.5.2”项下方法配制各成分低、中、高质量浓度(盐酸川芎嗪:0.12、1.87、23.97 μg/mL,丹参素:0.02、0.32、4.12 μg/mL,迷迭香酸:0.012、0.19、2.47 μg/mL)的标准血浆样品,每个浓度平行制备5份,按“2.3”项下方法处理后,再按“2.4”项下条件进样分析,记录峰面积(A)。将不同来源的空白血浆按“2.3”项下方法处理后,再加入相应质量浓度的对照品溶液和内标溶液,使最终质量浓度与标准血浆样品对应,每个质量浓度平行制备5份,按“2.4”项下条件进样分析,记录峰面积(B)。分别配制与标准血浆样品中对照品和内标相同质量浓度的标准溶液,每个质量浓度平行制备5份,按“2.4”项下条件进样分析,记录峰面积(C)。按如下公式计算提取回收率和基质因子:提取回收率(%)=A/B×100%,基质因子(%)=B/C×100%,结果见表2。由表2可见,低、中、高质量浓度标准血浆样品中盐酸川芎嗪、丹参素、迷迭香酸的提取回收率、基质因子均符合2020年版《中国药典》的相应要求[10]。
2.5.5 稳定性试验 按“2.5.2”项下方法配制低、中、高质量浓度(盐酸川芎嗪:0.12、1.87、23.97 μg/mL,丹参素:0.02、0.32、4.12 μg/mL,迷迭香酸:0.012、0.19、2.47 μg/mL)的标准血浆样品,每个质量浓度平行制备5份,考察其在室温(25 ℃)存放12 h、冻融(-80 ℃~室温)循环3次、4 ℃存放24 h的稳定性。结果显示,各低、中、高质量浓度标准血浆样品在上述条件下峰面积的RSD均小于15%(n=5),符合2020年版《中国药典》的相应要求[10]。
2.6 药动学研究
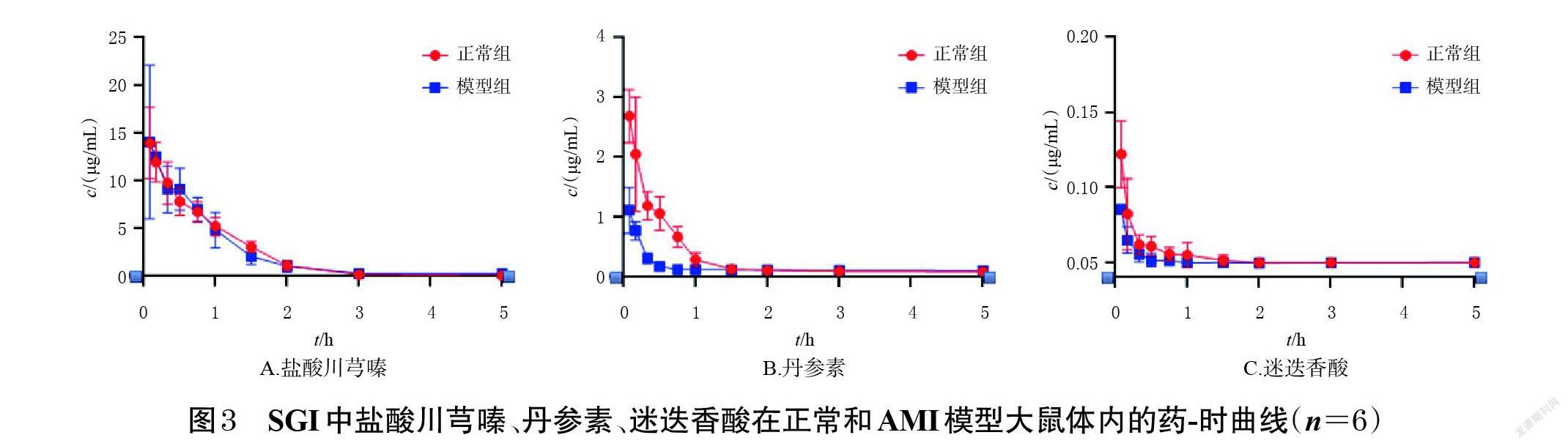
2.6.1 药-时曲线的绘制 取“2.2”项下冻存的血浆样品,放置至室温,按“2.3”项下方法处理后,再按“2.4”项下条件进样分析,记录峰面积并按随行标准曲线计算各待测成分的质量浓度,采用SPSS 18.0软件绘制平均药-时曲线,结果见图3。
2.6.2 药动学参数的计算 采用WinNonlin 8.1软件以非房室模型計算盐酸川芎嗪、丹参素、迷迭香酸的药动学参数。数据以x±s表示,采用SPSS 18.0软件,先将cmax和AUC进行对数转化后再进行t检验;对tmax进行秩和检验,对t1/2、CLz、Vz进行t检验。检验水准α=0.05。结果见表3。由表3可见,与正常组比较,模型组大鼠体内盐酸川芎嗪的CLz显著升高(P<0.05),表明AMI模型状态会增强盐酸川芎嗪在大鼠体内的消除;与正常组比较,模型组大鼠体内丹参素的t1/2和Vz均显著延长或升高(P<0.05),cmax和AUC0-5 h均显著降低(P<0.05),表明AMI模型状态会降低丹参素在大鼠体内的暴露量,延长其代谢时间;与正常组比较,模型组大鼠体内迷迭香酸的AUC0-5 h显著降低(P<0.05),说明AMI模型状态会降低迷迭香酸在大鼠体内的暴露量。
3 讨论
本课题组前期参考了盐酸加乙酸乙酯萃取法[11]和乙腈沉淀蛋白法[12]对血浆样品处理的影响,结果发现,加入乙腈后再加入盐酸和乙酸乙酯较单独采用萃取法或沉淀蛋白法效果更好,先加入乙腈能更好地辅助提取血浆中的盐酸川芎嗪,进一步加入盐酸后能更好地辅助提取血浆中的迷迭香酸。此外,本课题组前期还对萃取次数进行了考察,结果发现,在酸性条件下萃取血浆2次对迷迭香酸的提取效率最高。
盐酸异丙肾上腺素为β受体激动药,能加快大鼠心率,增加其心肌耗氧量,加重其心脏负荷,从而导致其心肌细胞坏死、心肌纤维断裂及变性等[13]。有研究表明,由盐酸异丙肾上腺素所致的大鼠心肌缺血损伤及心肌酶指标的变化都与AMI患者的病变特征相似[14]。因此,本研究采用盐酸异丙肾上腺素造模法复制AMI模型。
病理状态会通过改变药物代谢酶、药物转运体、肠道菌群等因素而影响药物的体内过程[15-17],但注射给药避开了胃肠道吸收转化,药物可直接进入血液系统,因此药物代谢酶成为了影响注射剂有效成分体内行为的主要因素。现有文献报道显示,心肌缺血状态下,低密度脂蛋白的氧化能力增强,会导致冠状动脉内皮细胞中细胞色素P450(cytochrome P450,CYP)单加氧酶下调,使得内皮细胞中CYP1A1、CYP2A6/7、CYP2C9、CYP2E1、CYP2J2的表达降低;同时,有文献报道,丹参中咖啡因是肝中CYP1A2、CYP2C9和CYP2E1同工酶的有效抑制剂[18],CYP3A是盐酸川芎嗪的Ⅰ相代谢酶,羟基川芎嗪是其主要代谢产物之一[19]。可见,疾病状态和药物成分都可能对药物代谢酶产生影响,故笔者推测这是SGI中盐酸川芎嗪、丹参素、迷迭香酸在AMI模型状态下药动学参数发生改变的原因,后续将通过在体实验予以验证。
综上所述,SGI中丹参素、迷迭香酸在AMI模型大鼠体内的暴露量均低于正常大鼠,盐酸川芎嗪在AMI模型大鼠体内的消除强于正常大鼠。建议在AMI患者使用SGI时,可适当提高给药剂量或延长使用周期。
参考文献
[ 1 ] 《中国心血管健康与疾病报告2020》编写组.《中国心血管健康与疾病报告2020》概述[J].中国心血管病研究,2021,19(7):582-590.
[ 2 ] 蒲忠慧,代敏,彭成,等.川芎生物碱的物质基础及药理作用研究进展[J].中国药房,2020,31(8):1020-1024.
[ 3 ] 许红蕾,王庭芳,张川.丹参素及其衍生物药理作用机制和应用研究进展[J].中国现代应用药学,2021,38(2):237-243.
[ 4 ] SONG Q T,ZHANG Y Y,HAN X,et al. Potential mechanisms underlying the protective effects of salvianic acid A against atherosclerosis in vivo and vitro[J]. Biomedecine Pharmacother,2019,109:945-956.
[ 5 ] 丁凡,王拥军,张岩.丹参活性成分的药理作用和临床应用研究进展[J].中华中医药杂志,2021,36(2):659-662.
[ 6 ] 马玉,马先林.川芎嗪对心血管的药理作用、临床应用及其效果分析[J].世界最新医学信息文摘,2019,19(30):213,219.
[ 7 ] 冯彬彬,张建海,牛小花,等.川芎嗪、阿魏酸和延胡索乙素在模型与正常大鼠体内药动学比较研究[J].中草药,2015,46(10):1493-1497.
[ 8 ] 艾进超,周惠芬,舒明春,等.丹参素在局灶性脑缺血大鼠体内药动学-药效学相关性研究[J].中国中药杂志,2014,39(14):2751-2755.
[ 9 ] 孙佳,潘洁,秦兰,等.荭草提取物对异丙肾上腺素诱导大鼠急性心肌缺血的作用及机制[J].贵州医科大学学报,2021,46(3):275-280.
[10] 国家药典委员会.中华人民共和国药典:四部[S]. 2020年版.北京:中国医药科技出版社,2020:466-468.
[11] 郑林.参芎葡萄糖注射液药效物质基础及作用机制研究[D].贵阳:贵阳医学院,2015.
[12] 张翠英,章洪,任伟光,等. UPLC-MS/MS测定丹参川芎对药中4种酚酸类成分在大鼠血浆和心脏组织的药代动力学[J].中国中药杂志,2019,44(19):4257-4262.
[13] 李晓华,刘凯,张宁,等.大小剂量盐酸异丙肾上腺素诱发大鼠心肌损伤模型的研究[J].中国实验诊断学,2016,20(2):185-188.
[14] 刘泽娟,吴越,蒋学华,等.丹参川芎嗪注射液中丹参素对盐酸川芎嗪在大鼠体内药动学的影响[J].华西药学杂志,2017,32(2):182-185.
[15] 巩仔鹏,陈颖,张瑞杰,等.疾病状态下的中药药代动力学研究进展[J].中國中药杂志,2015,40(2):169-173.
[16] COBBINA E,AKHLAGHI F. Non-alcoholic fatty liver disease(NAFLD)-pathogenesis,classification,and effect on drug metabolizing enzymes and transporters[J]. Drug Metab Rev,2017,49(2):197-211.
[17] 陈海彬,周红光,李文婷,等.基于肠道菌群的结肠癌防治及与癌毒病机理论的关系[J].中华中医药杂志,2019,34(12):5796-5800.
[18] SHERIFFDEEN M M,ALEHAIDEB Z I,LAW F C P. Caffeine/Angelica dahurica and caffeine/Salvia miltiorrhiza metabolic inhibition in humans:in vitro and in vivo studies[J]. Complement Ther Med,2019,46:87-94.
[19] FENG S,HE X,ZHONG P R,et al. A metabolism-based synergy for total coumarin extract of radix Angelicae dahu- ricae and ligustrazine on migraine treatment in rats[J]. Molecules,2018,23(5):E1004.
(收稿日期:2021-11-08 修回日期:2022-01-19)
(编辑:邹丽娟)
