毛大丁草药材的质量标准提升
2022-03-04杨贵香吴莹莹马雪刘春花郑林李勇军王永林
杨贵香 吴莹莹 马雪 刘春花 郑林 李勇军 王永林



中圖分类号 R284.1 文献标志码 A 文章编号 1001-0408(2022)04-0408-06
DOI 10.6039/j.issn.1001-0408.2022.04.05
摘 要 目的 提升毛大丁草药材的质量标准。方法 观察毛大丁草药材的性状并对其粉末进行显微鉴别;按2020年版《中国药典》(四部)通则方法测定该药材中的水分、总灰分、酸不溶性灰分和醇溶性浸出物;采用高效液相色谱法测定该药材中紫花前胡苷、木犀草素-7-O-β-D-芦丁糖苷、木犀草苷、芹菜素-7-O-β-D-芦丁糖苷、芹菜素-7-O-β-D-葡萄糖苷、异紫花前胡内酯的含量。结果 毛大丁草药材呈皱缩状,密被灰白色绵毛;须根多数,表面呈灰褐色或灰棕色,质脆,易折断,断面呈黄白色,中央有一明显细小木心。其粉末呈棕褐色,镜下可见非腺毛、石细胞、草酸钙方晶、导管、纤维等。15批药材样品的水分、总灰分、酸不溶性灰分、醇溶性浸出物测定值分别为8.63%~11.34%、10.39%~14.93%、3.29%~6.37%、9.03%~15.02%,平均值分别为10.01%、12.26%、4.61%、12.36%。紫花前胡苷、木犀草素-7-O-β-D-芦丁糖苷、木犀草苷、芹菜素-7-O-β-D-芦丁糖苷、芹菜素-7-O-β-D-葡萄糖苷、异紫花前胡内酯的质量浓度分别在3.87~154.88、1.64~65.41、1.60~64.00、1.92~76.96、1.27~50.93、0.40~15.89 μg/mL范围内与各自峰面积成良好的线性关系(r均不低于0.999 1);精密度、稳定性(24 h)、重复性试验的RSD均小于3%;平均加样回收率分别为101.88%、100.89%、102.64%、95.75%、96.71%、103.48%,RSD分别为0.55%、0.43%、0.34%、0.49%、0.47%、0.37%(n=6);样品中上述6种成分的含量分别为0.152 7~0.852 2、0.084 5~0.669 7、0.136 7~0.961 0、0.126 0~1.193 2、0.128 8~1.102 2、0.046 9~0.678 0 mg/g。结论 所建方法可用于毛大丁草药材的质量控制。初步拟定毛大丁草药材中水分不得过12.0%,总灰分不得过15.0%,酸不溶性灰分不得过6.0%,醇溶性浸出物不得少于9.0%,木犀草苷、芹菜素-7-O-β-D-葡萄糖苷的含量不得少于0.016%。
关键词 毛大丁草;质量标准;高效液相色谱法;性状鉴别;显微鉴别;木犀草苷;芹菜素-7-O-β-D-葡萄糖苷
Improvement of the quality standard of Gerbera piloselloides
YANG Guixiang1,2,WU Yingying1,3,MA Xue1,LIU Chunhua1,ZHENG Lin4,LI Yongjun1,WANG Yonglin4(1. Engineering Research Center for the Development and Application of Ethnic Medicine and TCM/State Key Laboratory of Functions and Applications of Medicinal Plants, Guizhou Medical University, Guiyang 550004, China; 2. School of Pharmacy, Guizhou Medical University, Guiyang 550004, China; 3. Dept. of Pharmacy, Bijie Medical College, Guizhou Bijie 551700, China; 4. Guizhou Provincial Key Laboratory of Pharmaceutics, Guizhou Medical University, Guiyang 550004, China)
ABSTRACT OBJECTIVE To improve the quality standard for Gerbera piloselloides. METHODS The properties of G. piloselloides were observed and microscopic identification was conducted for powder. The moisture, total ash, acid-insoluble ash and ethanol-soluble extract were detected according to the method stated in 2020 edition of Chinese Pharmacopoeia (part Ⅳ). The contents of nodakenin, luteolin-7-O-β-D-lutinoside, luteoloside, apigenin-7-O-β-D-lutinoside, apigenin-7-O-β-D-glucopyranoside and marmesin were determined by high performance liquid chromatography method. RESULTS G. piloselloides were shrunken,densely covered with thick white cotton wool, with many fibrous roots; the surface was taupe or gray-brown; its texture was brittle and easy to break; the cross section was yellow-white, and there was an obvious small wooden heart in the center. Its powder was tan, and non-glandular hairs, stone cells, calcium oxalate cubes, ducts,fibers could be seen under microscope. The measured values of moisture, total ash,acid-insoluble ash and alcohol-soluble extract for 15 batches of samples were 8.63%-11.34%, 10.39%-14.93%, 3.29%-6.37% and 9.03%-15.02%, respectively; average values were 10.01%, 12.26%, 4.61%, 12.36%. The linear ranges of nodakenin, luteolin-7-O-β-D-rutinoside, luteoloside, apigenin- 7-O-β-D-lutinoside, apigenin-7-O-β-D-glucopyranoside and marmesin were 3.87-154.88, 1.64-65.41, 1.60-64.00, 1.92-76.96, 1.27-50.93, 0.40-15.89 μg/mL, respectively (r≥0.999 1). RSDs of precision, stability (24 h) and repeatability tests were all less than 3%. The average recoveries were 101.88%, 100.89%, 102.64%, 95.75%, 96.71% and 103.48%, respectively; RSDs were 0.55%, 0.43%, 0.34%, 0.49%, 0.47% and 0.37%, respectively (n=6); the contents of above 6 components were 0.152 7-0.852 2, 0.084 5-0.669 7, 0.136 7-0.961 0, 0.126 0-1.193 2, 0.128 8-1.102 2, 0.046 9-0.678 0 mg/g. CONCLUSIONS The established method can be used for the quality control of G. piloselloides. It is preliminarily proposed that the moisture in G. piloselloides is not more than 12.0%; the total ash is not more than 15.0%, the acid-insoluble ash is not more than 6.0%, the alcohol-soluble extract is not less than 9.0%; the contents of luteoloside and apigenin-7-O-β-D-glucopyranoside are not less than 0.016%.
KEYWORDS Gerbera piloselloides; quality standard; high performance liquid chromatography method; property identification; microscopic identification; cynaroside; apigenin-7-O-β-D-glucopyranoside
毛大丁草,又名小一枝箭、兔耳风、白眉等,为菊科植物毛大丁草Gerbera piloselloides(L.)Cass.的干燥全草[1],主要分布于我国西藏、云南、四川、贵州、广西等地[2]。该药材收载于2003年版《贵州省中药材、民族药材质量标准》中,为贵州省少数民族常用药材[3]。据文献报道,该药材中含有多种生物活性物质,如糖苷类、黄酮类、香豆素类等,与其镇咳、祛痰、平喘、抗菌活性密切相关[4-6]。毛大丁草以全草入药,功效为宣肺止咳、发汗利水、利气活血,常用于治疗伤风咳嗽、哮喘、水肿、小儿食积等[7]。其饮片为醒脾养儿颗粒的主药,而醒脾养儿颗粒具有健脾理气、祛风除湿等作用,常用于治疗由脾虚引起的小儿厌食、腹泻、盗汗、遗尿等相关病症[8]。在2003年版《贵州省中药材、民族药材质量标准》中,毛大丁草药材的质量控制项目仅有性状及薄层鉴别,并无含量测定项,不能有效地控制药材质量。近年来,已有学者建立了该药材中熊果苷、大丁苷和绿原酸类、黄酮类成分的含量测定方法[9-11]。为了更全面地控制该药材质量,本研究对15批毛大丁草药材进行了性状和显微鉴别,并对药材中水分、总灰分、酸不溶性灰分、醇溶性浸出物进行了测定;同时,建立了高效液相色谱法,对该药材中6种结构明确、含量较高的化学成分(紫花前胡苷、木犀草素-7-O-β-D-芦丁糖苷、木犀草苷、芹菜素-7-O-β-
D-芦丁糖苷、芹菜素-7-O-β-D-葡萄糖苷、异紫花前胡内酯)进行了含量测定;根据上述测定结果设定了限量指标,增补了毛大丁草药材的定性和定量评价方法,以期为其质量标准的提升提供科学依据。
1 材料
1.1 主要仪器
本研究所用的主要仪器有CX41型显微镜(日本Olympus公司)、S60型显微成像系统(广州市明美科技有限公司)、Ultimate3000型高效液相色谱仪(美国Thermo Fisher Scientific公司)、EL204型萬分之一电子天平[梅特勒-托利多仪器(上海)有限公司]、KQ5200E型超声波清洗机(昆山市超声仪器有限公司)、GZX-9030MBE型电热鼓风干燥箱(上海博迅实业有限公司医疗设备厂)等。
1.2 药材与主要试剂
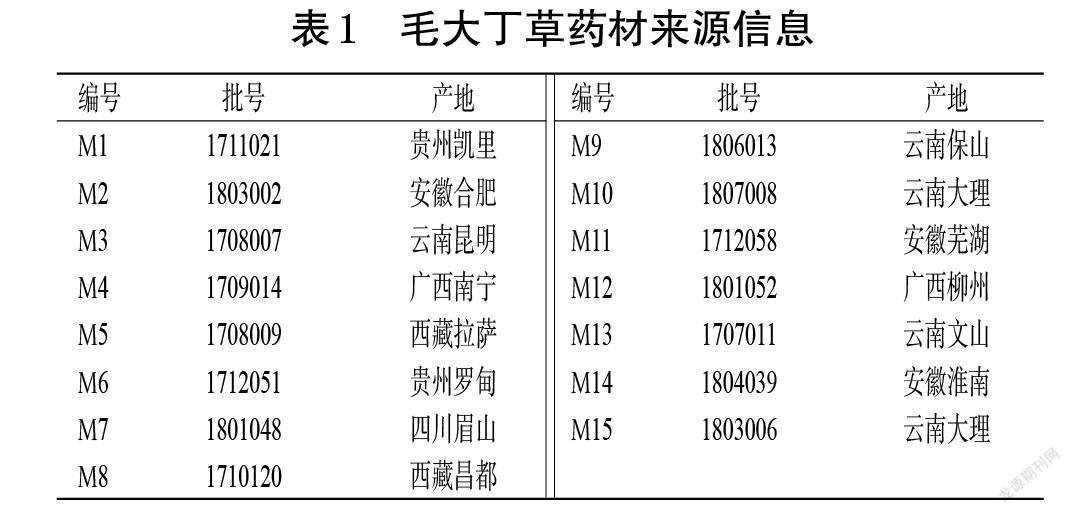
15批毛大丁草药材收集自贵州、云南、四川、安徽、广西和西藏6个省份(表1),经贵州省药物制剂重点实验室生药学教研室刘春花副教授鉴定,均为菊科大丁草属植物毛大丁草G. piloselloides(L.)Cass.的干燥全草。紫花前胡苷、木犀草素-7-O-β-D-芦丁糖苷、木犀草苷、芹菜素-7-O-β-D-芦丁糖苷、芹菜素-7-O-β-D-葡萄糖苷、异紫花前胡内酯对照品均为本课题组分离纯化而得,采用高效液相色谱法以峰面积归一化法测定其纯度均大于98%;乙腈、甲醇(国药集团化学试剂有限公司)为色谱纯,其余试剂均为分析纯,水为超纯水。
2 方法与结果
2.1 性状鉴别
毛大丁草药材呈皱缩状,长15~25 cm,根茎粗短,密被灰白色绵毛。须根多数,长可达12 cm,直径1~2 mm;表面呈灰褐色或灰棕色,质脆,易折断;断面呈黄白色,中央有一明显细小木心。叶基生,皱缩,易破碎;完整叶片展平后呈椭圆形或倒卵形,全缘,长3~10 cm,宽1.5~4 cm,叶面呈褐黑色或浅黄绿色,背面密被灰白色绵毛。头状花序单生于花梗顶端,花梗长10~40 cm,中空。气微,味涩。毛大丁草药材性状鉴别图见图1。
2.2 显微鉴别
毛大丁草药材的粉末呈棕褐色。非腺毛极多,单细胞,表面光滑,大多碎断呈纤维样,有的基部膨大,直径11~27 μm。石细胞呈类长方形或类椭圆形,有的壁厚,孔沟明显,胞腔较小;有的壁较薄,胞腔大,孔沟不明显;直径32~92 μm。草酸钙方晶散在,直径7~15 μm。导管多为梯纹或孔纹,也可见螺纹,直径16~71 μm。纤维成束存在,直径30~66 μm。毛大丁草药材粉末显微鉴别图见图2。
2.3 水分、灰分、浸出物检测
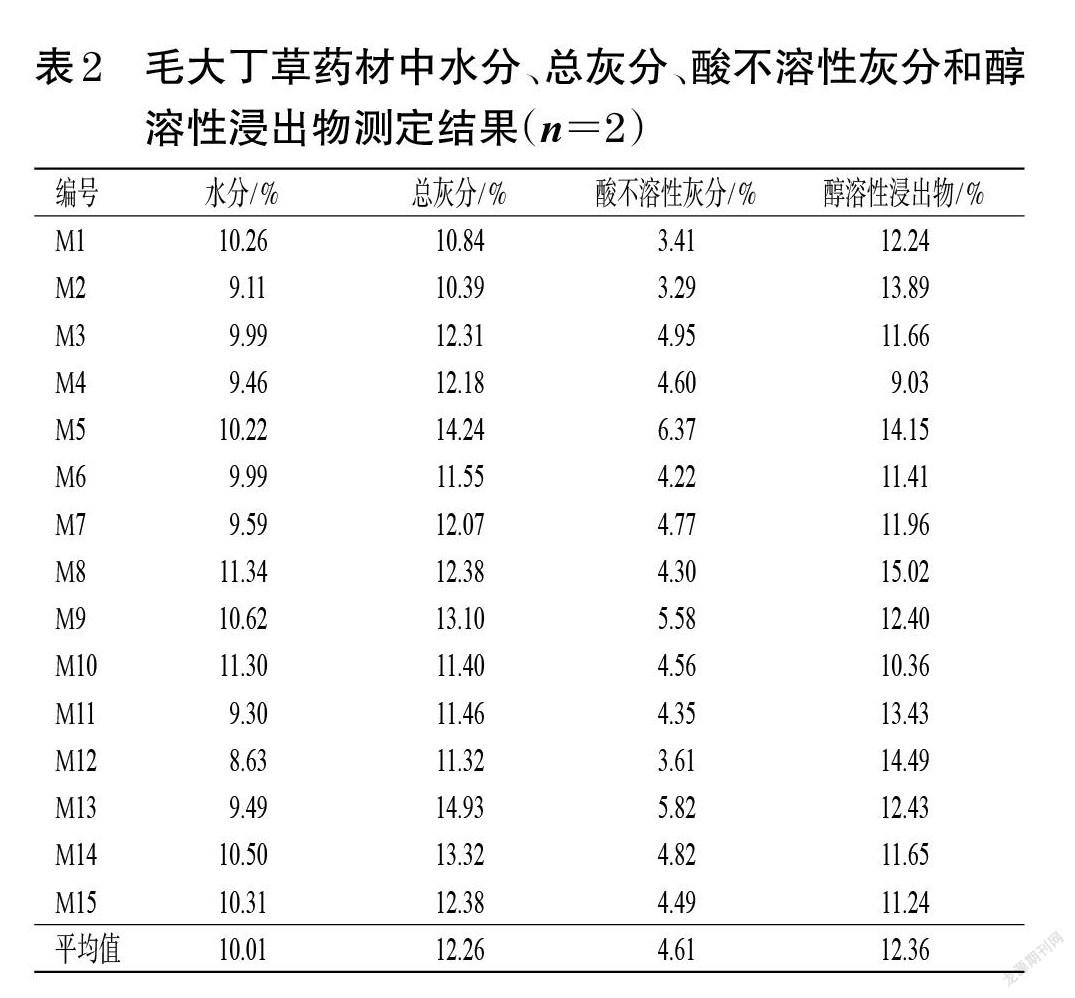
照2020年版《中国药典》(四部)通则“0832”“2302”“2201”对15批毛大丁草药材进行水分(第二法)、总灰分、酸不溶性灰分、醇溶性浸出物(热浸法,以95%乙醇作为溶剂)检测[12],每批样品平行测定2次。结果显示,15批毛大丁草药材的水分测定值为8.63%~11.34%,平均值为10.01%;总灰分测定值为10.39%~14.93%,平均值为12.26%;酸不溶性灰分测定值为3.29%~6.37%,平均值为4.61%;醇溶性浸出物测定值为9.03%~15.02%,平均值为12.36%。结果见表2。
2.4 含量测定
2.4.1 混合对照品溶液的制备 精密称取紫花前胡苷、木犀草素-7-O-β-D-芦丁糖苷、木犀草苷、芹菜素-7-O- β-D-芦丁糖苷、芹菜素-7-O-β-D-葡萄糖苷、异紫花前胡内酯对照品各适量,加甲醇溶解制成上述成分质量浓度依次为0.968、1.022、1.000、0.962、1.061、0.993 mg/mL的对照品贮备液,分别精密量取4.0、1.6、1.6、2.0、1.2、0.4 mL,置于同一25 mL量瓶中,用甲醇定容,摇匀,即得上述成分质量浓度依次为0.154 9、0.065 4、0.064 0、0.077 0、0.050 9、0.015 9 mg/mL的混合对照品溶液。
2.4.2 供试品溶液的制备 取毛大丁草药材粉末(过三号筛,下同)约1 g,精密称定,置50 mL具塞锥形瓶中,精密加入70%甲醇25 mL,称定质量,超声(功率200 W,频率40 kHz)0.5 h,放冷,再次称定质量,用70%甲醇补足减失的质量,摇匀,静置,取上层液置于离心管中,以12 000 r/min离心10 min,取上清液,经0.22 μm微孔滤膜滤过,取续滤液,即得。
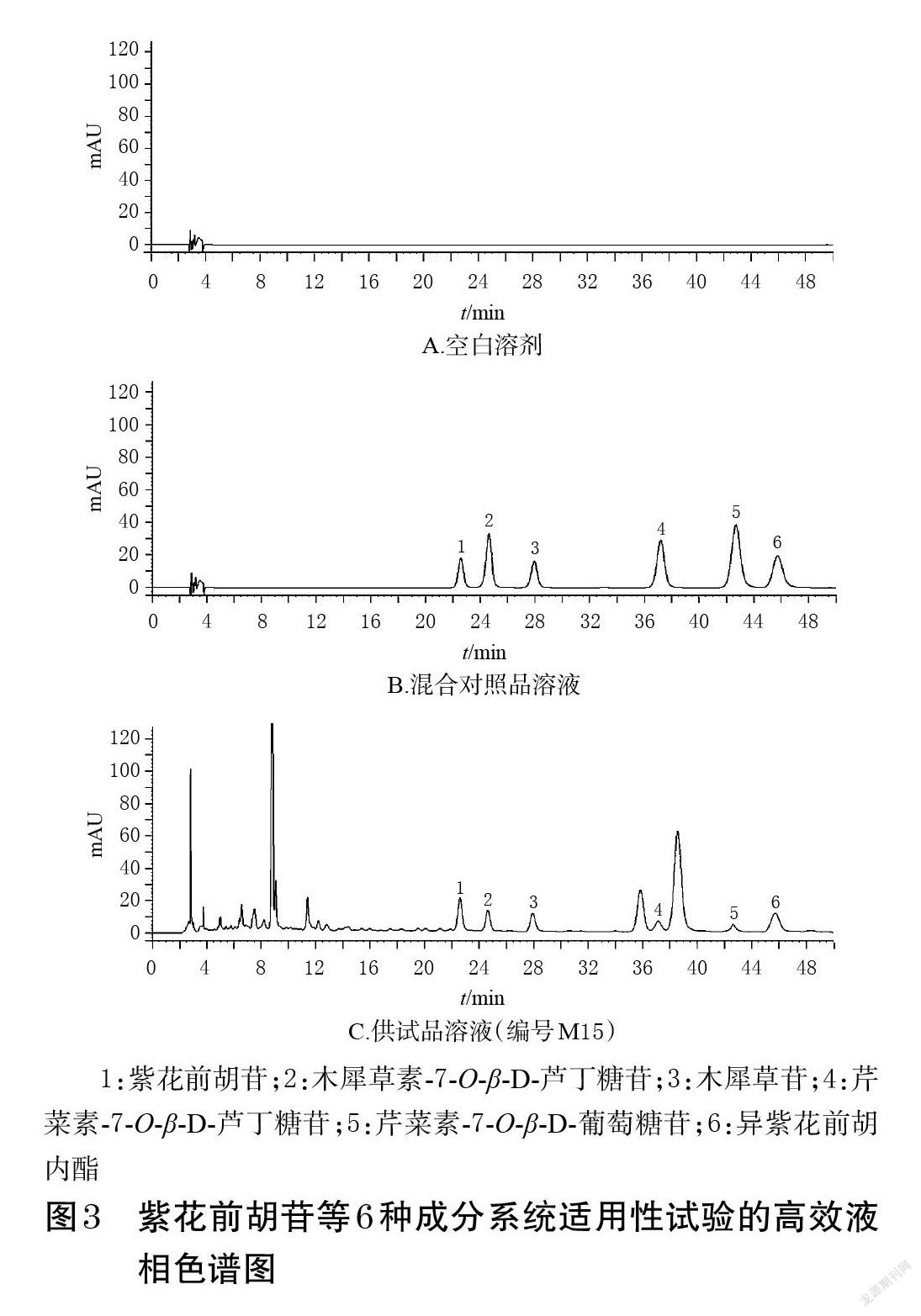
2.4.3 色谱条件及系统适用性试验 以ACE Excel 5 C18-PFP(250 mm×4.6 mm,5 μm)为色谱柱,以乙腈(A)-0.1%磷酸溶液(B)为流动相进行梯度洗脱(0~5 min,10.0%A→15.0%A;5~15 min,15.0%A→15.5%A;15~32 min,15.5%A→16.5%A;32~50 min,16.5%A);流速为1.0 mL/min;柱温为35 ℃;检测波长为340 nm;进样量为20 μL。取空白溶剂(70%甲醇)和上述混合对照品溶液、供试品溶液各适量,按本项下色谱条件进样测定,记录峰面积。结果显示,各成分分离度均大于1.5,理论板数均不低于16 000,空白溶剂对测定无干扰。紫花前胡苷等6种成分系统适用性试验的高效液相色谱图见图3。
2.4.4 线性关系考察 取“2.4.1”项下混合对照品溶液0.125、0.625、1.25、1.875、2.5、3.75、5 mL,分别置于5 mL量瓶中,加甲醇稀释并定容,摇匀,各精密吸取20 μL,按“2.4.3”项下色谱条件进样测定,记录色谱图。以待测成分的质量浓度(x)为横坐标、峰面积(y)为纵坐标,绘制标准曲线并进行线性回归,得紫花前胡苷、木犀草素-7-O-β-D-芦丁糖苷、木犀草苷、芹菜素-7-O-β-D-芦丁糖苷、芹菜素-7-O-β-D-葡萄糖苷和异紫花前胡内酯的回归方程分别为y=719.03x+0.592 8(r=0.999 6)、y=648.84x+0.022 6(r=0.999 6)、y=613.68x+0.003 9(r=0.999 1)、y=532.41x+0.226 7(r=0.999 5)、y=453.78x+0.106 3(r=0.999 6)、y=1 377.4x+0.134 9(r=0.999 5)。结果显示,上述6种成分的质量浓度分别在3.87~154.88、1.64~65.41、1.60~64.00、1.92~76.96、1.27~50.93、0.40~15.89 μg/mL范围内与各自峰面积成良好的线性关系。
2.4.5 精密度试验 取同一批次供试品溶液(编号M15)适量,按“2.4.3”项下色谱条件连续进样测定6次,记录峰面积。结果显示,紫花前胡苷、木犀草素-7-O-β-D-芦丁糖苷、木犀草苷、芹菜素-7-O-β-D-蘆丁糖苷、芹菜素-7-O-β-D-葡萄糖苷、异紫花前胡内酯峰面积的RSD分别为0.09%、0.40%、0.45%、0.56%、1.26%、0.29%(n=6),表明该方法精密度良好。
2.4.6 稳定性试验 取同一批次供试品溶液(编号M15)适量,分别于室温下放置0、3、6、9、12、24 h时按“2.4.3”项下色谱条件进样测定,记录峰面积。结果显示,紫花前胡苷、木犀草素-7-O-β-D-芦丁糖苷、木犀草苷、芹菜素-7-O-β-D-芦丁糖苷、芹菜素-7-O-β-D-葡萄糖苷、异紫花前胡内酯峰面积的RSD分别为0.80%、0.54%、0.69%、1.85%、1.51%、1.15%(n=6),表明供试品溶液在室温下放置24 h内稳定性良好。
2.4.7 重复性试验 取同一批次毛大丁草药材粉末(编号M15)适量,共6份,分别按“2.4.2”项下方法制备供试品溶液,再按“2.4.3”项下色谱条件进样测定,记录峰面积并代入标准曲线计算样品含量。结果显示,紫花前胡苷、木犀草素-7-O-β-D-芦丁糖苷、木犀草苷、芹菜素-7-O-β-D-芦丁糖苷、芹菜素-7-O-β-D-葡萄糖苷、异紫花前胡内酯含量的RSD分别为1.89%、2.45%、1.66%、2.68%、2.50%、1.99%(n=6),表明该方法重复性良好。
2.4.8 加样回收率试验 精密称取已知样品含量的毛大丁草药材粉末(编号M15)约0.5 g,共6份,分别按各成分在药材中已知含量的100%精密加入各对照品贮备液,按“2.4.2”项下方法制备供试品溶液,再按“2.4.3”项下色谱条件进样测定,记录峰面积并计算加样回收率,结果见表3。
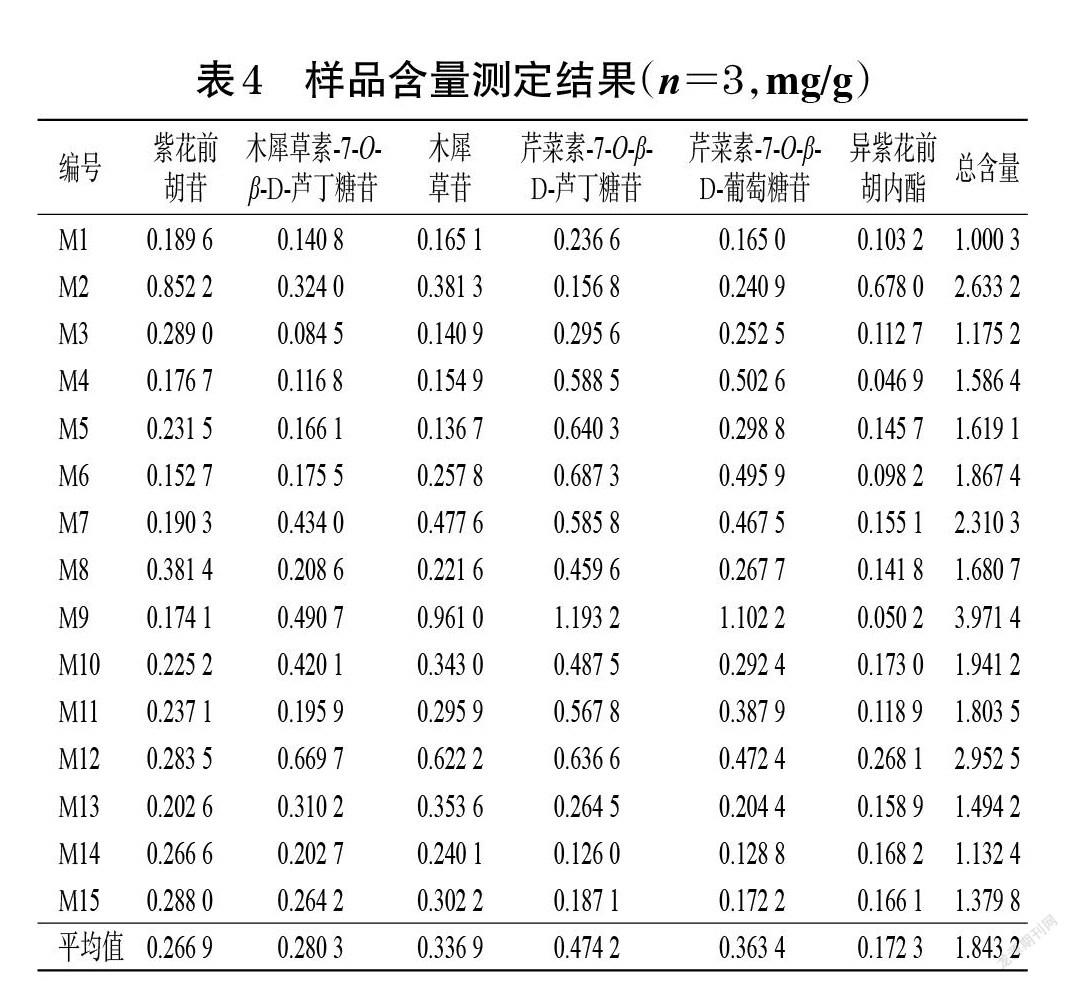
2.4.9 样品含量测定 分别取各批次毛大丁草药材粉末约1 g,精密称定,按“2.4.2”项下方法制备供试品溶液,再按“2.4.3”项下色谱条件进样测定,记录峰面积并代入标准曲线计算药材中6种成分的含量。每批样品平行测定3次,结果见表4。
2.5 质量标准提升建议
基于上述研究结果,本课题组对2003年版《贵州省中药材、民族药材质量标准》所收载的毛大丁草质量标准提出以下提升建议:增加显微鉴别项;增加水分、总灰分、酸不溶性灰分、醇溶性浸出物等检查项,以平均值上浮约20%[13-14]暂定本品水分不得过12.0%、总灰分不得过15.0%、酸不溶性灰分不得过6.0%,以平均值下浮约20%[13-14]暂定本品醇溶性浸出物不得少于9.0%;增加含量测定项,以本研究中木犀草苷、芹菜素-7-O-β-D-葡萄糖苷含量的最低值暂定以干燥品计,本品含木犀草苷(C21H20O11)、芹菜素-7-O-β-D-葡萄糖苷(C21H20O10)均不得少于0.016%。
3 讨论
3.1 指标成分的选择
本研究建立的含量测定方法能同时测定毛大丁草药材中紫花前胡苷、木犀草素-7-O-β-D-芦丁糖苷、木犀草苷、芹菜素-7-O-β-D-芦丁糖苷、芹菜素-7-O-β-D-葡萄糖苷、异紫花前胡内酯6种化学成分的含量;研究结果表明,15批药材中 6种成分除异紫花前胡内酯含量相对较低外,其余5种成分含量差别不大。据文献报道,黄酮类化合物是毛大丁草药材中一类重要的化合物,是该药材发挥抗癌活性的主要成分[15]。木犀草苷为黄酮类化合物的代表性成分之一,具有较强的抗菌消炎、抗病毒、抗肿瘤等活性,且对人体呼吸系统及心血管系统具有保护作用[16];芹菜素-7-O-β-D-葡萄糖苷具有抗菌消炎等活性[17];两种黄酮类成分的活性与毛大丁草药材的传统药效一致,为该药材的主要疗效成分,故本研究选择二者作为毛大丁草药材质量标准的含量测定指标。此外,由于本研究旨在提升贵州省地方质量标准,故以贵州产毛大丁草药材中木犀草苷、芹菜素-7-O-β-D-葡萄糖苷含量的最低值(编号M1)作为限度,即本品含木犀草苷(C21H20O11)、芹菜素-7-O-β-D-葡萄糖苷(C21H20O10)均不得少于0.016%。
本研究尚未成功鉴定出毛大丁草药材高效液相色谱图中所有共有峰所代表的化学成分,因此,在后期研究中还需利用核磁共振波谱、质谱等技术对各主要成分的结构进行鉴定及解析。
3.2 供试品溶液制备方法的选择
本研究对供试品溶液的提取方法(超声、回流)、提取溶剂(水、不同体积分数的甲醇和乙醇)及提取时间(0.25、0.5、1、1.5 h)等进行了考察,最终确定采用70%甲醇超声提取0.5 h作为供试品溶液的制备方法。
3.3 高效液相色谱条件的优化
本研究采用二极管阵列检测器对各成分进行了全波长光谱扫描,结果显示,各成分在340 nm波长处均有较强吸收,基线较平稳,分离度较好,且测定不受杂质的干扰,故最终选择340 nm作为检测波长。本研究考察了4种流动相体系(乙腈-水、甲醇-水、乙腈-0.1%磷酸溶液、甲醇-0.1%磷酸溶液)对色谱峰峰形的影响,发现当流动相为乙腈-0.1%磷酸溶液时,各待测成分色谱峰峰形较为尖锐且对称,无前延、拖尾等问题,故选择乙腈-0.1%磷酸溶液作为流动相。此外,本研究还考察了不同柱温(30、35、40 ℃)对各待测成分分离度的影响,发现当柱温为35 ℃时的分离效果最佳,故选择35 ℃为柱温。
3.4 含量测定结果分析
本研究所收集的样品产地来源较广。有研究表明,毛大丁草药材中的成分含量差异与其产地相关,即与药材的生长环境、采收时间及贮藏过程有关[10-11]。本研究含量测定结果表明,云南昆明(编号M3)、广西南宁(编号M4)和西藏拉萨(编号M5)三地产药材中木犀草苷的含量不符合限度要求,安徽淮南(编号M14)产药材中芹菜素-7-O-β-D-葡萄糖苷的含量不符合限度要求,故不建议选择上述药材入药。
综上所述,本研究在2003年版《贵州省中药材、民族药材质量标准》毛大丁草原质量标准基础上增加了显微鉴别项,水分、总灰分、酸不溶性灰分、浸出物检查项及药材中6种成分的含量测定项,同时规定了药材中水分、总灰分、酸不溶性灰分、醇溶性浸出物及指标成分含量的检测限度,提升了该药材的质量标准,可为其质量控制提供参考依据。
参考文献
[ 1 ] 卢鸿涛.毛大丁草的本草考证[J].中药材,1988,11(4):45-46.
[ 2 ] 程用谦.中国植物志:第七十九卷[M].北京:科学出版社,1996:94.
[ 3 ] 贵州省药品监督管理局.贵州省中药材、民族药材质量标准[S].贵阳:贵州科技出版社,2003:255.
[ 4 ] 肖瑛,李建北,丁怡.毛大丁草化学成分的研究[J].中草药,2003,34(2):109-111.
[ 5 ] WANG C,ZHENG Q T,LU Y,et al. Dibothrioclinin Ⅰ and Ⅱ,epimers from Gerbera piloselloides(L.)Cass[J]. Acta Crystallogr C,2003,59(Pt10):O593-O595.
[ 6 ] 肖瑛,丁怡.大丁草属植物的化學成分和药理活性研究[J].天然产物研究与开发,2002,14(6):51-57.
[ 7 ] 江苏新医学院.中药大辞典:上册[M].上海:上海科学技术出版社,1997:446.
[ 8 ] 马韩铮,王雪峰.醒脾养儿颗粒的临床应用进展[J].中国民族民间医药,2015,24(22):27-28,31.
[ 9 ] 游景瑞,熊丹丹,刘春花,等. HPLC结合化学计量学法的毛大丁草指纹图谱研究[J].中药材,2019,42(1):126- 130.
[10] 游景瑞,孙佳,兰燕宇,等. UHPLC-PDA法同时测定毛大丁草中6种成分[J].中成药,2021,43(1):111-116.
[11] 王娜,曹葳葳,仇维华,等. RP-HPLC-UV法同时测定毛大丁草中大丁苷和8-甲氧基补骨脂素的含量[J].沈阳药科大学学报,2019,36(3):249-253.
[12] 国家药典委员会.中华人民共和国药典:四部[S]. 2020年版.北京:中国医药科技出版社,2020:114,232,234.
[13] 陈华林,徐俊,蔡晓洋,等.藏药奥色折布的质量标准研究[J].中国药房,2020, 31(21):2609-2614.
[14] 刘利琴,彭潇,马雪,等.贵州产红孩儿药材的质量标准提升研究[J].中国药房,2020,31(12):1458-1462.
[15] REN W Y,QIAO Z H,WANG H W,et al. Flavonoids:promising anticancer agents[J]. Med Res Rev,2003,23(4):519-534.
[16] 管仁伟,曲永胜,顾正位,等.木犀草苷的药理作用研究[J].中国野生植物资源,2014,33(1):1-3.
[17] 郭晓民,瞿晶田,柴士伟. HPLC-DAD法测定野菊花栓中绿原酸、3,5-二咖啡酰奎宁酸、木犀草素-7-O-β-D-葡萄糖苷、芹菜素-7-O-β-D-葡萄糖苷和蒙花苷[J].现代药物与临床,2017,32(3):382-385.
(收稿日期:2021-07-27 修回日期:2022-01-24)
(编辑:胡晓霖)
