Ni基催化剂催化环戊二烯加氢反应及其宏观动力学
2022-03-03杜浩元赵永祥彭阳峰童天中赵红亮
杜浩元,赵永祥,彭阳峰,童天中,赵红亮
(1. 华东理工大学 化工学院,上海 200237;2. 中国昆仑工程有限公司 锦州分公司,辽宁 锦州 121001)
环戊烯作为一种重要的化工产品,广泛应用于橡胶、医药、农药等领域,可用来生产环戊醇[1]、环戊酮[2]、戊二醛[3]、戊二酸[4]等具有高经济价值的产品。工业上生产环戊烯的主要方法是通过C5资源获得环戊二烯后,在液相状态下通过催化剂选择性加氢制得[5]。环戊二烯选择性加氢的核心在于催化剂,好的催化剂应具有高活性、高选择性、稳定性好、经济性优等特点。与钯系催化剂相比,镍系催化剂价格更便宜、抗毒害能力更强、稳定性更好[6-9]。近年来,环戊二烯加氢镍系催化剂的研究取得了一定的成就。Wang等[10-11]制备的Ni-B/SiO2非晶态合金催化剂、李泽壮等[12]制备的Ni-Ru/Al2O3催化剂及张一烔等[13]制备的Ni-B/SiO2非晶态合金催化剂均在环戊二烯选择性加氢制环戊烯中均表现出良好的转化率和选择性,具有潜在的工业应用前景。
目前,关于环戊二烯加氢的研究主要集中在加氢方法、工艺优化和催化剂开发上,环戊二烯加氢动力学的报道相对较少。反应动力学研究包括本征动力学和宏观动力学,本征动力学是一种消除了内外扩散、研究催化剂表面反应、描述化学反应本身规律的动力学;宏观动力学是一种包含流体流动、传热、传质等物理因素影响的化学反应动力学[14-17]。显然,宏观动力学更加符合实际的工业应用,具有一定的工业指导意义。
本工作采用一种镍系催化剂在固定床管式反应器中进行环戊二烯的液相加氢反应,考察了反应温度、反应压力、氢气与环戊二烯的摩尔比(简称氢烯比)、液态空速对反应的影响;建立了环戊二烯加氢宏观动力学数学模型,并对数学模型进行参数估值与统计检验,得到模型参数,为工业反应器的设计与优化提供依据。
1 实验部分
1.1 原料
由于环戊二烯在室温下容易二聚,本工作所用的环戊二烯在实验室通过双环戊二烯解聚制备后立即用环己烷按质量比为1∶9的比例稀释并保存在-15℃的环境中,在此条件下3 d内环戊二烯的聚合程度不超过3%[18]。双环戊二烯:纯度85%(w),上海石化化工研究所;环己烷:纯度大于99.5%(w),泰坦科技股份有限公司;氢气:纯度99.999 5%(φ),法国液化空气集团;ZXH200镍系催化剂:以Al2O3为载体,单质镍为活性组分,庄信万丰(上海)催化剂有限公司。
1.2 仪器
固定床加氢反应器:非标产品,合肥至臻机械科技有限公司。反应器核心为一根垂直安装的内径为10 mm,长700 mm的陶瓷管,可看作平推流反应器,陶瓷管外部为三段等温控制加热炉,反应器还包括控温装置、压力控制装置、流量控制装置及相应的读数显示装置。2ZB-2L20A型双柱塞微量泵:北京星达科技发展有限公司。GC112N型气相色谱仪:上海仪电分析仪器有限公司,FID检测器,JN.SE-30型色谱柱50 m×0.32 mm×0.25 μm。
1.3 工艺流程
首先在流量控制器的控制下由双柱塞泵将加氢原料打入管路与氢气混合,经过预热带预热后进入固定床反应器,固定床反应器前后端装填约250 mm的陶瓷球,中间装填约200 mm的催化剂,催化剂装在恒温段,物料在陶瓷球上预热后与催化剂接触发生反应,产物随后经冷凝管降温后收集于气液分离罐,取样时将稳定液放入试样收集罐,排空后取样分析。温度由等温加热炉控制,通过背压阀调节系统的压力。
1.4 分析方法
采用气相色谱仪分析产物组成。柱箱的初始温度为35 ℃,以3 ℃/min的升温速率升至50 ℃后保持3 min,再以15 ℃/min的升温速率升至180 ℃后保持3 min,最后以20 ℃/min的升温速率升至220 ℃后保持5 min,进样温度160 ℃;检测器温度250 ℃。用面积归一法确定物质的含量。
1.5 催化剂的预处理
该催化剂出厂前活性组分镍已经还原,催化剂已老化,通过处理保证催化剂在室温环境下能稳定储存。催化剂使用前需要脱除吸附水,并进行预硫化处理,使催化剂在使用中具有良好的活性与选择性。
催化剂的干燥:在氢气流量为200 mL/min、压力为常压的条件下进行吹扫,开启床层的程序升温,初始升温速率为90 ℃/h,在床层温度达到90 ℃时保持10~20 min,后以15 ℃/h的升温速率升温,每升高15 ℃保持10~20 min,床层最终在150 ℃下干燥8 h。
催化剂的预硫化:以二甲基二硫醚为硫化剂、环己烷为稀释剂配制含硫量为50 mg/L的硫化液进行预硫化操作。在硫化温度35 ℃、压力1.5 MPa、氢气流量200 mL/min、液体进料流率为30 mL/h条件下硫化时间16 h。
2 结果与讨论
2.1 操作条件对反应的影响
2.1.1 反应温度
反应温度对环戊二烯转化率和环戊烯选择性的影响见图1。从图1可看出,随着反应温度的升高,环戊二烯的转化率逐渐增加,环戊烯的选择性逐渐下降,符合一般的化学反应规律。在反应温度为50~80 ℃的范围内,环戊烯的选择性明显下降,且低于90%,这主要是因为温度升高,反应速率加快,生成的环戊烯越来越多,竞争吸附加剧,更多的环戊烯加氢生成环戊烷。在工业上,满足效率的同时要求产物的纯度尽可能高,因此反应温度在40~50 ℃之间最为适宜。

图1 反应温度对环戊二烯加氢反应的影响Fig.1 Effect of temperature on the hydrogenation of cyclopentadiene.Reaction conditions:2.0 MPa,n(H2)∶n(cyclopentadiene)=1.4,LHSV=3 h-1.
2.1.2 氢烯比
氢烯比对环戊二烯转化率和环戊烯选择性的影响见图2。

图2 氢烯比对环戊二烯加氢反应的影响Fig.2 Effect of hydrogen/cyclopentadiene ratio on hydrogenation of cyclopentadiene.Reaction conditions:50 ℃,2.0 MPa,LHSV=3 h-1.
从图2可看出,随着氢烯比的增加,环戊二烯的转化率逐渐升高,环戊烯的选择性逐渐下降。当氢烯比在1.4~3.0之间时,环戊二烯的转化率提高较为明显,且环戊烯的选择性能维持在90%以上;而当氢烯比大于3.0后,环戊二烯的转化率提升幅度减少,环戊烯的选择性降到90%以下。这是由于环戊二烯加氢是一个串联反应,开始时以环戊二烯加氢生成环戊烯为主,当氢烯比在低区间内改变时,氢气的含量主要影响主反应而对副反应的影响不明显;当氢烯比在高区间内改变时,氢气的含量对于主反应来说已经过量而对副反应的影响加剧。因此,较适宜的氢烯比为2.0~3.0。
2.1.3 反应压力
压力对环戊二烯转化率和环戊烯选择性的影响见图3。从图3可看出,随反应压力的升高,环戊二烯的转化率逐渐升高,环戊烯的选择性逐渐下降。在1.0 ~2.0 MPa压力范围内,环戊二烯的转化率从43%提高到71%,环戊烯的选择性从97%降低到90%,说明在该区间内压力对环戊二烯转化率的影响比对环戊烯的选择性影响更大。在2.0~2.7 MPa压力范围内,环戊二烯转化率提升缓慢,环戊烯选择性下降明显。这是由于环戊二烯加氢是分子数减少的反应,增大压力有利于反应的正向进行,且随着压力的增加,反应液的氢气含量增加,更多的环戊烯发生了加氢反应。因此,较适宜的压力为1.6 ~2.0 MPa。

图3 压力对环戊二烯加氢反应的影响Fig.3 Effect of pressure on the hydrogenation of cyclopentadiene.Reaction conditions:50 ℃,n(H2)∶n(cyclopentadiene)=3,LHSV=3 h-1.
2.1.4 液态空速
液态空速对环戊二烯转化率和环戊烯选择性的影响见图4。从图4可看出,随液态空速的增加,环戊二烯的转化率下降,在液态空速大于3 h-1时,环戊烯的选择性没有明显的变化。这是由于液态空速增大,环戊二烯与催化剂的接触时间缩短,转化率降低,而环戊二烯夺取的氢气能力变强,环戊烯的选择性增加。因此,较适宜的液态空速为2~3 h-1。

图4 进料液态空速对环戊二烯加氢反应的影响Fig.4 Effect of LHSV on the hydrogenation of cyclopentadiene.Reaction conditions:50 ℃,2.0 MPa,n(H2)∶n(cyclopentadiene)=3.
2.2 宏观动力学
2.2.1 动力学模型的建立
在环戊二烯加氢反应体系中,环戊二烯除了生成环戊烯之外还会发生其他反应,如环戊二烯深度加氢生成环戊烷、环戊二烯二聚或三聚、二聚物双环戊二烯加氢生成二氢双环戊二烯或四氢双环戊二烯。考虑到原料中的二聚物含量极低且在反应器内的停留时间较短,可认为体系中主要发生式(1)的反应。

为了考察环戊二烯液相加氢的宏观动力学,模型采用较简单、便于指导工业应用的幂函数形式。影响环戊二烯液相加氢的因素包含:反应温度、反应压力、氢烯比与液态空速,因此,建立的动力学模型如下:

综上,需要确定的动力学参数有A1,Ea1,a,b,c,A2,Ea2,d,e,f。2.2.2 模型参数估值
式(2),(3),(6),(7)及反应器的入口条件组成了一阶常微分方程的初值问题。通过给定动力学模型参数的初值并采用合适的数值积分方法就可以得到反应器出口的组成情况,然后将计算值与实验值对比,以一定的优化算法优化修正参数直至满足设定的精度,最后得到模型参数的拟合值。根据环戊二烯加氢反应的实验结果,采用龙格-库塔法对式(2),(3),(6),(7)求解,并运用列文伯格-马夸尔特法对参数估值[19],得到动力学模型参数。
将环戊二烯、环戊烯、环戊烷摩尔分数的模拟值与实验值偏差的平方和作为优化目标函数:

2.2.3 模型验证
将环戊二烯与环戊烯视为关键组分,对宏观动力学模型进行统计检验,ρ2为决定性指标,是度量回归值总偏离大小的参数,ρ2的值越大,模型就越可靠,ρ2表达式为:

F为回归均方与模型计算误差均方和之间的比值,表达式为:

非线性拟合中,当ρ2>0.9,F>10F0.05(10,11)即表明模型可以较好地预示实验结果。
环戊二烯转化率与环戊烯选择性的模型计算值与实验值的相对偏差见图5。图中对角线表示计算值与实验值等值,上方的点表示计算值比实验值大,下方的点表示计算值比实验值小。
模型方程的r1与r2的ρ2>0.9,F>10F0.05(10,11)。由图5可得,环戊二烯的转化率与环戊烯的选择性的模型计算值分布在对角线附近,平均偏差在10%以内,计算值与实验值吻合良好。综上,在温度为20~80 ℃、反应压力为1.0~2.7 MPa、氢烯比为1.4~6.0、液态空速为2~7 h-1条件下,得到的动力学模型适用可信。
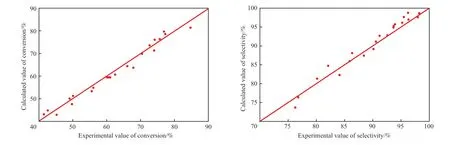
图5 环戊二烯的转化率和环戊烯的选择性计算值与实验值的对比Fig.5 Comparison between the calculated value and experimental value of cyclopentadiene conversion and cyclopentene selectivity.
3 结论
1)ZXH200镍系催化剂催化的环戊二烯液相加氢反应适宜的条件为:反应温度40~50 ℃、反应压力1.6 ~2.0 MPa、氢烯比2.0~3.0、液态空速2~3 h-1。
2)在适宜的反应条件内,ZXH200镍系催化剂催化环戊二烯选择性加氢可使用幂函数形式的宏观动力学模型进行描述,该宏观动力学模型是适用可信的。
符 号 说 明


