特殊人群的肿瘤免疫治疗
2022-03-03陈旭孙建国
陈旭,孙建国
(陆军军医大学第二附属医院1.医务处;2.肿瘤科,重庆 400037)
免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)包括针对程序性细胞死亡蛋白-1(programmed cell death protein 1,PD-1)及其配体1 (programmed cell death protein ligand 1,PD-L1)和细胞毒性T淋巴细胞抗原4 (cytotoxic T lymphocyte antigen 4,CTLA-4)抑制剂,已成为包括肺癌在内的多种恶性肿瘤的标准治疗方法。然而,Ⅲ期随机对照研究(randomized controlled trial,RCT)存在特定入组条件和样本量有限等局限性,并未纳入足够的真实世界的特殊人群,包括烟草暴露、肝转移、接受糖皮质激素治疗、驱动基因阳性、症状性脑转移、老年以及贫血患者等。因此,尽管ICIs已经获批各类适应证,但在这些特殊人群中的有效性和安全性仍未形成确定性结论或高循证级别证据,笔者在本文就这些热点问题进行解析。
1 烟草暴露状态
烟草暴露是诱发多种类型肿瘤发生的风险因素,包括肺癌、口腔癌、鼻腔癌、鼻咽癌、食管癌、胃癌、膀胱癌、结肠癌等。 在不同组织学类型非小细胞肺癌(non-small cell lung cancer,NSCLC)中,鳞状细胞癌与吸烟指数相关性较高,90%以上肺鳞癌患者是吸烟者,而肺腺癌主要发生在不吸烟人群。肺腺癌患者表皮生长因子受体(epidermal growth factor receptor,EGFR)、淋巴瘤激酶(anaplastic lymphoma kinase,ALK)基因突变概率比较高,是针对这类基因突变靶向药的最大受益者。肺鳞癌患者很少发生EGFR或ALK突变,对大部分靶向药都无效或者微效,选择化学治疗(化疗)或放射治疗(放疗)常不能获得满意效果,一旦出现耐药就难以控制肿瘤生长,总体生存预后较差。随着ICIs类药物的出现,相对于传统化疗而言,肺癌患者接受免疫治疗后死亡风险大幅度降低,生存期延长,其中肺鳞癌是免疫治疗的优势人群。多项二线免疫治疗的研究表明[1-4],接受免疫单药或者双免方案的鳞癌患者生存获益高于非鳞癌患者;而且非鳞癌患者免疫治疗获益与PD-L1蛋白表达量呈正相关,而肺鳞癌患者免疫治疗获益与PD-L1蛋白表达量关系不密切。进一步分析显示,烟草暴露和高肿瘤突变负荷(tumor mutational burden,TMB)是非鳞癌患者对免疫治疗药物反应潜在的决定因素[5]。肺鳞癌患者的突变异质性和突变负荷较高,而非鳞癌患者的突变异质性和突变负荷处于较低水平,产生的新抗原较少,导致炎性肿瘤微环境(tumor microenvironment,TME)较少,对免疫治疗的获益相对较少。
2 肝转移患者
肝转移是肺癌患者预后差的重要原因,约有20%NSCLC患者会发生肝转移。临床研究显示,肝转移患者虽然也可从免疫治疗中有所获益,但相较于其他部位转移患者,肝转移患者对免疫治疗的获益要差得多,对免疫治疗的响应更差,生存率也更低。追溯其中原因,以及探讨如何逆转这种情况,笔者聚焦于肝脏免疫微环境及其调控机制,以期为肝转移患者的免疫治疗新策略提供线索。

此外,肝脏转移的TME与血管异常密不可分。源于血管内皮生长因子(vascular endothelial growth factor,VEGF)等因子水平升高,肝转移TME处于缺氧和酸中毒状态,通过增加Treg细胞聚集、激活和扩张,抑制树突状细胞成熟等途径,导致肿瘤特异性细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)抗原呈递和激活受损,具有免疫抑制表型的异常内皮细胞(endothelial cell,EC)扩张,同时,在TME状态下,PD-1/PD-L1途径被激活,PD-L1在CTL、EC以及肿瘤细胞上表达上调。使用抗VEGF分子靶向药物改善肿瘤血管状态和抗PD-1/PD-L1免疫抑制剂抑制肿瘤免疫逃逸反应在理论上具有协同抗癌作用[10]。
3 基线糖皮质激素的使用
糖皮质激素是肿瘤治疗常用药物,包括化疗预处理、放化疗反应处理、神经系统转移以及基础疾病并发症处理,也广泛应用于免疫治疗相关不良反应处理中[13]。但超生理剂量糖皮质激素会对机体产生一定免疫抑制作用,甚至可能影响ICIs疗效。故临床上对于ICIs治疗患者糖皮质激素的使用存在一定争议。
糖皮质激素对免疫治疗疗效的影响分为两个方面,一是治疗前或联合化疗过程中使用糖皮质激素,二是发生免疫治疗相关不良反应后使用糖皮质激素处理。在ICIs治疗之前应用糖皮质激素,可能影响免疫治疗疗效,尤其是对于低热人群、自身免疫性疾病患者,需采用基础糖皮质激素,但使用剂量若超过10 mg·d-1便会影响后期ICIs临床疗效。不过,在使用ICIs联合化疗时,紫杉醇、培美曲塞等化疗药物需使用糖皮质激素进行预处理,这时糖皮质激素用量小,用药时间短,对免疫治疗疗效可能不会产生影响。
在糖皮质激素使用中还有一类特殊人群:自身免疫性疾病患者。研究显示[14],自身免疫性疾病患者是ICIs治疗潜在获益人群,然而,也可能出现原发病症状恶化,或出现新的免疫相关症状,有时会危及生命(例如重症肌无力)。与PD-1和PD-L1抑制剂比较,CTLA-4抑制剂导致基础自身免疫性疾病恶化的发生率更高,且症状更加严重。针对这部分患者,接受ICIs 免疫治疗时需要密切监测;在启动ICIs 治疗之前,尽量把泼尼松剂量降低到目标范围(<10 mg·d-1)。此外,累及神经系统的疾病或危及生命的自身免疫性疾病患者,尤其是免疫抑制药物不能控制或需要大剂量免疫抑制药物控制病情的患者,不适合ICIs治疗[15]。
1.3.3 加强田间管理 发病初期及时拔除病株,并在田外销毁。施足有机肥,增施磷、钾肥,提高植株自身的抗病性,减轻病害;栽培前期及时供水,浇水后及时松土,提高地温,促进发根;栽培中期注意通风,防止徒长,促花保果。
4 驱动基因突变的肺癌患者
PACIFIC研究问世,改写了不可切除Ⅲ期NSCLC的标准治疗。不可切除Ⅲ期NSCLC放化疗后无进展患者度伐利尤单抗(durvalumab)维持治疗4年OS和无进展生存期(progression-free survival,PFS)率分别为49.6% 和35.3%,而对照组为36.3%和19.5%。但亚组分析发现,EGFR突变患者没有PFS获益[HR=0.76,95%CI(0.35,1.64)]。所以免疫治疗对于Ⅲ期不可切EGFR突变患者PFS获益不明确。
ICIs治疗晚期EGFR突变NSCLC患者整体疗效不佳。一项Meta分析[21]纳入OAK、CheckMate057、KEYNOTE-010 和POPLAR等多项临床试验,评估ICIs作为EGFR敏感突变晚期NSCLC二线治疗与化疗比较的OS,结果显示,ICIs能显著延长EGFR野生型患者中OS;但在EGFR突变型患者中OS差异无统计学意义。因此,在大多数Ⅲ期RCT中,NSCLC驱动基因阳性患者被作为排除标准。
免疫治疗对于不可切除的EGFR突变阳性人群并非完全绝缘。多项临床研究结果显示,免疫联合方案可能对EGFR-酪氨酸激酶抑制药(tyrosine kinase inhibitor,TKI)耐药人群提供客观缓解率(objective response rate,ORR)和PFS获益[11,22-23]。其中,CT18研究针对EGFR-TKI耐药后T790M阴性NSCLC患者,采用特瑞普利单抗联合化疗,ORR为50.0%,中位PFS 7.0个月,中位OS 23.5个月[22]。IMpower150 研究纳入EGFR突变阳性一线耐药患者,B组(阿替利珠单抗+贝伐珠单抗+卡铂+紫杉醇,ABCP方案)较C组(贝伐珠单抗+卡铂+紫杉醇,BCP方案)有更好的临床获益,ORR为71%,中位PFS为10.2个月,中位OS超过25个月[11]。因此,对于EGFR突变阳性人群的筛选成为提高免疫治疗疗效的关键。在条件允许的情况下,行穿刺活检以判断肿瘤免疫分型,如发现较多TILs则预示更好的疗效及预后。
因此,在临床实践中,对于晚期不可切除的EGFR突变阳性NSCLC患者,使用ICIs时应谨慎。在做好充足检查的基础上(病理活检、免疫分型、TMB水平、EGFR突变类型)全面评估患者状态(TKI-naive、TKI经治耐药)来选择最为恰当的免疫治疗模式(ICIs单药、ICIs联合抗血管生成药物),使患者获得最大获益。
5 症状性脑转移
因此,ICIs联合颅内放疗或许是治疗肺癌脑转移患者的新契机,在接受ICIs治疗的同时给予放疗可达到免疫增效的效果,能够促使甚至撬动免疫治疗的最大效能。考虑到放射外科治疗周期极短,1~4个病灶只需要1~2 d,放疗可以在免疫治疗的多个阶段进行,基本不存在延误治疗的问题。临床可以尝试同步或先ICIs后序贯放疗的方式,以期达到最佳疾病控制。
6 老年患者
由于ICIs低毒性、耐受性好的特点,其在老年患者中应用尤其受到关注。在一系列研究中(CheckMate017、CheckMate057、KEYNOTE-010、OAK、KEYNOTE-024、KEYNOTE-189、KEYNOTE-407、IMpower 150、PACIFIC),以65岁为分界点,NSCLC老年患者接受ICI的生存率整体上与年轻患者差异无统计学意义。
FDA对纳入老年患者的4项Ⅲ期试验的纳武利尤单抗的安全性进行了分析[38]。1或2级不良事件(adverse events,AEs)的发生率在所有年龄组中相似。然而,老年患者的3—5级AEs(≥70岁患者为71.7%,<65岁患者为58.4%),严重AEs(<65岁患者为50.8%,≥70岁患者为58%),以及需要用免疫调节药物治疗的AEs(<65岁患者为41.5%,≥70岁为51.9%) 发生率较高。在最近发表的一项IIIB/IV期安全性研究CheckMate153中接受纳武利尤单抗治疗的经治NSCLC的亚组分析数据中[39],在1426例接受治疗的患者中,其中556例(39%) 年龄≥70岁。老年人和总体人群的安全性和疗效情况相似。
进一步分析更高年龄段老年患者的ICIs治疗获益情况,发现治疗获益并不理想。在一项荟萃分析中,分析了>75岁接受ICIs单药治疗的NSCLC患者,与化疗相比,未观察到明显延长的OS[HR=1.23,95%CI(0.61,2.48)][40]。另外一项荟萃分析分析了接受ICIs治疗的>75岁NSCLC患者,获得了相似的结论[HR=1.02,95%CI(0.35,1.69)][41]。
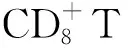
一项荟萃分析显示[43],在9647例接受免疫治疗的肿瘤患者中(包括NSCLC、肾细胞癌、Mela、头颈部鳞癌、胃癌),免疫治疗对≥75岁似乎有效。在一线治疗中,>75岁亚组生存获益与<75岁患者相似,均显著优于标准治疗;在二线治疗中,仅<75岁患者获得生存获益,>75岁亚组生存获益相对标准治疗并不显著。
综上所述,在老年患者中,使用ICIs是一种安全和有效的选择。老年人的治疗结果可能受到混杂因素影响,特别是不良PS,而不是由于年龄本身。同时,尽早一线使用免疫治疗,有更大临床获益可能性。
7 贫血人群

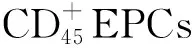
8 结束语
综上所述,笔者在本文就烟草暴露、肝转移、接受糖皮质激素治疗、驱动基因阳性、症状性脑转移、老年以及贫血患者等七大特殊人群的免疫治疗进行了阐述,并提出了相应的临床治疗策略。由于篇幅有限,还有一些特殊人群不能完全囊括其中,包括器官移植、胸腺瘤、乙肝病毒/丙肝病毒/人类免疫缺陷病毒感染的特殊疾病患者,其他驱动基因突变患者、PS评分差的患者、使用抗菌药物的患者、器官功能受损的患者、免疫治疗原发耐药患者以及免疫治疗重启患者。期待今后有更多的临床研究及临床数据,来指导这些特殊人群免疫治疗的临床实践。
