恩诺沙星、喹烯酮、土霉素和硫酸多黏菌素B对细胞的联合毒性研究
2022-03-03傅榆涵侯力睿扈洪波尹淑涛
傅榆涵,侯力睿,赵 冲,扈洪波,尹淑涛
(中国农业大学食品科学与营养工程学院,北京 100083)
中国是兽药生产和使用大国,在生产上兽药种类丰富,在《中华人民共和国兽药典(2015版)》录入的兽药共2 030种[1],且处于不断研发状态。在应用上,中国人口增长和经济水平的提高使肉类消费量剧增,推动兽药需求不断增长,每年抗生素使用量为15~20万t;每生产1 kg肉,中国使用抗菌药物的量约是欧盟国家的10倍[2]。一些使用者滥用、乱用或为追求经济利益不遵循休药期规定等现象导致兽药残留超标[3]。兽药在动物体内经系列代谢转化,部分会残留在动物体内经食品加工流入市场,大部分以代谢物或原药的形式进入环境[4],再经食物链富集流动、不断放大,最终影响处于食物链顶端的人类,可能引起急性毒性或过敏,破坏机体内菌群平衡,诱导有害微生物产生抗性基因,降低药物治疗效果,若长期积累产生蓄积毒性,将影响机体的正常生理功能和生长发育[5]。
目前,兽药种类繁多、滥用现象普遍且存在多种兽药混合使用现象,易造成多兽药残留,当这些药物同时存在时相互影响将产生联合毒性,可能放大对生物的危害[6-7],如大环内酯类、氟喹诺酮类和磺胺类兽药两两结合对小球藻的生长均表现出协同抑制[8];头孢菌素和环丙沙星协同抑制羊角月牙藻的生长[9]。混合兽药残留带来的威胁不容小觑,但中国现有的兽药残留标准多仅针对单一药物,对药物的联合毒性不够重视,关于兽药联合的政策或管理也有待完善。喹烯酮、恩诺沙星、硫酸多黏菌素B、土霉素为常见抗菌药,使用较为普遍且在环境中的残留较高,同时接触的可能性较高[10-11]。因此,本研究选取这4种药物,以人肝细胞L02、小鼠肝细胞AML12、猴肾细胞Marc145、人肾细胞HEK293T、人神经母细胞瘤细胞SK-N-SH和小鼠睾丸间质细胞TM3为模型,评价不同暴露浓度下各兽药单独处理和联合处理时对细胞生长的抑制作用,得到浓度效应关系,并采用浓度加和模型(CA)和独立作用模型(IA)法评价二元、三元、四元组合的联合毒性,以期对各药物之间可能发生的联合作用进行初步了解。
1 材料与方法
1.1 材料
1.1.1 细胞 AML12(CRL-2254)、L02(CVCL-6926)、HEK293T(ACS-4500)、Marc145(CRL-12231)和SK-N-SH(HTB-11)细胞均来自ATCC 细胞库;TM3(3101MOUGNM24)细胞来自国家生物医学实验细胞资源库。
1.1.2 主要试剂 恩诺沙星(enrofloxacin,ENR,98%)、土霉素(oxytetracycline dihydrate,OTC,97%)、硫酸多黏菌素B(polymyxin B sulfate,PMB,USP级,≥6 000 USP units/mg)均购自Aladdin公司;喹烯酮(quinocetone,QCT,≥98%)购自上海源叶生物科技有限公司;DMEM/F12、DMEM高糖培养基购自HyClone公司;RPMI-1640培养基、PBS缓冲液均购自北京索莱宝科技有限公司;戊二醛、结晶紫均购自Sigma公司;ITS细胞培养添加物(100×)购自塞业生物科技有限公司;马血清、胎牛血清均购自Biological Industries(BI)公司。
1.1.3 主要仪器设备 CO2恒温培养箱(3111型)、液氮罐(8038型)、生物安全柜(Forma CLASSⅡ级A2型)、高速低温离心机(Biofuge Pro R)和96孔酶标仪(Multiscan SK3)均购自Thermo Scientific公司;电子精密天平(AL104-IC)购自梅特勒-托利多(上海)有限公司。
1.2 细胞培养
AML12细胞培养于含有10%胎牛血清和1% ITS细胞培养添加物的DMEM/F12培养基中;L02细胞培养于含有10%胎牛血清的RPMI-1640培养基中;HEK293T、Marc145和SK-N-SH细胞均培养于含有10%胎牛血清的DMEM培养基中;TM3细胞培养于含有5%马血清和2.5%胎牛血清的DMEM/F12培养基中,在37 ℃、5% CO2环境中贴壁生长。
1.3 药物处理
细胞传代时,根据细胞状态和生长速度,将一定数量的细胞均匀接种到细胞培养板中,当细胞汇合度达到40%~50%时,进行加药处理。表1所示浓度为对应的一元药物在该细胞中的最大浓度,按相应稀释因子进行梯度稀释。根据单一药物对细胞产生50%、33%和25%生长抑制率时的浓度计算结果进行二元(EC50∶EC50)、三元(EC33∶EC33∶EC33)、四元(EC25∶EC25∶EC25∶EC25)毒性比药物混合,并以1/2为稀释因子进行梯度稀释,按所需浓度将药物加入新培养基中并混匀,用真空泵吸除原培养基,再加入新配好的含药培养基,联合处理细胞24 h。

表1 单一药物最大浓度及稀释因子
1.4 结晶紫染色
加药处理24 h后移除培养基,用PBS缓冲液润洗,再每孔加入0.5 mL 1%戊二醛溶液,于摇床上固定15 min。弃去戊二醛,每孔用PBS缓冲液润洗2次后,加入1 mL 0.02%结晶紫染色液,在摇床上染色30 min。弃去染色液,流水小心冲洗每个孔,至洗液呈无色透明为止。倒置晾干后每孔加入2 mL 75%乙醇,于摇床上溶解6~8 h,570 nm波长下测定吸光值(D),以75%酒精为空白对照。以对照组细胞数量为100%,按公式(1)计算出加药处理一段时间后的细胞存活率。
细胞存活率(%)=
(1)
1.5 拟合剂量效应曲线
根据抗菌药对细胞生长的抑制作用(Y)与浓度(X)和EC50预估值,使用非线性回归模型,遵循方程(2)、(3)。
Y=Bottom+(Top-Bottom)/(1+10^((logEC50-X)×HillSlope))
(2)
logECF=logEC50+(1/HillSlope)×log(F/(100-F))
(3)
式中,Y,药物对细胞的生长抑制率(%);X,抗菌药浓度(mg/L);ECF,抑制率为F%(F=10、20、25、33、50)时抗菌药的浓度(mg/L);Bottom,曲线的基线响应(mg/L);Top,最大响应(mg/L);Hillslope,指曲线的坡度。
1.6 多元混合物毒性的预测
采用CA[12]和IA[13]判断联合效应。
CA 模型数学表达式为:
(4)
式中,n,混合物中组分数目;ECx,i,第i个组分单独作用时产生x%效应对应的单一毒性效应浓度;ci,混合物产生x%效应时对应的组分i在混合物体系中的浓度。
IA模型数学表达式为:
(5)
式中,E(cmix),预测的效应;cmix,混合物的总浓度;ci,混合物产生x%效应时对应的组分i在混合体系中的浓度;E(ci),i组分单独作用产生x%效应时的单一浓度。
根据公式拟合CA和IA线,当实际曲线在CA、IA线之上时,表示实际毒性大于预测毒性。存在协同效应;与CA、IA线相交时,表示相加效应;当实际曲线在CA、IA线下时,表示实际毒性小于预测毒性,存在颉颃效应。
1.7 统计分析
运用GraphPad Prism 8.0分析数据及曲线拟合。试验结果以平均值±标准差表示。
2 结 果
2.1 单一兽药对不同细胞的生长抑制作用
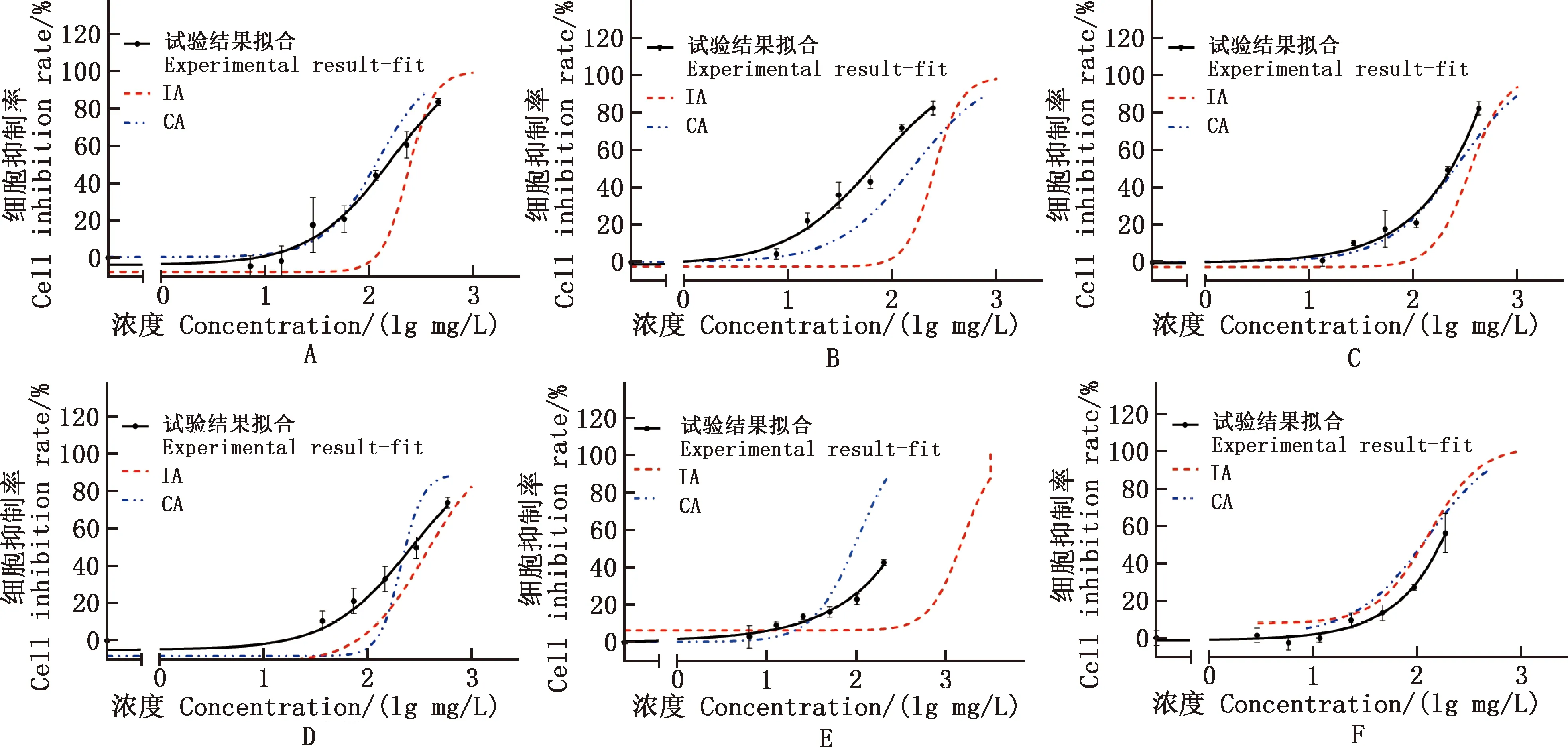
探究ENR、OTC、QCT、PMB单独作用24 h对细胞生长的抑制作用,结果见图1。由图1可知,4种抗菌药对6种细胞均存在剂量效应关系,随着作用剂量的增加,细胞生长抑制率增加,利用软件进行曲线方程拟合,具体结果见表2。通过拟合得到的曲线计算的4种药物对不同细胞的EC50、EC20、EC10值,具体结果见表3。

A~F,分别为4种兽药单独作用于L02、AML12、HEK293T、Marc145、SK-N-SH和TM3细胞的剂量-效应曲线
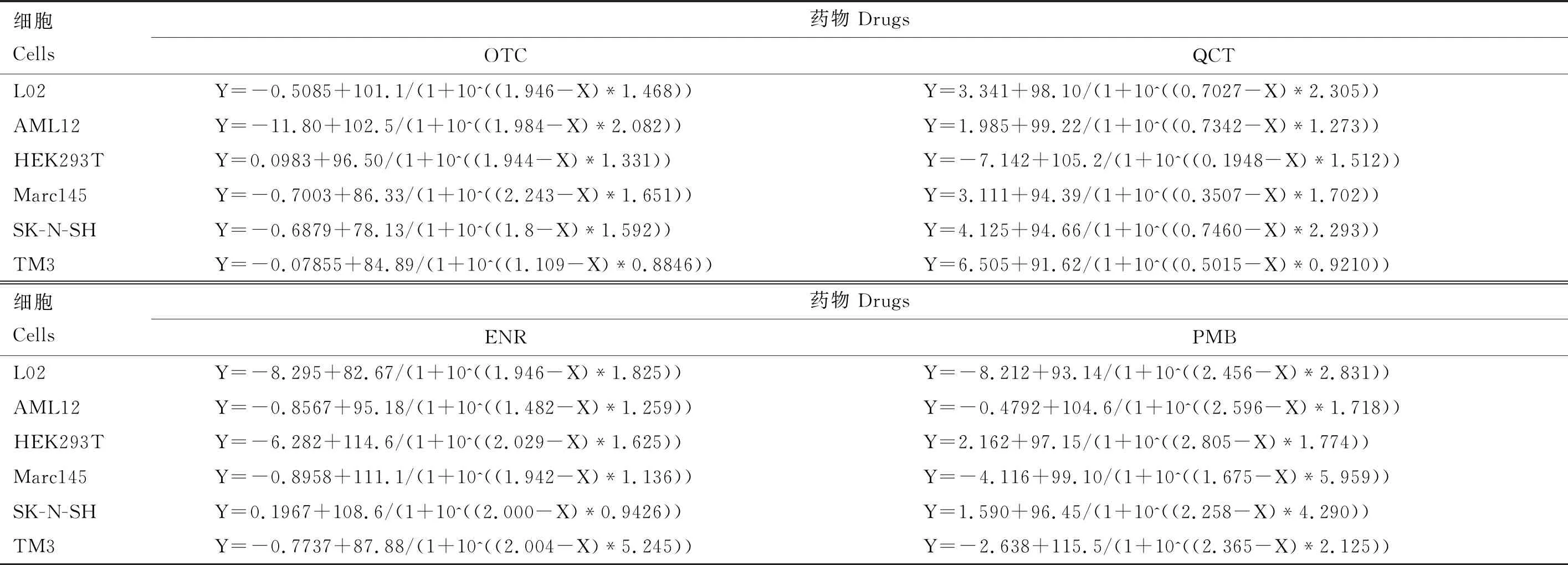
表2 抗菌药作用于不同细胞后的生长抑制曲线
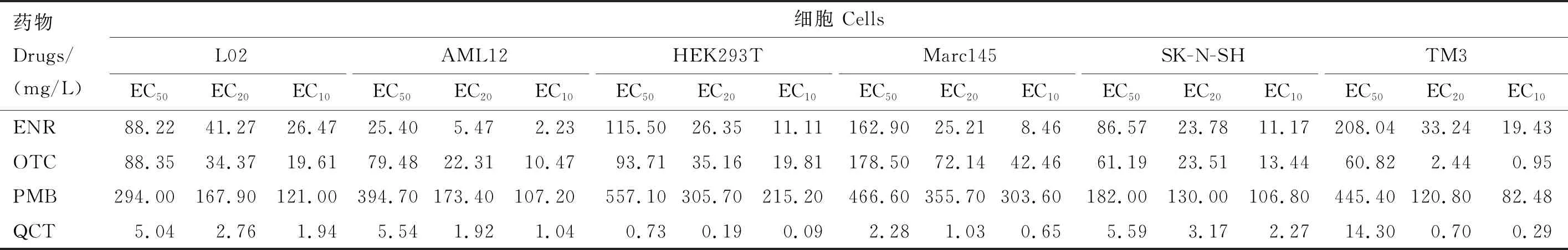
表3 抗菌药作用不同细胞的EC50、EC20、EC10值
通过比较EC50可知,不同药物对同一细胞的毒性大小不同。无论对哪种细胞,QCT的毒性都是最强的,PMB毒性最小,其中在HEK293T细胞中,QCT和PMB相差约763倍(EC50,PMB,HEK293T=557.10 mg/L,EC50,QCT,HEK293T=0.73 mg/L)。ENR和OTC的毒性介于QCT和PMB之间,但对不同细胞,毒性大小存在差别,对L02、Marc145细胞,两者毒性类似,对AML12细胞,ENR的毒性更强,而对HEK293T、SK-N-SH和TM3细胞,OTC的毒性更强。
同种药物对不同细胞的毒性也存在差异。 ENR对AML12细胞的毒性最大(EC50,ENR,AML12=25.40 mg/L),而对TM3的毒性最小(EC50,ENR,TM3=208.04 mg/L),相差约8.2倍。 OTC对6种细胞的EC50在60~200 mg/L范围内,对每种细胞的毒性差别不明显,影响最小的是Marc145细胞(EC50,OTC,Marc145=178.50 mg/L)。PMB对SK-N-SH细胞的EC50为182.0 mg/L,对比PMB对其他类型细胞的毒性,PMB对神经细胞的影响最大,具有较强的神经毒性。QCT对肾细胞的毒性最强,仅0.73 mg/L就可对HEK293T细胞造成半数抑制。
2.2 二元兽药对不同细胞的生长抑制作用
ENR+OTC、ENR+PMB、ENR+QCT、OTC+PMB、OTC+QCT、PMB+QCT二元组合联合毒性结果见图2~4。大部分药物二元组合后产生协同毒性效应。ENR与其他3种抗菌药的组合在大部分细胞中主要表现出相加效应,而ENR+OTC组合在肝细胞(L02和AML12细胞),ENR+PMB在肾细胞(Marc145和HEK293T细胞)中表现出了协同效应,ENR+PMB和ENR+QCT在AML12细胞中出现明显的颉颃,在低浓度时有促进细胞生长的作用。与OTC组合的药物大部分出现了协同效应,尤其是OTC+QCT在6种细胞中均出现协同毒性。与PMB组合的药物易出现低浓度呈相加或颉颃作用,而随浓度的增加对细胞的毒性增强,出现协同作用。
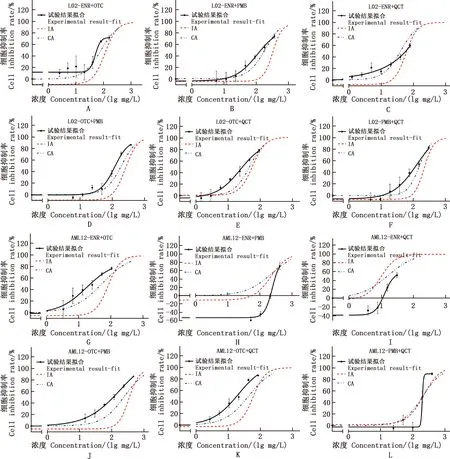
A~F、G~L,分别为ENR+OTC、ENR+PMB、ENR+QCT、OTC+PMB、OTC+QCT、PMB+QCT二元组合对L02和AML12细胞的混合毒性评价
从细胞的角度来看,在TM3细胞中抗菌药联合易出现相加效果,在肝细胞(L02和AML12细胞)和肾细胞(Marc145和HEK293T细胞)中出现协同的概率较高。不同细胞模型由于代谢途径的差异对同样药物联合表现出来的效应可能不同,如ENR+QCT在AML12细胞中主要是颉颃作用,而在HEK293T中主要是协同作用,联合毒性效应存在模型差异。
2.3 多元兽药对不同细胞的生长抑制作用
ENR+OTC+PMB、ENR+OTC+QCT、OTC+PMB+QCT、ENR+QCT+PMB三元及OTC+ENR+PMB+QCT四元组合联合毒性结果见图5、6。多元组合中相加效应出现的概率上升。在AML12细胞中,ENR+PMB+QCT组合出现明显的颉颃作用,在低浓度混合时甚至有促生长作用,在ENR+PMB和ENR+QCT二元组合也有类似情况,而在AML12细胞中4种药物单独作用均不存在促生长作用,当多元组合中出现OTC时多为协同作用。部分组合出现3段毒性,即低浓度时为相加或颉颃作用,中间浓度时为协同作用,当浓度继续上升,协同作用减弱,变为颉颃作用,如HEK293T细胞中的ENR+OTC+PMB组合、Marc145和TM3细胞中OTC+PMB+QCT组合,随着组分的增加,药物之间的联合作用变化更为复杂。
3 讨 论
QCT为化学合成喹噁啉-1,4-二氧化合物[14],其在代谢过程中脱氢产生自由基引起氧化应激,使细胞DNA损伤断裂,细胞膜通透性增加,从而引起细胞死亡[15]。QCT的毒性较强,且可能由于肝脏和肾脏为QCT的主要代谢器官,其肝脏和肾脏毒性较为显著,在本研究中,仅0.73 mg/L就可对HEK293T细胞造成半数抑制,Chen等[16]以非洲绿猴肾细胞Vero为材料,发现短时间处理下40 μg/mL QCT对细胞生长的抑制率达50%,且抑制强度远高于同为喹噁啉类抗菌药的卡巴氧和喹乙醇。PMB属多肽类抗生素[17],对革兰氏阴性菌有强烈的杀伤作用[18]。本研究结果显示,在4种药物中PMB 对6种细胞的EC50均最大,可见其毒性较小,但从细胞上比较,对SK-N-SH细胞的EC50最小,神经毒性较为突出。有文献报道,PMB可造成神经肌肉阻滞,具有一定神经毒性[19]。ENR属喹诺酮类抗菌药物[20],在食品中ENR的脱乙基产物环丙沙星(ciprofloxacin,CIP)检出最为常见,其次是ENR[21]。OTC属四环素类抗生素,是农业和医学中应用最多的抗菌药之一,在河流中的检出率可达287 ng/L[22],是最常见的环境污染物之一[23],这些药物极易发生混合残留,当不同的药物混合使用可能同时对多种器官造成损伤。
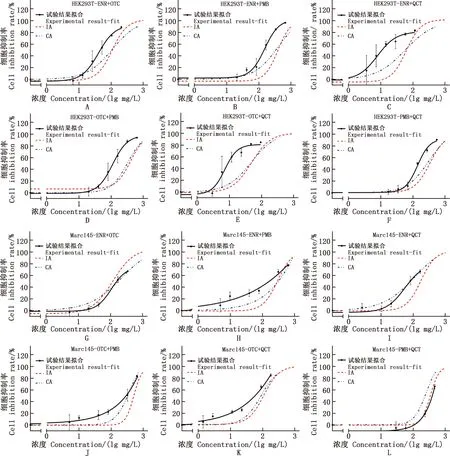
A~F、G~L,分别为ENR+OTC、ENR+PMB、ENR+QCT、OTC+PMB、OTC+QCT、PMB+QCT二元组合对HEK293T和Marc145细胞的混合毒性评价

A~D、E~H、I~L、M~P、Q~T、U~X,分别为ENR+OTC+PMB、ENR+OTC+QCT、OTC+PMB+QCT和ENR+QCT+PMB三元组合对L02、AML12、HEK293T、Marc145、SK-N-SH和TM3细胞的混合毒性评价
A~F,分别为OTC+ENR+PMB+QCT四元组合对L02、AML12、HEK293T、Marc145、SK-N-SH和TM3细胞的混合毒性评价
当2种或2种以上物质同时或顺序进入机体会发生复杂的交互作用,影响彼此的吸收、代谢或转化等过程,产生与单一作用时不一样的综合效应,即联合毒性[24]。由于兽药使用不当和多种兽药联合使用易导致兽药混合残留,而混合兽药对生物的联合毒性往往不是简单的相加。 本研究结果显示,QCT+OTC在等毒性比混合时对6种细胞均造成了协同抑制,以OTC∶QCT=4∶1的浓度比混合时也具有显著协同效应,可通过增加活性氧(ROS)、抑制超氧化物歧化酶2(SOD2)和过氧化氢酶(CAT)激发氧化应激,并上调促凋亡蛋白Bim使细胞发生凋亡[25]。本研究结果显示,在HEK293T细胞中与ENR组合的药物均出现显著协同作用,有文献报道ENR和其代谢产物环丙沙星(CIP)也可产生协同肝毒性,引起肝细胞氧化应激[26],因此抗菌药的使用在避免滥用、乱用外还要注意配伍禁忌,避免联合使用后对人体产生更大的危害;除此之外,可采用降解、吸附等抗菌药去除策略,结合快速、灵敏的检测方法提高对食品中抗菌药的检测效率,以减少抗菌药进入人体[27]。
药物的联合毒性不是固定的,影响联合毒性的因素包括组分、剂量、作用时间、模型及评价方法等。不同的化学物之间无论是理化性质、针对的靶器官或细胞还是在生物体内的转化、代谢等过程都存在差异,各物质的毒性作用机制不同导致联合作用不相同[28]。组分越多,化学物之间产生的相互影响也越复杂。本研究结果显示,当药物三元、四元组合时出现相加效应的概率上升,这与Funnel假说一致,即混合物组分越多,联合效应越接近于相加作用[29]。同时联合效应是随浓度的变化而变化的,如OTC+PMB组合在L02细胞中低浓度为相加作用,随着浓度的升高出现了协同作用。连勇等[30]发现敌敌畏与乐果低剂量联合对HepG2细胞DNA的损伤效应为简单相加,敌敌畏与马拉硫磷、乐果与马拉硫磷具有协同效应,而在高剂量下,3种有机磷农药之间联合模式为颉颃。产生这种区别的可能原因是不同剂量对于代谢酶的影响不同,有机磷农药低剂量下可能对P450酶系产生诱导,而高剂量下产生抑制。在模型上,同一组药物可能因靶点、作用方式、代谢途径差异对不同细胞联合毒性存在较大区别。联合毒性也存在时间依赖性[31],造成时间依赖的原因可能是靶蛋白不同、细胞膜的通透性变化、药物与靶蛋白结合的有效浓度变化等[32-34]。本研究固定染毒时间为24 h,并未涉及这4种抗菌药对细胞不同作用时间下的联合毒性的影响,时间依赖作用有待进一步探讨。
4 结 论
在6种细胞模型中,QCT的毒性最强,PMB的毒性最小,ENR、QCT主要造成肝脏和肾脏毒性,OTC对每一种组织的毒性大小相似,但生殖毒性较突出,而PMB主要对神经细胞造成影响,不同的药物混合使用可能同时对多种器官造成损伤。二元抗菌药组合出现协同作用的可能性较高,尤其是与OTC组合。在多元组合中,随着组分的增加,组分间的相互作用更加复杂,联合毒性出现相加的概率上升。
