猪瘟病毒E2-GM-CSF融合蛋白在HEK293T细胞中的表达和免疫原性分析
2022-03-03张艳敏周亚南刘旭平谭文松
张艳敏,周亚南,曹 磊,田 园,刘旭平,谭文松,赵 亮
(1.华东理工大学,生物反应器工程国家重点实验室,上海 200237;2.上海倍谙基生物科技有限公司,上海 201203)
猪瘟(classical swine fever,CSF)是由猪瘟病毒(Classical swine fever virus,CSFV)引起的猪的高传染性、高致病性疾病,严重危害动物健康和养猪业[1-2]。CSFV属于黄病毒科(Flaviridae)瘟病毒属(Pestivirus),有4种结构蛋白(C、E0、E1和E2)[3]。其中,E2蛋白是CSFV的主要保护性抗原,可诱导机体产生针对CSFV的中和抗体,是研究各种CSFV基因工程疫苗的首选靶蛋白[4]。CSF的防控措施主要是清除政策和预防性疫苗接种,但因清除政策在高密度养猪区会造成巨大的经济损失,所以在除欧盟外的许多国家仍使用预防性疫苗接种防控CSF[5-6]。目前可用的CSFV疫苗有减毒活疫苗、亚单位疫苗和嵌合疫苗,应用最广泛的是减毒活疫苗。这3类疫苗均有一定的局限性,如减毒活疫苗不能从血清学上区分猪群中的疫苗接种猪和野毒感染猪(differentiation of infected from vaccinated animals,DIVA),给CSF的控制和净化带来了挑战;嵌合疫苗在DIVA鉴定诊断方面会受到牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)和边界病毒(Border disease virus,BDV)的交叉反应影响,样品检测的特异性低;而E2亚单位疫苗除了具有DIVA特性外,还具有安全性好、稳定性强、便于运输和储存等优点,是防控CSF的有效措施[7],但E2亚单位疫苗的免疫原性较低,不能提供完全保护[8-9]。因此,为了预防和控制CSF,开发安全有效的新型CSFV标记疫苗十分必要。近年来,已有学者利用不同的表达系统对E2亚单位疫苗进行表达研究,如大肠杆菌表达系统[10]、酵母表达系统[11]和杆状病毒-昆虫细胞表达系统[12]等,但E2亚单位疫苗的免疫原性并没有明显提高。为进一步开发E2亚单位疫苗,将E2蛋白与分子佐剂结合、使用改良佐剂的E2乳剂及使用流行株的E2蛋白等多种途径被尝试用于提高E2蛋白免疫原性[8]。细胞因子是参与免疫发展和调控的关键分子,已在一些治疗性和预防性疫苗中作为分子佐剂来提高抗原免疫效力[13-14]。其中,粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)在先天免疫和适应性免疫反应中有广泛的调节作用,如募集抗原递呈细胞(antigen-presenting cells,APCs)到抗原加工位点,增强抗原特异性CD8+T细胞反应等[13]。研究表明,GM-CSF可作为免疫佐剂增强抗原的免疫原性[15-16]。因此,在表达CSFV E2蛋白的同时表达GM-CSF,有望提高E2蛋白的免疫原性,增强免疫反应。CSFV的宿主细胞是哺乳动物细胞,用哺乳动物细胞表达CSFV E2蛋白更有利于其形成天然构象和合适的糖基化形式[17]。本研究通过构建稳定表达E2-GM-CSF融合蛋白的HEK293T重组细胞,实现E2-GM-CSF融合蛋白在哺乳动物细胞中的表达,并通过小鼠免疫试验分析E2-GM-CSF融合蛋白的免疫原性,以期为CSFV亚单位疫苗开发提供科学依据。
1 材料与方法
1.1 材料
HEK293T细胞(编号:CRL-3216)购自美国模式培养物集存库(American type culture collection,ATCC);慢病毒表达载体pCDH-CMV-MCS-EF1-copGFP-T2A-puro(pCDH)购自SBI公司;慢病毒包装质粒pMD2.G和psPAX2均购自ThermoFisher Scientific公司;DNA Marker、琼脂糖凝胶DNA回收试剂盒、细胞基因组DNA提取试剂盒均购自天根生化科技(北京)有限公司;嘌呤霉素盐酸盐和BCA蛋白浓度测定试剂盒均购自上海碧云天生物技术公司;His-TrapTMexcel预装柱购自GE公司;CSFV抗原检测ELISA试剂盒购自Median公司;Montanide ISA61佐剂购自SEPPIC公司。4~6周龄健康BALB/c雌鼠购自杭州华安生物技术有限公司。
1.2 重组慢病毒表达载体的构建
为了使E2蛋白分泌表达,去除其C-端胞内区和跨膜区的蛋白,同时在其C-端加入6个组氨酸标签以便于纯化。合成符合上述要求的CSFV 石门株E2基因(GenBank登录号:AF092448.2)和猪GM-CSF基因(GenBank登录号:AAB06854.1)并克隆至pGH载体构建pGH-E2和pGH-GM-CSF质粒。以pGH-E2和pGH-GM-CSF质粒为模板PCR扩增E2、E2-F和GM-CSF DNA序列(引物信息见表1),其中E2-F片段是在E2基因的5′-端加上与GM-CSF基因3′-端同源的序列。以E2-F和GM-CSF为模板,F1和R3为引物通过重叠PCR(Overlap PCR)扩增E2-GM-CSF基因。将E2和E2-GM-CSF基因与pCDH载体连接,连接产物转化大肠杆菌Stabl3感受态细胞,经EcoRⅠ和BamHⅠ双酶切和测序鉴定,重组质粒命名为pCDH-E2和pCDH-E2-GM-CSF。

表1 引物信息
1.3 重组慢病毒包装
将HEK293T细胞接种至6孔板,置于细胞培养箱中培养24 h,用新鲜培养基替换原培养基。配制DNA-转染试剂混合物:向DMEM培养液中加入pCDH-E2、pCDH-E2-GM-CSF或pCDH对照质粒和慢病毒包装质粒pMD2.G和psPAX2,再加入Lipo8000TM转染试剂,混匀后加至上述6孔板,继续培养72 h,收集培养上清,经滤膜过滤后,于-80 ℃保存。
1.4 重组细胞的构建和鉴定
分别用pCDH对照、E2和E2-GM-CSF慢病毒颗粒转导HEK293T细胞,经嘌呤霉素加压筛选后,获得HEK293T-pCDH对照细胞及HEK293T-E2和HEK293T-E2-GM-CSF重组细胞。将重组细胞接种至6孔板,培养120 h,收集细胞提取基因组DNA进行PCR验证;收集培养上清通过ELISA和Western blotting检测E2蛋白和E2-GM-CSF融合蛋白。设计并合成引物对基因组DNA进行PCR验证。引物序列为:上游引物:5′-CGCAAATGGG-CGGTAGGCGTG-3′;下游引物:5′-GGCACCGG-AGCGATCGCAGATC-3′。以基因组DNA为模板PCR扩增E2和E2-GM-CSF片段,产物经琼脂糖凝胶电泳检测。用CSFV抗原ELISA试剂盒检测培养上清中E2蛋白的表达,根据样品(sample)D450 nm值同阳性对照(positive)D450 nm值比较后得到的SP值(sample/positive),判断样品中蛋白的结果;以鼠抗猪GM-CSF单克隆抗体作为一抗,HRP标记的羊抗鼠IgG为二抗,Western blotting分析E2-GM-CSF融合蛋白。
1.5 重组蛋白的纯化
离心收集HEK293T-E2和HEK293T-E2-GM-CSF细胞培养上清,经滤膜过滤除杂,用His-TrapTMexcel柱进行蛋白纯化,用BCA蛋白浓度测定试剂盒检测纯化蛋白浓度。纯化后蛋白用10% SDS-PAGE胶分离,经考马斯亮蓝染色、纯水脱色后观察蛋白条带。
1.6 亚单位疫苗制备和免疫原性分析
将纯化后的E2蛋白、E2-GM-CSF融合蛋白和PBS与Montanide ISA61佐剂以2∶3比例混合制成疫苗。将4~6周龄BALB/c雌鼠随机分为3组,每组5只。E2组小鼠腹腔注射含25 μg E2蛋白的疫苗,200 μL/只;E2-GM-CSF组小鼠腹腔注射含25 μg E2-GM-CSF融合蛋白的疫苗,200 μL/只;对照组小鼠注射等体积的PBS乳剂。第1次免疫后21 d以相同剂量和相同方式进行第2次免疫。第1次免疫后第0、14、21和28天对免疫鼠采血,用于检测E2特异性抗体。
1.7 ELISA检测小鼠血清中的E2特异性抗体
利用间接ELISA方法测定免疫小鼠血清中抗体效价。用包被液稀释纯化的E2蛋白,以4 ng/μL E2蛋白包被96孔酶标板,于4 ℃包被过夜;PBST洗板3次;用含3% BSA的PBST室温封闭2 h;PBST洗板3次;加入梯度稀释的待检血清(血清从1∶300至1∶24 300进行3倍倍比稀释),室温孵育1 h;PBST洗板5次;加入HRP标记的羊抗鼠IgG,置于室温孵育1 h;PBST洗板5次;加入TMB显色液,避光显色10 min;加入硫酸终止显色,用酶标仪测定450 nm处的吸光值。
2 结 果
2.1 目的基因克隆
分别以pGH-E2和pGH-GM-CSF质粒为模板,PCR扩增E2、E2-F和F-GM-CSF DNA片段,得到大小分别约为1 089、1 157和438 bp 的E2、E2-F和F-GM-CSF条带(图1A)。 以纯化后的E2-F和F-GM-CSF为模板,用重叠PCR方法扩增E2-GM-CSF融合基因,得到大小为1 515 bp的E2-GM-CSF条带。表明成功扩增了E2和E2-GM-CSF基因,可用于重组质粒构建。
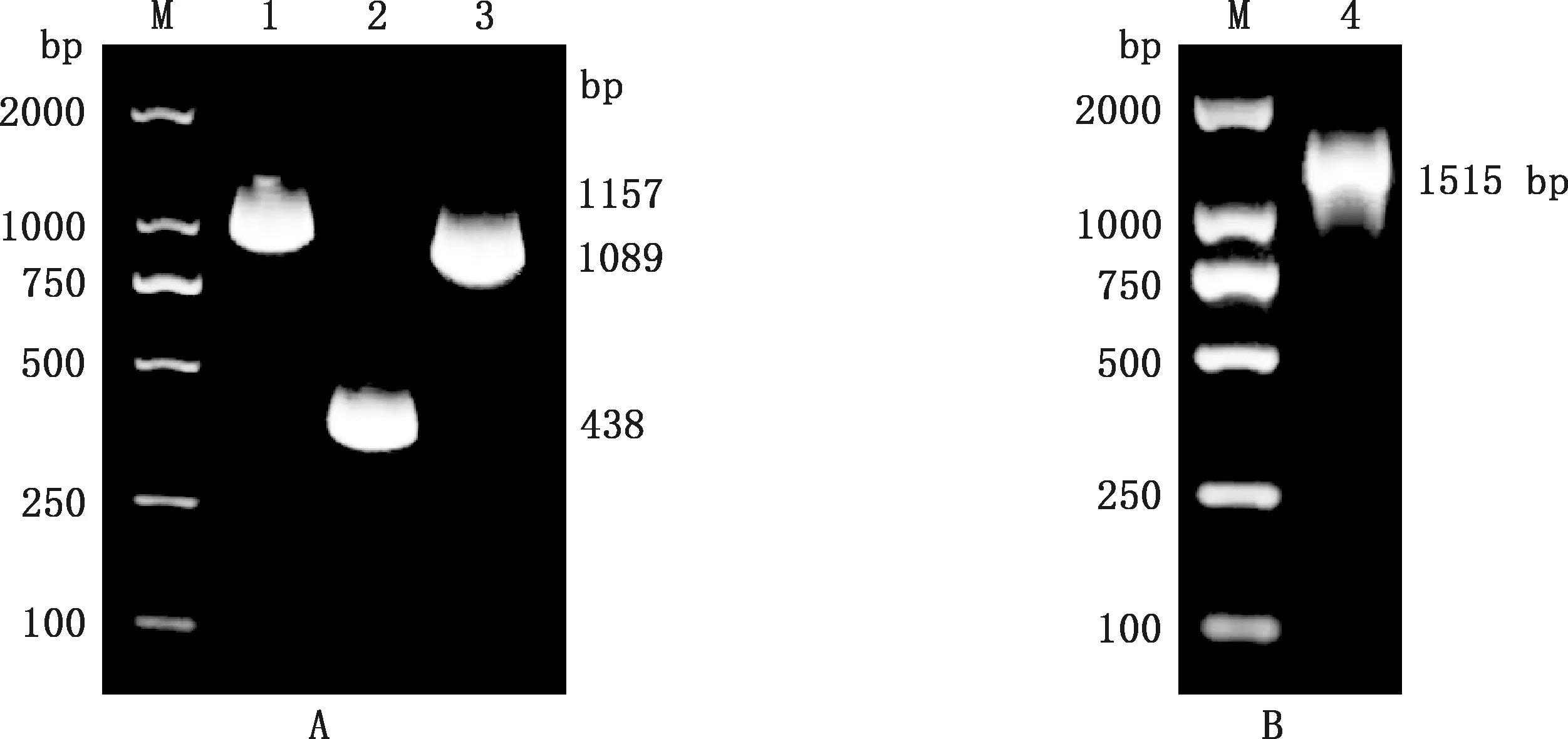
M,D2000 DNA Marker;1,E2-F片段;2,F-GM-CSF片段;3,E2基因;4,E2-GM-CSF基因
2.2 重组质粒pCDH-E2和pCDH-E2-GM-CSF的双酶切鉴定
重组质粒pCDH-E2和pCDH-E2-GM-CSF经EcoRⅠ和BamHⅠ双酶切鉴定,结果显示,分别得到大小为8 172 bp的载体片段及1 112和1 521 bp的E2及E2-GM-CSF基因片段(图2)。测序结果表明,重组质粒pCDH-E2和pCDH-E2-GM-CSF的目的基因序列正确。
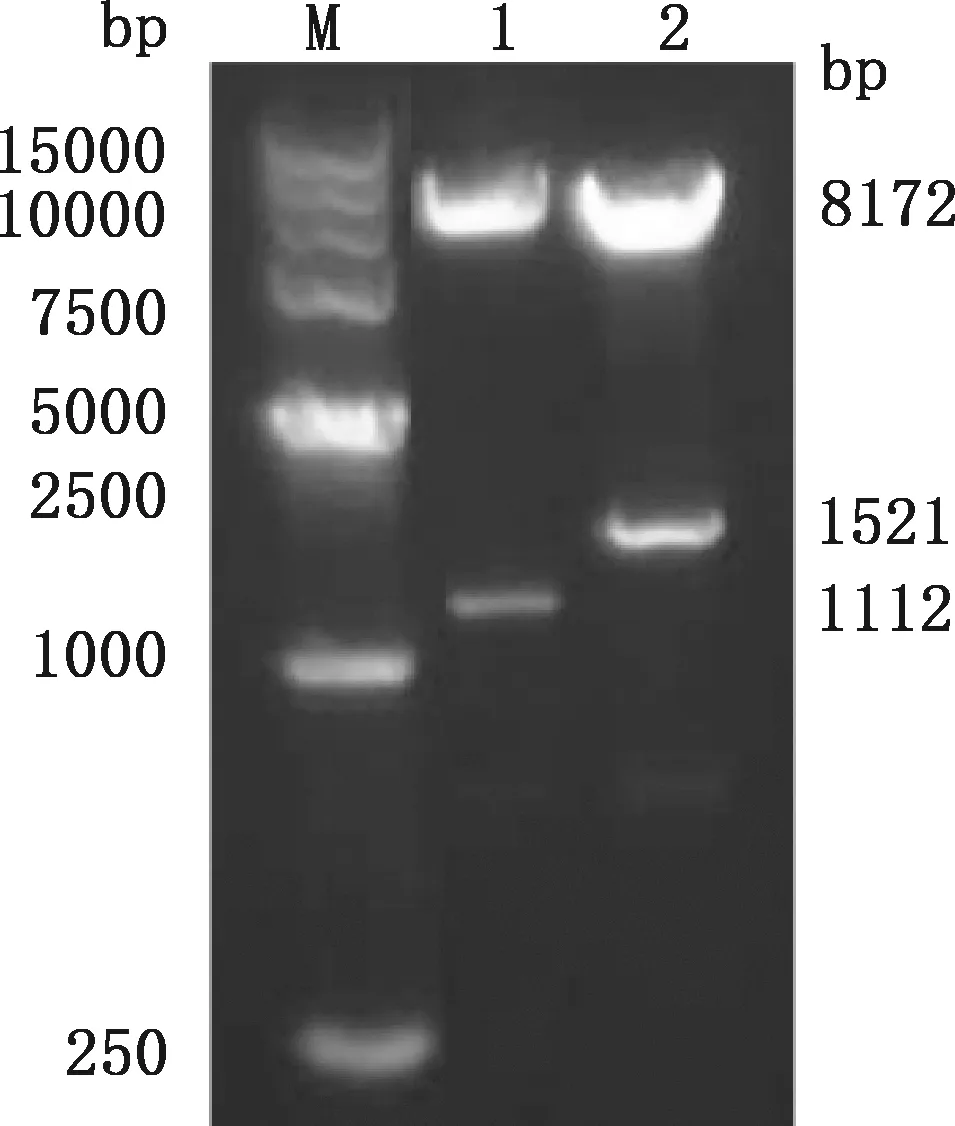
M,D15000 DNA Marker;1,重组质粒pCDH-E2双酶切;2,重组质粒pCDH-E2-GM-CSF双酶切
2.3 HEK293T-E2和HEK293T-E2-GM-CSF重组细胞鉴定
在HEK293T-E2和HEK293T-E2-GM-CSF细胞基因组DNA PCR产物琼脂糖凝胶电泳图中分别观察到1 258和1 686 bp的条带(图3),与预期大小相符,证明E2和E2-GM-CSF基因成功整合至细胞基因组DNA。
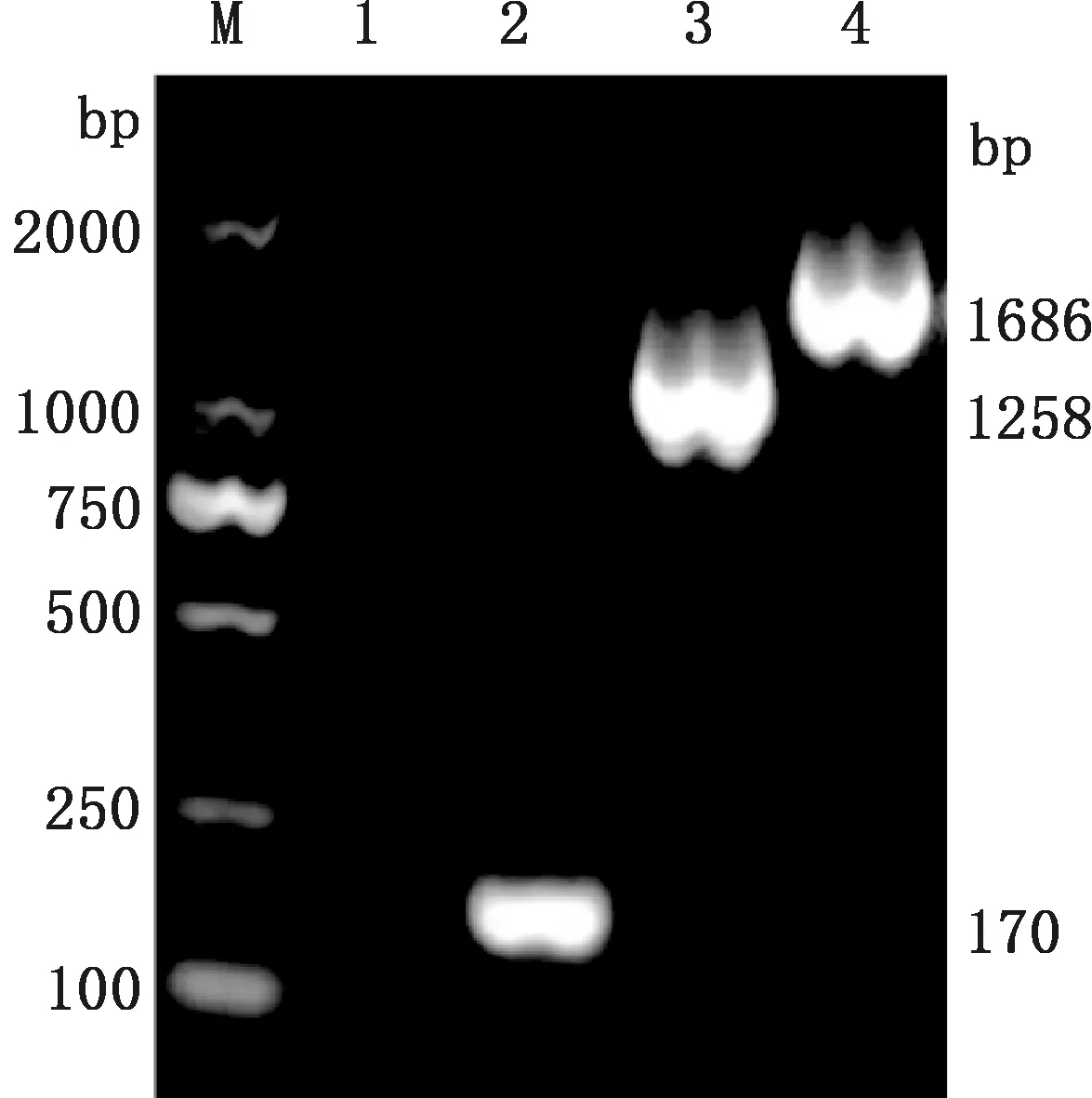
M,D2000 DNA Marker;1,未处理的HEK293T细胞;2,HEK293T-pCDH对照细胞;3,HEK293T-E2细胞;4,HEK293T-E2-GM-CSF细胞
2.4 重组蛋白的ELISA和Western blotting鉴定
收集重组细胞培养上清,进行ELISA和Western blotting鉴定。ELISA结果显示,未处理的HEK293T细胞和HEK293T-pCDH对照细胞培养上清SP值远<20%,未检测到E2蛋白;HEK293T-E2和HEK293T-E2-GM-CSF细胞培养上清SP值远>20%,检测到E2蛋白(图4),证明E2蛋白在重组细胞中分泌表达。Western blotting结果显示,细胞培养上清中检测到大小约70 ku的E2-GM-CSF融合蛋白(图5),说明E2-GM-CSF融合蛋白在重组细胞中分泌表达。
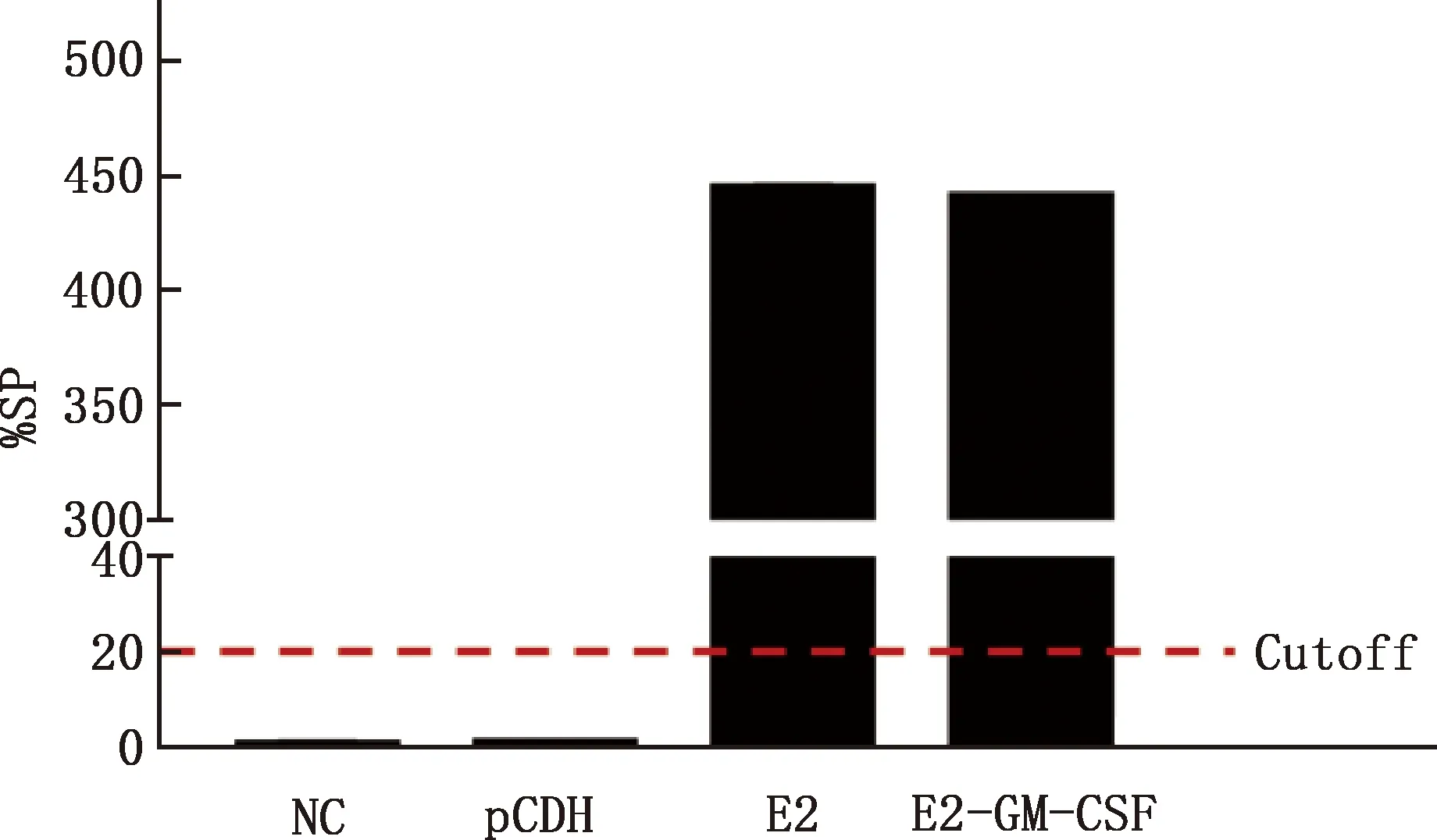
NC,未处理细胞上清;pCDH,HEK293T-pCDH对照细胞上清;E2,HEK293T-E2细胞上清;E2-GM-CSF,HEK293T-E2-GM-CSF细胞上清
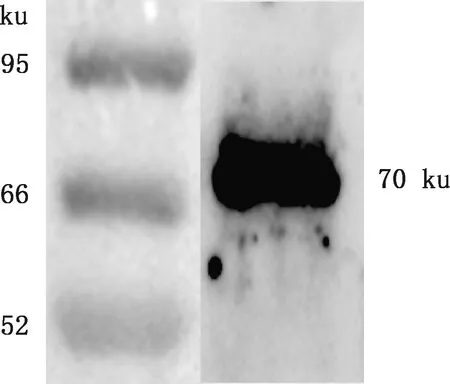
图5 Western blotting检测培养上清中的E2-GM-CSF融合蛋白
2.5 重组蛋白纯化
SDS-PAGE检测结果显示,获得清晰单一的大小分别约为50和70 ku的E2蛋白和E2-GM-CSF融合蛋白条带(图6),说明纯化后的E2蛋白和E2-GM-CSF融合蛋白纯度较高。
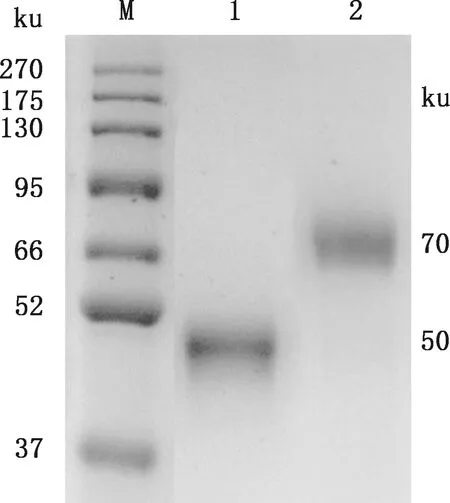
M,蛋白质分子质量标准;1,E2蛋白;2,E2-GM-CSF融合蛋白
2.6 小鼠血清E2特异性抗体检测
用ELISA检测免疫小鼠血清中的E2特异性抗体水平,结果见表2。由表2可知,PBS对照组小鼠血清中未检测到E2特异性抗体;E2组在免疫后14 d检测到E2特异性抗体,在免疫后28 d抗体效价达到最高值,为1∶1 800;E2-GM-CSF组在免疫后14 d检测到与E2组相同量的抗体,在免疫后21和28 d抗体效价均高于E2组,最高为1∶8 100,表明HEK293T细胞表达的E2蛋白和E2-GM-CSF融合蛋白均有免疫原性,且E2-GM-CSF融合蛋白的免疫原性更高。

表2 ELISA检测小鼠血清中的E2特异性抗体效价
3 讨 论
E2亚单位疫苗是新型CSFV疫苗的重要研究方向,但与减毒活疫苗相比,由于E2蛋白的免疫原性较低导致E2亚单位疫苗保护效果不理想,所以有必要配合高效的佐剂使用。已有研究表明,细胞因子作为“抗原-细胞因子”融合蛋白疫苗或作为“抗原+细胞因子”混合疫苗给药时可显著增强各种抗原的免疫原性,且作为“抗原-细胞因子”融合蛋白疫苗给药时,细胞因子表现出更好的佐剂活性[18]。GM-CSF是一类能促进早期造血细胞生成并调节成熟中性粒细胞功能的细胞因子,在临床上对调节免疫功能、促进疫苗的效果有显著作用。 Liu等[19]研究表明,GM-CSF可通过免疫应答增强HPV16/18疫苗的抗肿瘤作用,证明了GM-CSF的佐剂活性。又因为原核表达的E2蛋白缺乏正确的翻译后修饰且多为包涵体,而CSFV的宿主是哺乳动物细胞,用哺乳动物细胞表达CSFV E2蛋白更有利于其形成天然构象和合适的糖基化形式。
本研究构建了稳定表达E2-GM-CSF融合蛋白的HEK293T重组细胞,并通过小鼠免疫试验分析了表达的E2-GM-CSF融合蛋白的免疫原性。利用慢病毒载体构建了表达E2蛋白和E2-GM-CSF融合蛋白的HEK293T重组细胞,实现了重组蛋白在哺乳动物细胞中相对快速的生产。研究表明,E2蛋白缺乏合适的翻译后修饰,尤其是糖基化时不能诱导可检测的病毒中和抗体反应和针对CSFV的保护,且CSFV是哺乳动物细胞病毒,GM-CSF也是由哺乳动物细胞表达的细胞因子,所以与其他表达系统相比,哺乳动物细胞表达系统更有利于形成具有正确结构和合适糖基化的E2-GM-CSF融合蛋白[17,20]。Lorenzo等[21]利用HEK293细胞表达了CSFV E2蛋白和猪CD154分子的融合蛋白E2-CD154,发现即使在不同的培养条件下,HEK293细胞表达的蛋白批次间也具有高度的可重复性和一致性。这为用HEK293细胞表达E2蛋白和E2-GM-CSF融合蛋白提供了依据。通过常规质粒转染技术构建稳定细胞系费时费力,又因质粒在细胞基因组中的随机整合,使得结果难以预测,而慢病毒倾向于高频率整合至具有转录活性的染色质中,可在细胞中产生更高、更稳定的转基因表达[22-23]。因此,与质粒转染构建稳定细胞株相比,本研究用慢病毒载体构建表达E2蛋白和E2-GM-CSF融合蛋白的HEK293重组细胞是相对快速的方法。重组细胞表达的E2蛋白和E2-GM-CSF融合蛋白纯化后,通过小鼠免疫试验分析了其免疫原性。免疫小鼠血清的ELISA结果表明,E2-GM-CSF融合蛋白免疫原性高于E2蛋白。这与倪莅文等[24]用大肠杆菌表达的E2和GM-CSF融合蛋白的小鼠免疫结果一致,E2和GM-CSF融合蛋白比E2蛋白免疫小鼠后产生的抗体水平更高。而Wang等[25]进行的猪圆环病毒2型Cap蛋白(PCV2-Cap)亚单位疫苗的研究结果表明,Cap-PoGM-CSF融合蛋白免疫小鼠后诱导的PCV2特异性抗体水平与PCV2-Cap蛋白没有明显差异,但可引起更强的淋巴细胞增殖反应和更多的白介素-2和干扰素-γ分泌,表明GM-CSF不能增强由PCV2-Cap疫苗诱导的体液免疫,却可增强由PCV2-Cap疫苗诱导的细胞免疫。GM-CSF在体液免疫中展现不同作用的原因可能是由抗原蛋白本身的特点导致的,也可能与抗原蛋白与GM-CSF形成的融合蛋白的结构有关,具体原因还有待进一步研究。本研究并没有验证E2-GM-CSF融合蛋白是否会像Cap-PoGM-CSF融合蛋白一样引起更强的细胞免疫反应,所以需进行免疫试验进一步分析,E2-GM-CSF融合蛋白的免疫原性也需进行猪免疫和攻毒试验进一步评估。
4 结 论
本研究利用慢病毒载体构建了表达E2-GM-CSF融合蛋白的HEK293T重组细胞,可正确表达具有免疫原性的E2-GM-CSF融合蛋白,为预防和控制CSF提供了新型的候选E2亚单位疫苗,并为其他亚单位疫苗在哺乳动物细胞中的表达提供参考。
