双元调控系统LisRK对单增李斯特菌抗酸应激与侵袭力作用的研究
2022-03-03陈凌波方小伟吉俊芝杨玉莹
陈凌波,张 钰,方小伟,吉俊芝,方 春,杨玉莹
(长江大学动物科学学院,荆州 434025)
单核细胞增生李斯特菌(Listeriamonocytogenes),简称单增李斯特菌,是一种重要的人兽共患病原菌,该菌感染可以引发人和动物的李斯特菌病(listeriosis),表现为胃肠炎、败血症、脑膜脑炎和流产等,病死率约30%[1]。单增李斯特菌对环境的耐受力极强,该菌可以在高渗透压、宽泛的温度(0~45 ℃)和pH(4.5~9.0)等不利应激条件下存活甚至生长[2]。双元调控系统(two-component system,TCS)是细菌中重要的信号转导系统,负责感受环境信号并将其转导至细菌体内,调控相关靶基因的表达使得细菌能够对环境变化信号作出响应[3]。典型的TCS由组氨酸激酶(histidine kinase,HK)和响应调节蛋白(response regulator,RR)两部分组成。HK锚定在细胞膜上感受特定的环境信号刺激以激活自身激酶活性,活化的激酶水解ATP使得HK上特定组氨酸残基发生磷酸化;磷酸化的HK将磷酸基团传递给对应的RR,RR接收结构域上的天冬氨酸残基被磷酸化激活后导致其输出结构域构象改变,后者通过结合靶基因的启动子调控靶基因发挥作用[4]。细菌通常拥有多套TCS以应对不同的信号刺激,根据单增李斯特菌基因组序列预测该菌基因组至少编码16套TCS[5-6]。这些TCS在调控单增李斯特菌毒力、抗生素耐药性以及抵抗环境应激等方面发挥重要作用。Jiang等[7-8]发现VirSR介导单增李斯特菌生物被膜形成以及对多种抗生素的敏感性。LiaFSR系统则参与单增李斯特菌应对温度、酸碱度、渗透压、氧化应激以及抵抗抗生素和消毒剂的杀伤作用[9-10]。Pontinen等[9,11]敲除lisK基因,发现单增李斯特菌在低温条件下生长速度减慢,但不影响该菌在高温、高渗以及氧化应激条件下的生长能力。Aslan等[12]敲除lisR基因显著减弱单增李斯特菌对玻璃界面的黏附能力和对氨苄青霉素的耐受。唯一的孤儿反应调节因子DegU则介导细菌的毒力、运动性以及生物被膜形成能力[13]。尽管除了DegU外,其他TCS都成对存在,但发挥作用过程并非完全一一对应,Alistair等[14]发现,在缺磷条件下,枯草芽孢杆菌的PhoPR系统的HK(PhoR)可以激活YycFG系统的RR(YycF),调控下游靶基因应对磷饥饿。目前尚不清楚其他TCS间是否存在相互作用导致其表现出多种功能。本研究拟利用同源重组技术整体敲除lisRK基因簇,进而阐明其对单增李斯特菌环境适应性和致病性的影响。
1 材料与方法
1.1 材料
1.1.1 菌株与载体 单增李斯特菌参考菌株10403S(血清型为1/2a型)、穿梭质粒pKSV7和回补质粒pIMK2均由浙江大学动物科学学院方维焕教授馈赠。肠上皮细胞Caco-2和胃腺癌细胞MGC803分别由浙江农林大学动物科技学院程昌勇博士和南华大学医学院刘罗根博士馈赠。BALB/c小鼠购自长江大学医学院实验动物中心。
1.1.2 主要试剂 脑心浸液培养基BHI购自北京陆桥生物技术有限公司;LB培养基购自生工生物工程(上海)股份有限公司;核酸染料GoldView购自上海赛百盛公司;琼脂糖凝胶回收试剂盒、质粒提取试剂盒以及DNA Marker均购自武汉擎科生物技术有限公司;限制性核酸内切酶BamHⅠ购自NEB公司;无缝克隆试剂盒购自北京艾德莱生物有限公司。
1.2 方法
1.2.1 缺失株与回补株的构建 缺失株构建方法参照文献报道[15],具体过程如下:根据参考菌株10403S基因组信息(登录号:CP002002),运用Vector NTI软件设计携带lisRK基因上、下游同源臂的重组质粒pFL315,本研究所用的引物由武汉擎科生物技术有限公司合成(表1)。首先以10403S基因组为模板用pFL315-A/B和pFL315-C/D分别扩增上、下游同源臂,PCR产物回收后用引物pFL315-A/D通过重叠延伸PCR获得融合的同源臂;再利用无缝克隆试剂盒将纯化的同源臂与BamHⅠ线性化的穿梭载体pKSV7连接形成重组质粒pFL315;连接产物转化大肠杆菌DH5α感受态细胞并涂布含100 μg/mL氨苄青霉素的LB平板;挑取单菌落进行PCR鉴定,阳性克隆送武汉擎科生物科技有限公司测序,确认插入的片段无误。
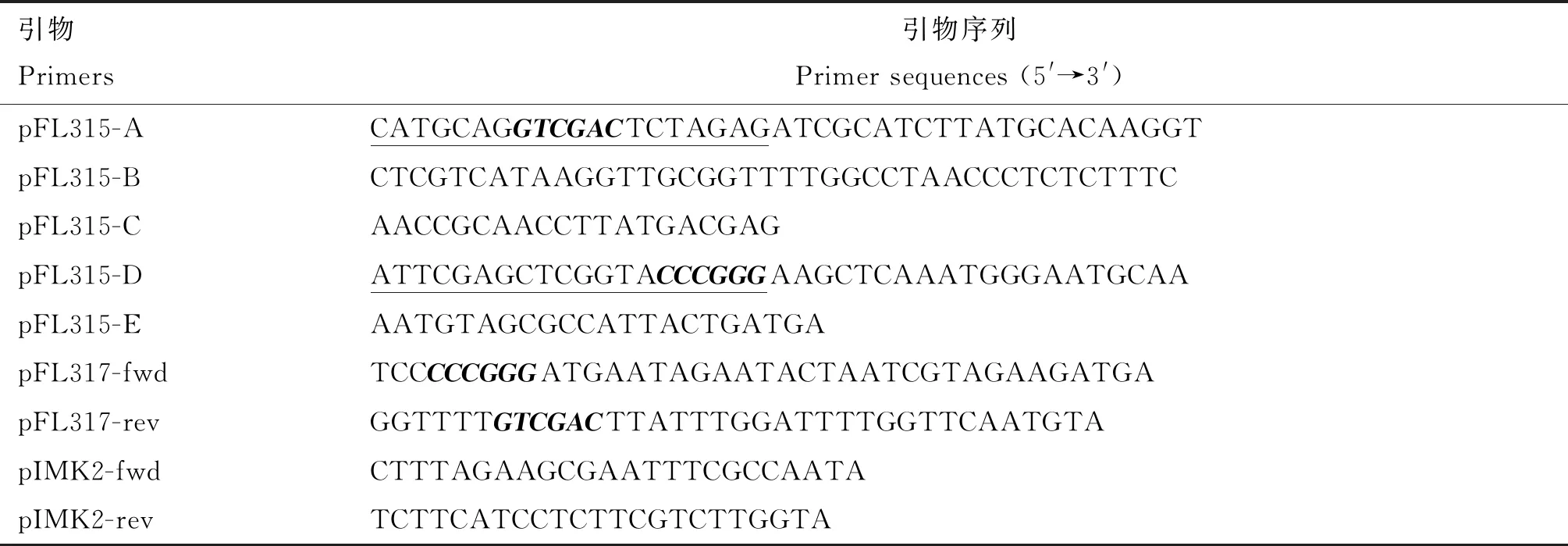
表1 PCR引物信息
将重组质粒pFL315电转至单增李斯特菌10403S感受态细胞中,然后涂布含10 μg/mL氯霉素的BHI平板,于37 ℃培养箱中培养2~3 d,待长出菌落后进行PCR鉴定;阳性克隆转接至含10 μg/mL的氯霉素BHI培养基中,于42 ℃培养箱中连续传代,并通过旁侧引物鉴定是否完成同源重组;将完成同源重组的克隆转移至无抗BHI培养基,于30 ℃培养箱中连续传代以消除重组后的质粒,获得缺失株ΔlisRK。
回补株构建方法:用引物pFL317-fwd/rev扩增lisRK基因片段,PCR产物经SalⅠ和SmaⅠ双酶切后与酶切的pIMK2连接,连接产物转化大肠杆菌DH5α感受态细胞,挑取单克隆分别用质粒引物pIMK2-fwd/rev和特异性引物pFL317-fwd/rev进行PCR鉴定,阳性的单克隆送测序,将回补质粒电转入缺失株ΔlisRK,构建回补株CΔlisRK。
1.2.2 应激生长曲线测定 分别挑取亲本株10403S、缺失株ΔlisRK和回补株CΔlisRK单菌落于3 mL BHI培养基中,37 ℃振荡培养12 h。分别取1 mL菌液,12 000 r/min离心收集菌体,用BHI培养基将菌体重悬,再用不同应激培养基(pH 4.5、5% NaCl和10 mmol/L H2O2)分别将原菌液按1∶10连续倍比稀释2次,至终浓度为原菌液的1%,然后取200 μL菌液接种于96孔板,每组3个平行,放置于37 ℃培养,每隔1 h使用酶标仪测定D600 nm值,于平台期停止测定。
1.2.3 酸应激存活试验 分别挑取亲本株10403S、缺失株ΔlisRK和回补株CΔlisRK单菌落于3 mL BHI培养基中,在37 ℃摇床中过夜培养。分别取1 mL菌液,12 000 r/min离心收集菌体,用PBS洗涤2次后再用1 mL PBS进行重悬。 取50 μL菌液加入950 μL pH 2.5的BHI培养基中,涡旋混匀后置于37 ℃培养箱孵育1 h。通过平板计数确定处理前的菌数N0和应激处理后存活的菌数N1,应激存活率(SR)的计算公式为:SR=N1/N0×100%,试验重复3次。
1.2.4 细胞侵袭试验 分别挑取亲本株10403S、缺失株ΔlisRK和回补株CΔlisRK单菌落于3 mL BHI培养基中,在37 ℃摇床中过夜培养。同时准备生长状态良好的肠上皮细胞Caco-2或胃腺癌细胞MGC803铺12孔板,每组4个平行孔。次日去除旧培养基,细胞用无菌PBS清洗3次,加入1 mL无抗DMEM,收集过夜培养的细菌,经PBS洗涤3次后,倍比稀释至合适梯度,每孔加入50 μL菌液使感染复数(MOI)约为10∶1,混匀后置于37 ℃含5% CO2培养箱中孵育,实际感染剂量N0通过平板计数确定。感染后30 min弃去培养液,用PBS洗3次后加入含50 μg/mL庆大霉素的DMEM培养基,于细胞培养箱中继续孵育1 h,弃培养液后洗涤3次,每孔加入1 mL灭菌去离子水充分吹吸混匀,使得细胞破裂,释放出细菌,倍比稀释后通过平板计数确定侵入细胞的细菌数N1。侵袭率IR= N1/N0×100%,试验重复3次。
1.2.5 小鼠毒力试验 将4周龄BALB/c小鼠随机分为3组,每组6只,于IVC笼具中饲养1周以适应环境。分别挑取亲本株10403S、缺失株ΔlisRK和回补株CΔlisRK单菌落于3 mL BHI培养基中,在37 ℃摇床中过夜培养,离心收集菌体,用PBS洗涤3次后,再用PBS重悬,倍比稀释至合适的梯度备用。上述各组菌液经腹腔注射途径感染小鼠,0.2 mL/只(约106CFU),通过平板计数法确定实际感染剂量。感染48 h后将小鼠脱颈处死,无菌剖检采集肝脏和脾脏,置于研钵中,加入1 mL PBS进行充分研磨,匀浆液经倍比稀释后进行平板计数,确定感染小鼠肝脏和脾脏中的细菌载量。
1.2.6 统计分析 试验结果以3次重复的平均值±标准偏差表示,试验数据采用GraphPad Prism 5.0软件做图,利用非配对单因素方差分析(One-Way ANOVA)方法进行统计分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结 果
2.1 缺失株与回补株的构建
本研究利用同源重组技术构建缺失株ΔlisRK,首先以10403S基因组为模板,分别扩增得到lisRK基因的上游和下游同源臂片段,大小分别为639 bp和640 bp(图1),与预期一致;再以纯化的上游和下游同源臂为模板,通过融合PCR扩增得到大小为1 279 bp的融合同源臂片段(图1)。融合的同源臂与BamHⅠ线性化的pKSV7重组连接后获得重组质粒pFL315,PCR鉴定大小为1 279 bp(图1)。重组质粒电转至单增李斯特菌10403S感受态细胞中,在41 ℃条件下传代10~12次后利用旁侧引物进行PCR筛选重组成功的克隆,PCR鉴定大小为1 591 bp(图1);重组成功的克隆接种至BHI培养基中,于30 ℃条件下传代消除质粒,再利用旁侧引物和质粒上cat基因引物进行PCR鉴定,亲本株扩增的片段大小为3 720 bp,缺失株片段大小为1 591 bp(图1),表明成功筛选到缺失株ΔlisRK。
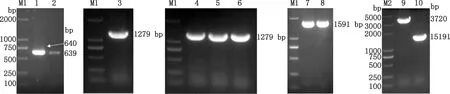
M1,DL2000 DNA Marker;1,上游同源臂;2,下游同源臂;3,融合的上、下游同源臂;4~6,重组质粒pFL315;7~8,重组成功的克隆;M2,DL5000 DNA Mark;9,亲本株10403S;10,缺失株ΔlisRK
PCR扩增得到lisRK基因片段,大小2 150 bp(图2),与pIMK2载体连接后得到回补质粒,用质粒引物pIMK2-fwd/rev和特异性引物pFL317-fwd/rev进行PCR扩增得到大小分别为3 010 bp和2 150 bp的片段,显示成功构建回补质粒(图2)。将回补质粒电转入缺失株ΔlisRK感受态细胞,挑取单克隆进行PCR鉴定,得到2 150 bp大小的目的片段,结果显示回补株CΔlisRK构建成功(图2)。
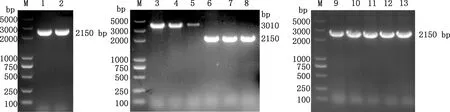
M,DL5000 DNA Marker;1~2,lisRK基因片段;3~5,质粒引物鉴定lisRK回补质粒;6~8,特异性引物鉴定lisRK回补质粒;9~13,回补株CΔlisRK
2.2 lisRK基因缺失对单增李斯特菌抗应激能力的影响
本研究利用pH 4.5、含5% NaCl和10 mmol/L H2O2的BHI的培养基评估LisRK是否介导单增李斯特菌对酸、碱渗透压以及氧化条件等应激环境的抵抗能力。结果显示,亲本株10403S、缺失株ΔlisRK和回补株CΔlisRK在正常BHI培养基中生长并无差异(图3A);在pH 4.5的BHI培养基中缺失株ΔlisRK的生长能力显著弱于亲本株,回补株CΔlisRK与亲本株的生长能力相当(图3B);在含5% NaCl及10 mmol/L H2O2的BHI培养基中单增李斯特菌生长速度较正常条件下慢,但亲本株与缺失株的生长能力亦无显著性差异(图3C和3D)。为进一步验证LisRK介导单增李斯特菌的抗酸应激作用,比较10403S和ΔlisRK在致死性酸性条件下存活率发现,在pH 2.5的BHI培养基中应激处理1 h,缺失株ΔlisRK的存活率(0.57%)极显著低于亲本株10403S(2.07%)和回补株CΔlisRK(1.97%)(P<0.01);回补株与亲本株的存活率则并无显著性差异(P>0.05)(图4)。
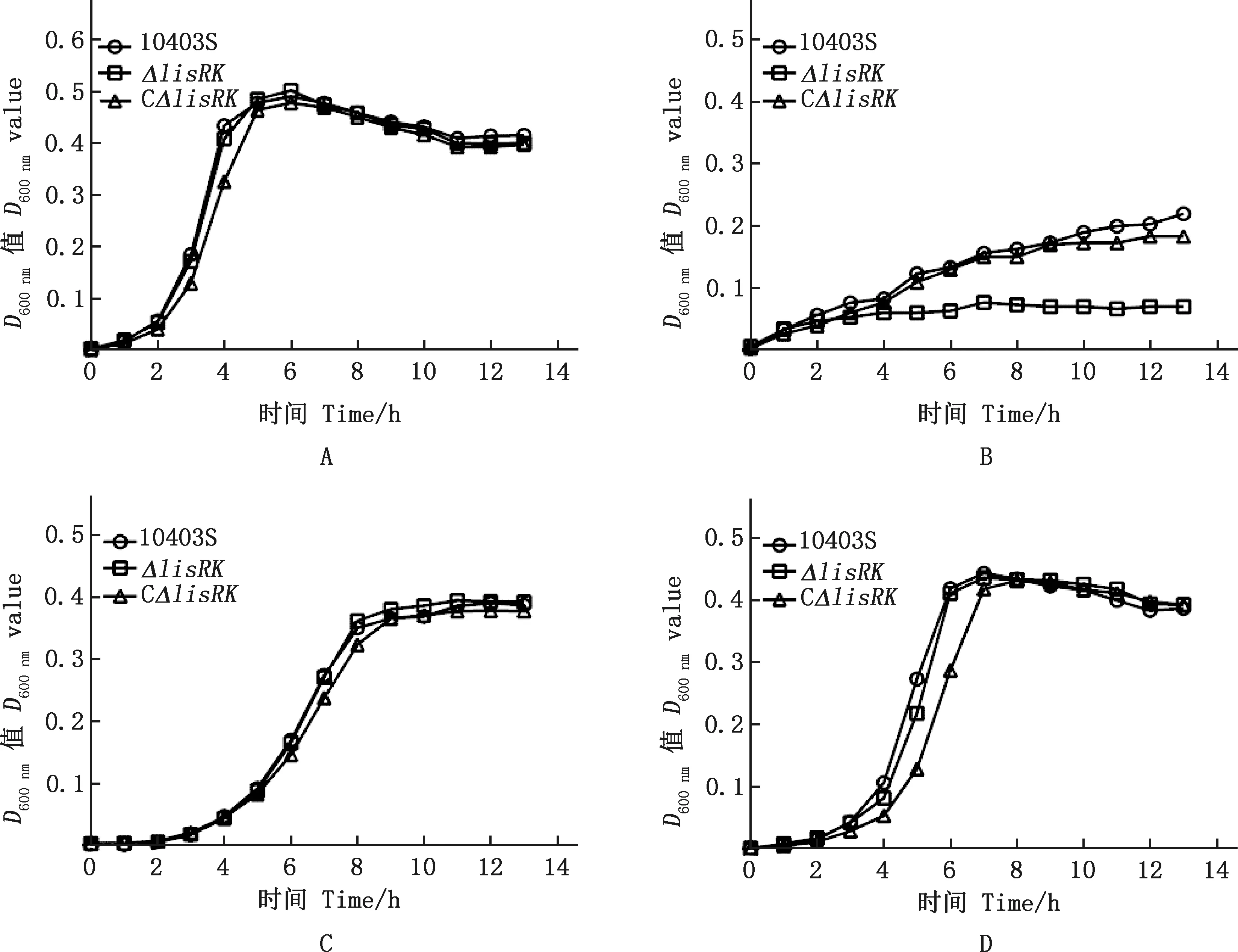
A,pH 7.0;B,pH 4.5;C,5% NaCl;D,10 mmol/L H2O2
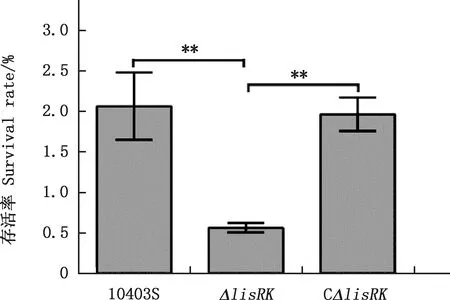
*,差异显著(P<0.05);**,差异极显著(P<0.01);无*,差异不显著(P>0.05)。下同
2.3 lisRK基因缺失对单增李斯特菌侵袭能力的影响
本研究利用检测亲本株、 缺失株与回补株对肠上皮细胞Caco-2和胃腺癌细胞MGC803的侵袭能力,结果显示,细菌与细胞孵育0.5 h后,缺失株ΔlisRK对Caco-2细胞的侵袭率(2.04%)极显著低于亲本株10403S(7.72%)与回补株CΔlisRK(6.92%)(P<0.01);回补株CΔlisRK对Caco-2细胞的黏附率则与亲本株并无显著性差异(P>0.05)(图5A)。MGC803细胞侵袭试验结果表明,缺失株ΔlisRK对MGC803细胞的侵袭率(0.13%)极显著或显著低于亲本株10403S(0.29%)和回补株CΔlisRK(0.21%)(P<0.01;P<0.05)(图5B)。
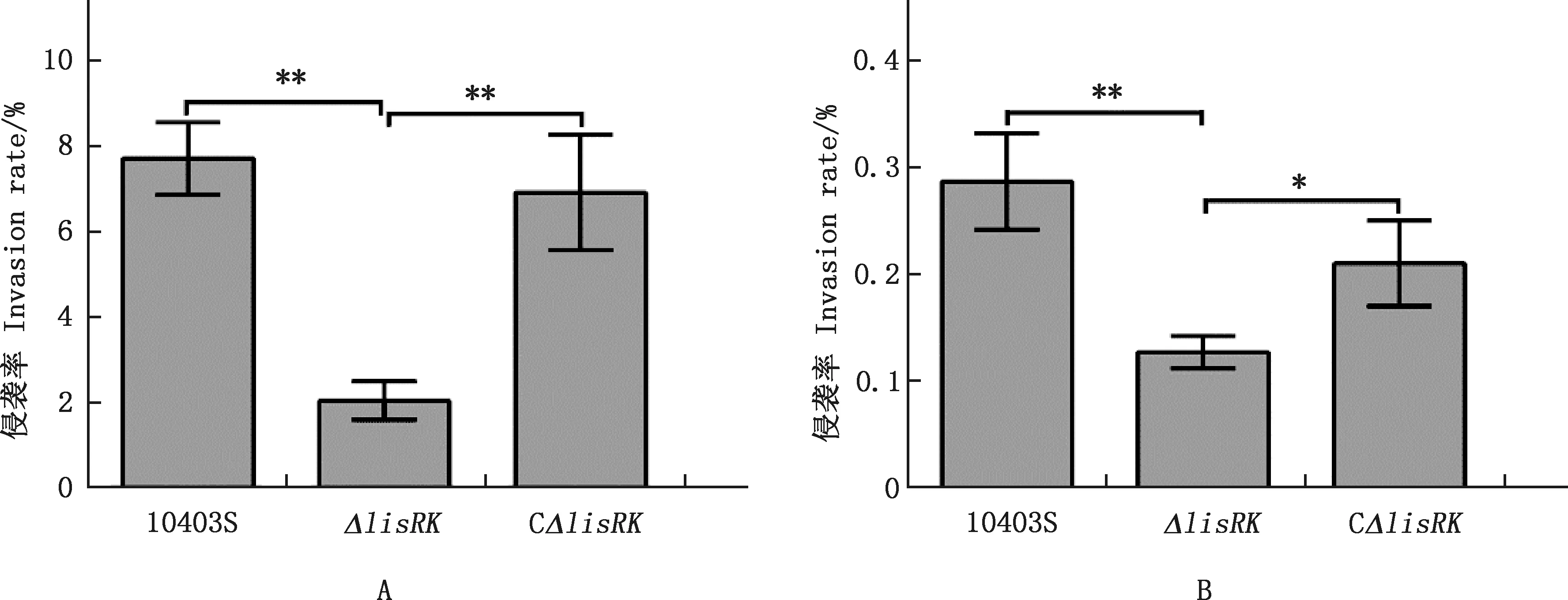
图5 亲本株10403S、缺失株ΔlisRK与回补株CΔlisRK对Caco-2细胞(A)和MGC803细胞(B)的侵袭率
2.4 lisRK基因缺失对单增李斯特菌致病力的影响
本研究比较了感染亲本株、缺失株与回补株的小鼠肝脏和脾脏中的细菌载量,结果显示,腹腔注射后48 h,感染缺失株ΔlisRK的小鼠肝脏中载菌量(7.42×107CFU)低于亲本株(2.17×108CFU)和回补株CΔlisRK(2.88×108CFU);缺失株在脾脏中载菌量(1.87×107CFU)亦低于亲本株(5.58×107CFU)和回补株CΔlisRK(4.34×107CFU),但均无显著性差异(P>0.05)(图6),提示lisRK缺失可能减弱单增李斯特菌的致病性。
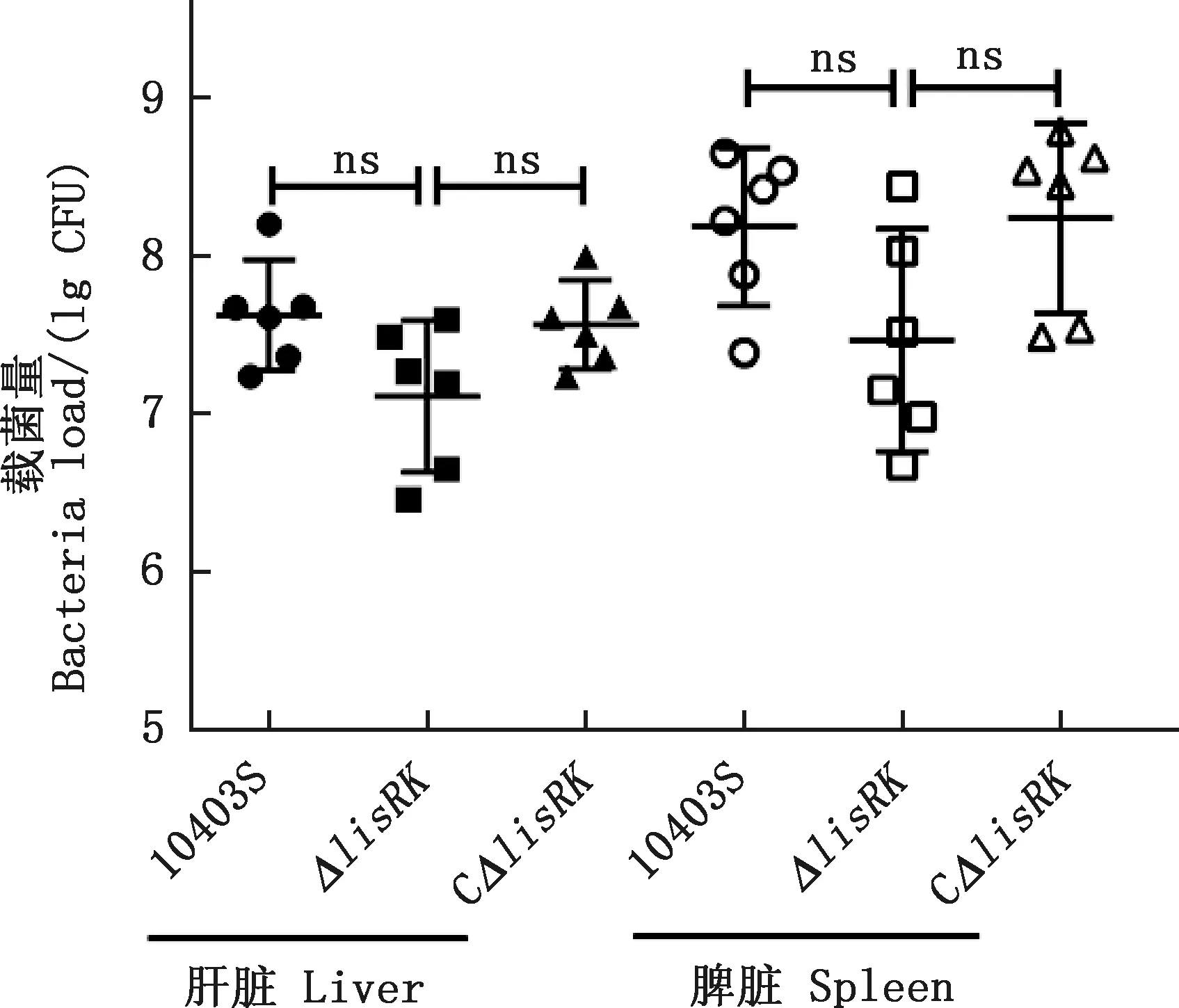
ns,差异不显著(P>0.05)
3 讨 论
作为一种食源性病原菌,单增李斯特菌对不利环境的适应性和抵抗能力是其成功建立感染的前提[16-17]。TCS是细菌中重要的信号转导系统,单增李斯特菌拥有多套TCS以应对各种胞外信号刺激[18]。本研究利用同源重组技术首次整体敲除了LisRK系统,应激生长和存活试验表明缺失lisRK基因显著降低了单增李斯特菌在酸性环境中的生存能力,但不影响其在高渗和氧化应激条件下的生长能力。这与Cotter等[19]的发现一致,在LO28菌株中转座子插入lisK基因导致其在pH 3.5条件下的存活率显著降低,表明LisRK可以介导单增李斯特菌的抗酸应激作用。但Pontinen等[9]却发现在菌株EGDe中敲除lisK基因并不影响该菌的抗酸应激能力,这可能与菌株特性相关。已有研究表明,EGDe的抗酸应激能力较其他代表菌株弱[20-21]。本研究中细胞侵袭试验表明,缺失lisRK基因显著降低了对人源胃腺癌细胞MGC803和肠上皮细胞Caco-2的侵袭率。Aslan等[12]通过原子力显微镜发现了类似的表型,在LO28菌株中激活LisRK系统可以显著增强该菌对玻璃界面的黏附能力,敲除lisR基因则显著减弱该菌的黏附能力。表明LisRK可以影响单增李斯特菌的黏附与侵袭能力。在LO28菌株中,4 μg/mL头孢呋辛刺激导致inlA和inlB等主要黏附侵袭相关基因表达水平显著下调,lisR基因缺失则导致LO28对头孢呋辛敏感性显著增加[22],在单增李斯特菌中对宿主细胞的黏附侵袭作用主要由内化素InlA、InlB以及黏附相关蛋白LAP等分子介导[23-24],但尚不清楚LisRK是否通过直接调控黏附与侵袭基因的表达介导单增李斯特菌的黏附侵袭作用。本研究中小鼠毒力试验显示,经腹腔注射感染后48 h,缺失株ΔlisRK在感染小鼠肝脏和脾脏中的载菌量均低于亲本株和回补株,但差异均不显著,提示LisRK可能影响单增李斯特菌对小鼠的致病性。本研究与Cotter等[19]发现在LO28菌株中单独缺失lisK基因显著降低该菌对小鼠的致病力不完全一致。可能与试验动物个体差异较大有关,或者仅选择感染后48 h这一个时间点不能全面反映小鼠体内细菌数量的动态水平,尽管之前的研究显示,单增李斯特菌感染后24、48以及72 h小鼠体内载菌量与其致病性正相关[25]。也有可能是菌株间差异所致,同样基因在不同菌株中的作用并非相同:Cotter等[19]发现,在LO28中敲除lisK基因能显著降低该菌在3.5%乙醇中的存活率,然而Pontinen等[9]发现在EGDe中敲除lisK基因并不影响该菌在3.5%乙醇中的生长能力。 还可能与不同TCS间相互作用有关:Alistair等[14]发现细菌的TCS并非完全一一对应,不同TCS组分之间存在互作并交叉激活的情况;Su等[26]发现在沙门氏菌中,PhoP能被CheR甲基化,突变PhoR上甲基化位点导致其不能磷酸化激活而减弱该菌的毒力。此外,Brunhede等[27]发现单独敲除lisR或lisK基因对单增李斯特在土壤中适应性的影响并非完全一致。因此,尚不能确定缺失完整LisRK系统与缺失LisK组分对单增李斯特菌的毒力影响不一致是否由于LisRK与其他TCS间互作所致。
4 结 论
本研究以参考菌株10403S为亲本株构建了双元调控系统lisRK基因缺失株,证实LisRK缺失显著降低单增李斯特菌的酸应激存活能力,以及对胃腺癌细胞MGC803和肠上皮细胞Caco-2的侵袭率,具体机制有待进一步深入研究。
