大鲵源迟缓爱德华菌的生物学特性及其感染的病理损伤
2022-03-02郭向辉康振亚欧阳萍陈德芳黄小丽
向 菲,郭向辉,康振亚,冯 杨,欧阳萍,陈德芳,黄小丽,耿 毅*
(1.四川农业大学动物医学院,成都 611130;2.四川农业大学动物科技学院,成都 611130)
大鲵(Andrias davidianus)俗名“娃娃鱼”,属两栖纲(Amphibian)有尾目(Caudata)隐鳃鲵科(Crypto⁃branchidae)大鲵属(Andrias),为国家濒危二级水生野生保护动物,已被列入濒危野生动植物种国际贸易公约(CITES公约)附录Ⅰ中[1],具有很高的营养与药用价值,同时也是研究生物进化机制的好材料[2]。随着大鲵繁殖技术的成熟,人工养殖在我国华中、西南及西北等地区快速发展,并逐步成为地方优势特色产业,但在大鲵养殖的发展过程中疾病的制约作用也逐渐显现出来,以大鲵蛙病毒(CGSRV)[3-4]、嗜水气单胞菌(Aeromonas hydrophila)[5]、维氏气单胞菌(Aeromonas veronii)[6]和类志贺邻单胞菌(Plesiomo⁃nas shigelloides)[7]等生物性病原的危害较大。
迟缓爱德华菌(Edwardsiella tarda)隶属于肠杆菌科的爱德华菌属,是一种革兰氏阴性、短杆状、能运动的机会致病菌[8],通常在水温高、水质差和有机物含量高等条件下引发疾病,给水产养殖业造成严重危害[9]。该菌可感染鳗鲡(Anguilla japonica)、牙鲆(Paralichthys olivaceus)、黄颡鱼(Pelteobagrus ful⁃vidraco)、大菱鲆(Scophthatmus maximus)、中华鳖(Trionyx sinensis)和牛蛙(Rana catesbiana)等多种水生动物[10]。本研究从四川雅安与都江堰两养殖场的患病大鲵体内分离到两株优势菌(XY01、XY02),根据形态、生理生化特性及16S rDNA序列分析鉴定为迟缓爱德华菌,并对分离菌的药物敏感性、毒力基因及其感染的病理损伤进行测定分析,以期为大鲵迟缓爱德华菌感染的防治提供参考,同时也为阐释其致病机制提供资料。
1 材料和方法
1.1 材料
1.1.1 患病大鲵
患病大鲵来自四川雅安和都江堰两养殖场,体重(1.8±0.3)kg。
1.1.2 主要试剂
LB营养琼脂购自青岛高科技工业园海博生物技术有限公司;细菌基因组DNA提取试剂盒、DL2000 DNA marker和PCR master mix购自南京诺唯赞生物科技有限公司;药敏纸片购于杭州微生物试剂有限公司。
1.2 方法
1.2.1 病原菌分离与形态学观察
在无菌条件下,从病死大鲵的肝、肾、腹水取样接种LB琼脂平板,28℃培养24~48 h,挑取形态大小一致的单个优势菌落在LB平板上再次划线培养,获得纯培养菌株,并观察其菌落与菌体形态特征,-20℃保存备用。
1.2.2 分离菌生理生化特性与药物敏感性测定
生理生化特性测定采用微量生化法参照《常见细菌系统鉴定手册》[11]进行。药敏试验采用K-B法,将菌液均匀涂布平板,28℃培养24 h测定抑菌圈的直径并判定结果,根据杭州微生物试剂有限公司提供的标准[12]进行判定。
1.2.3 分离菌16S rDNA基因序列分析
取对数生长期的新鲜菌液,离心收集菌体,提取细菌基因组DNA作为模板。采用一对扩增细菌16S rDNA基因的通用引物[13](F:5′-AGAGTTTGAT CCTGGCTCAG-3′;R:5′-TACGGCTACCTTGTTACG AC-3′)PCR扩增16S rDNA基因,预期扩增片段大小 约 1 500 bp。 PCR 反 应 体 系 :12.5 μL mix,8.5 μL ddH2O,2 μL primer,2 μL 模板DNA。循环条件:95℃预变性3 min;95℃变性15 s,55℃退火15 s,72℃延伸1 min,共30个循环;最后,72℃延伸5 min。1%的琼脂糖凝胶电泳检测。PCR产物经DNA纯化试剂盒纯化后测序。将测序获得序列在GenBank中经Blast比对,选取相似性较高的序列,采用Clustal M进行多序列同源性比对(Multiple alignments),按邻接法(Neighbor-joining method)用MEGA7.0软件构建系统进化树。
1.2.4 分离菌毒力基因的PCR检测
参考文献[14],合成迟缓爱德华菌的citC、fimA、gadB、katB、mukF和esrB毒力基因的PCR检测引物(表1),检测分离菌相关毒力基因携带情况。

表1 PCR检测毒力相关基因的引物Table.1 The primers of PCR detection for virulence-related genes
1.2.5 组织病理学观察
取患病大鲵心、肝、脾、肾、肠和肌肉等组织,10%的中性福尔马林固定,石蜡包埋,常规切片,HE染色,中性树胶封片,光学显微镜下观察并照相记录。
2 结果
2.1 患病大鲵的病理剖检
患病大鲵腹部膨胀,肛门红肿,腹部及尾部皮肤灶性褪色、发白,黏液减少,甚至坏死形成溃烂,后肢腿部肿大,趾间出血,发红(图1a);腹腔内充满大量含血腹水(图1b);肝脏血管扩张淤血,肿大,呈土黄色(图1c);脾脏肿胀、淤血呈暗红色,表面见大小不等的白色结节(图1d);肾脏肿大,淤血,偶见出血点(图1e);肠道充血,肠腔内无食物,充满多量黏液,肠壁变薄(图1f)。
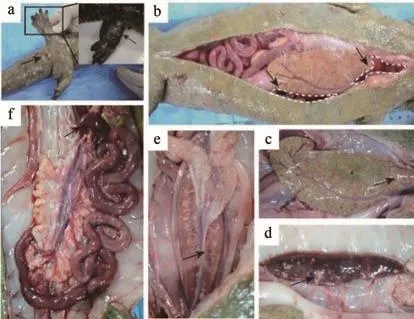
图1 患病大鲵剖检变化Figure 1 Necropsy changes of diseased giant salamander
2.2 病原菌分离与形态特征
从两地患病大鲵体内分别分离到一株优势细菌(XY01、XY02),在LB平板上呈灰白色、光滑、湿润、圆形的半透明状。菌体呈革兰阴性、无荚膜,直径 1 μm,长2~3 μm的短杆菌(图2)。
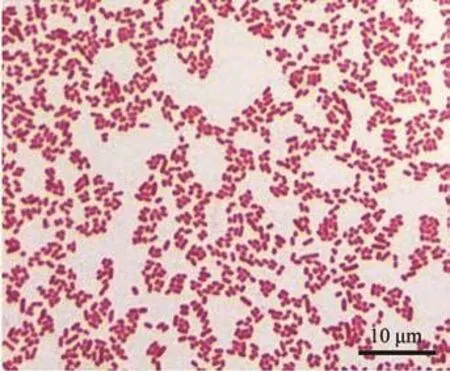
图2 细菌革兰染色结果Figure 2 Gram stain result of bacteria
2.3 分离菌生理生化特性及药物敏感性
分离菌XY01、XY02的生理生化特性见表2,与E.tarda[11]的生理生化特性基本一致。药敏结果(表3)显示:两分离菌株对罗红霉素、阿莫西林、万古霉素、卡那霉素和复方新诺明等耐药;对氧氟沙星、头孢西丁、氟苯尼考、庆大霉素和多黏菌素-B等敏感,但两分离株在多西环素、四环素与头孢他啶等药物的敏感性上存在一定差异,详见表2。

表2 分离株XY01、XY02生理生化特性Table 2 Biochemical and physiological characteristics of the isolated strain XY01 and XY02

表3 XY01、XY02药敏试验结果Table 3 Drug sensitivity test results of isolated strain XY01 and XY02
2.4 分离菌16S rDNA基因序列分析
PCR扩增出两分离菌株XY01和XY02的16S rDNA基因片段,测序后序列提交至NCBI,登录号为MW672113和MW694894。在GenBank中经Blast比对发现两分离菌株XY01、XY02与迟缓爱德华菌的同源性最高,再以两分离菌及Genbank中爱德华菌属相关菌株的16S rDNA基因序列构建系统进化树(图3),分离菌株XY01和XY02与迟缓爱德华菌聚为一簇。

图3 基于分离菌基与相关菌株16S rDNA基因序列构建的系统发育树Figure 3 Phylogenetic tree based on16SrDNA sequence of isolates(XY01、XY02)and other related species in Edwardsiella genus
2.5 致病性相关毒力基因的PCR检测
对两分离株XY01、XY02进行6种毒力基因(citC、fimA、gadB、katB、mukF、esrB)的PCR检测,结果见图4,表明两分离菌均携带6种毒力基因。
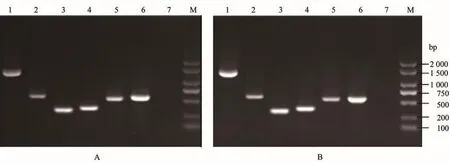
图4 两分离菌株(XY01、XY02)毒力基因的PCR检测电泳图Figure 4 The electropherogram of PCR detection virulence genes in two isolates(XY01、XY02)
2.6 组织病理学观察
肝细胞广泛性空泡变性,并发生坏死形成坏死灶,大量淋巴细胞、巨噬细胞浸润(图5a);脾脏红白髓界限不清,毛细血管与脾窦扩张淤血,脾髓淋巴细胞数量减少,大量巨噬细胞浸润,散在大小不等的坏死灶(图5b);肾小球毛细血管内皮细胞肿胀,炎症细胞浸润,肾小囊内大量淡红染渗出物及一定量炎症细胞;肾小管上皮细胞肿胀,颗粒变性甚至发生坏死;肾间质毛细血管扩张淤血,出血,巨噬细胞、淋巴细胞及中性粒细胞浸润(图5c);肠黏膜上皮细胞坏死,脱落,固有膜裸露,固有膜、黏膜下层及肌层大量巨噬细胞、淋巴细胞及中性粒细胞浸润(图5d);心肌纤维颗粒变性、空泡变性,甚至坏死,形成坏死灶,并在一些坏死灶内见蓝染的细菌团块;肌间隙增宽,巨噬细胞、淋巴细胞浸润(图5e);骨骼肌间隙增宽,水肿,间隙内充滞大量淡红染的水肿液,肌纤维变性、坏死,横纹消失,肌浆凝固,均质红染(图5f)。

图5 患病大鲵组织病理损伤Figure 5 Histopathological lesions of diseased giant salamander
3 讨论
迟缓爱德华菌(Edwardsiella tarda)1965年由W.H.Ewing等命名[15],广泛存在于自然界,尤其是水环境中,是水产养殖动物重要的病原菌[10,16],感染的水生动物超过25种,给全球水产养殖造成严重的经济损失,同时也是鸟类、两栖类、爬行类以及人类的病原菌[17-18]。本研究中,从患病大鲵体内分离鉴定了2株迟缓爱德华菌,进一步的毒力基因检查发现两分离菌株citC、fimA、gadB、katB、mukF和esrB均为阳性,而毒力基因(citC、fimA、gadB、katB、mukF和esrB)的存在与否被认为是判定该菌为致病株或非致病株的重要依据[19],由此可见,分离菌株XY01、XY02是致病菌株,临床上感染的大鲵不仅出现明显的临床症状,同时发生死亡也证明了这一点。本研究表明迟缓爱德华可自然感染大鲵,并引起死亡,因此,在大鲵的养殖过程中应重视该菌的危害,加强防控。
现有研究表明,迟缓爱德华菌感染鱼类的主要组织病理损伤为化脓性间质性肾炎与化脓性肝炎[8],但本研究中发现感染大鲵的组织病理损伤主要表现为变质肝炎、渗出性肾小球肾炎与间质性肾炎,与鱼类的组织病理损伤特点存在差异,同时感染大鲵还表现出明显的肠炎与坏死性脾炎等与鱼类存在明显的差异,这可能与宿主的种属差异有关。吴中明等[20]研究发现迟缓爱德华菌感染大鲵在多组织器官均有细菌团块的聚集,表明该菌可在大鲵体内多组织、器官定殖,从而引起病理损伤,甚至导致死亡,在我们的研究中也发现感染大鲵全身多组织出现明显的损伤与炎症反应,尤其是肝、脾、肾和肠的病理损伤较为严重,并在损伤的心肌中发现细菌团块,进一步证实了上述观点。感染大鲵在临床上出现明显的腹水与后肢肿大等临床特征,可能是由于肝、肾严重的结构损伤引起蛋白合成障碍、肾小球滤过性增强、肾小管重吸收能力降低等致血管内外液体交换及球-管失衡,从而使钠、水在体内潴留出现水肿所致。
尽管大菱鲆迟缓爱德华菌活疫苗在我国已获批上市,但目前还未开展该疫苗对其他水生动物迟缓爱德华菌感染预防的免疫效应评价[21-22],抗菌药物的使用仍是目前防治大鲵等水生动物迟缓爱德华菌感染的重要手段。本研究中发现两地的分离株对氧氟沙星、头孢西丁、氟苯尼考、庆大霉素和多黏菌素-B等敏感,据此采用氟苯尼考内服进行治疗,很好地控制了疫情。值得注意的是两地分离的菌株在头孢他啶、头孢呋辛、多西环素与新霉素等药物的敏感性上存在一定差异,因此,在治疗该菌感染时应根据药物敏感性检测结果选择用药,避免药物滥用,确保有效用药,同时降低细菌耐药性产生的风险。此外,Peng B.等[23]通过对具有耐药性的迟缓爱德华菌代谢状态的研究,发现外源性丙氨酸或葡萄糖可使细菌恢复对卡那霉素的敏感性;Zeng Z.H.等[24]发现葡萄糖通过代谢重编程增强了罗非鱼抵抗迟缓爱德华菌侵袭的能力;G.P.Richards[25]也阐述了噬菌体被用于治疗迟缓爱德华菌病及其他细菌病的有效性,这些环境友好型防控方法的不断探索,有望为今后爱德华菌感染的有效防控提供新的策略。
