西红花FT同源基因的表达及功能分析
2022-03-02杨柳燕裴卫忠张永春
王 桢 杨柳燕 裴卫忠 李 心 杨 贞 张永春*
(1. 上海市农业科学院林木果树研究所,上海 201499;2. 上海市药材有限公司,上海 200003)
对高等植物来说,开花是从营养生长阶段向生殖生长阶段转换的重要生活阶段,与不同信号网络的排列组合紧密相关。研究表明在拟南芥()中至少存在5 条不同的开花调控途径:光周期途径、春化/温度途径、自主途径、赤霉素途径以及年龄途径等。()是三大开花途径整合子之一,可以整合来自光周期、春化/温度等不同开花途径的信号,促进植物开花,在植物开花过程中发挥着重要作用。2007 年,在拟南芥和水稻()中同时被证实,FT-like 蛋白作为“成花素”,主要在叶片中表达,通过筛管运输到茎尖分生组织(SAM),与锌指蛋白FD(FLOWERING LOCUS D)互作,促进下游、、等花分生组织特征基因和花器官决定基因的表达,促进成花转换,启动花发育过程。基因在成花转变过程中起重要作用,且同源基因的序列相似性很高,使得对基因的分离和功能研究发展很快,先后从葡萄()、玉米()、黄瓜()、苹果()、土豆()、杨树()、郁金香()等多种植物中分离出同源基因,并进行了一系列的生物学分析,逐渐揭示了不同物种同源基因在调控开花时间及其它多方面的功能。
西红花(L.)为鸢尾科(Iridaceae)番红花属()多年生球根植物,又名藏红花、番红花。其红色的干燥柱头和花柱可入药,是我国紧缺的名贵药材之一。还广泛应用于食品香料、天然染料等行业,集多种用途于一身,被誉为“红色金子”。上海崇明岛作为我国最早开始西红花人工种植的地区之一,从上世纪70 年代末进行引种栽培,形成了独有的“两段法”栽培模式,目前西红花已经成为上海市的道地中药材之一。
笔者前期对西红花田间栽培阶段的营养生长过程和室内储藏阶段的花芽分化、开花过程进行了观测。自然条件下,西红花的花期主要集中在10 月底至11 月上旬,单朵花期短,给花丝的采收带来很大的人工压力。研究发现温度处理能显著影响西红花花芽分化的有无和花发育、开花进程,但是迄今为止,鲜见对西红花成花诱导过程的分子机理进行深入探索的文献报道,分离到的开花相关的基因也不多,主要集中在MADS-box基因家族等。Tsaftaris 等从西红花中分离得到3 个同源基因,、和,但没有进一步进行功能鉴定等。因此,为深入理解西红花基因在西红花开花、休眠和球茎膨大等重要发育过程中的功能,本研究对Tsaftaris等克隆出的3 个西红花基因通过qRT-PCR 分析其在不同组织中的表达情况,通过转化烟草()和拟南芥及其突变体进行功能验证,期望为探索西红花基因的功能和基因资源的开发利用等研究提供参考。
1 材料与方法
1.1 试验材料
1.1.1 植物材料
2018 年11 月至2019 年11 月将西红花种球种植于崇明华宇西红花种植专业合作社基地。期间,11 月至5 月为大田繁育球茎阶段,5 月至11 月为室内储藏球茎阶段。
烟草栽培种‘NC89’种植于上海市农业科学院实验室培养箱,生长条件为24 ℃,16 h/22 ℃,8 h,用于遗传转化和对照。
拟南芥Col 和突变体-(Ler 生态型)用于遗传转化和对照,Ler 生态型用于对照,均种植于实验室培养箱,生长条件为24 ℃,16 h/22 ℃,8 h,用于遗传转化或对照。其中,突变体-(Ler 生态型)购买自拟南芥生物资源中心(Bio‐logical Resource Center,USA),编号CS56。
1.1.2 各种酶及生化试剂
各种限制性内切酶、T4-ligase 连接酶等购自Thermo 公司。DNA 琼脂糖凝胶回收试剂盒、质粒提取试剂盒购自Axygen 公司。植物RNA 提取试剂盒RNeasy PowerPlant Kit 购自Qiagen 公司。反转录试剂盒Evo M-MLV、SYBR Green Pro Tag HS预混型qPCR试剂盒等购自艾科瑞生物公司。
1.1.3 菌株及载体
pMD18-T 载体购于TaKaRa 公司。大肠杆菌菌株DH5α 感受态,农杆菌感受态EHA105、GV3101 均购买自上海唯地生物科技有限公司。超量表达载体pMOG22为实验室保存。
1.2 试验方法
1.2.1 西红花基因组DNA提取
称取0.1 g鲜叶片,于液氮中研磨成粉末,根据CTAB法提取西红花基因组DNA。
1.2.2 西红花总RNA提取及逆转录
称取0.1 g 鲜叶片和花芽,于液氮中研磨成粉末,根据RNeasy PowerPlant Kit 植物总RNA提取试剂盒的操作步骤,提取总RNA。采用Evo M-MLV反转录试剂盒反转录合成cDNA第一链。
1.2.3 西红花基因组DNA 和cDNA 全长扩增
根据Tsaftaris文中提供的西红花3 个基因的引物序列,以基因组DNA(gDNA)和cDNA 为模板进行PCR 扩增。通过测序得到基因序列后,自行设计特异性正向和反向引物,用于超量表达载体构建。引物序列如表1,下划线表示酶切位点,用于构建超量表达载体的3对引物两端分别加有酶切位点RⅠ/HⅠ,Ⅰ/RⅠ,RⅠ/Ⅰ;用于构建亚定位载体的3 对引物两段均加有酶切位点Ⅰ/Ⅰ。试验所用引物及测序均由上海生工生物技术有限公司提供服务。

表1 扩增西红花FT基因全长的特异引物Table 1 Gene specific primers used to isolate complete FT coding sequences of saffron
1.2.4 西红花表达分析
采集不同生长阶段的球茎、叶片、花等为材料,根据RNeasy PowerPlant Kit 总RNA提取试剂盒的操作步骤,提取总RNA,进行基因的定量表达分析。详细取样部位为,大田繁育阶段:1 月份子球茎、叶片、主根、侧根,4 月份子球茎、顶芽;室内储藏阶段:9 月份叶片、花瓣、花药、柱头。以西红花作为内参基因,检测-在上述样品中的表达水平(引物见表2)。使用Roche LightCy‐cle480 System 荧光定量PCR 仪。每个样品设置3次重复。数据采用2法方法进行处理。

表2 qRT-PCR分析特异引物Table 2 Gene specific primers used for qRT-PCR analysis
1.2.5 西红花序列分析、系统进化分析
序列分析和多序列比对使用ClustalW 软件,基因序列作图使用GeneDoc 软件。系统进化分析使用MEGA 5.0软件,采用邻接法(Neighbor Join‐ing,NJ),使用1 000个重复进行Bootstrap检验。为了分析西红花基因与其他被子植物同源基因的系统进化关系,我们从GenBank(http://www.ncbi.nlm.nih.gov)数据库中选取了已报道的功能确定(花期控制方面)的同源基因共同构建系统进化树。
1.2.6 西红花超量表达载体构建和遗传转化
扩增出的cDNA 特异片段通过DNA 琼脂糖凝胶回收试剂盒进行回收,连接pMD18-T 载体,热激转化大肠杆菌DH5α 感受态细胞。挑选阳性克隆摇菌,提质粒,再通过相应的酶切位点,酶切,回收,连接超量表达载体pMOG22。构建的超量表达载体分别命名为35S::,35S::,35S::.
将35S::,35S::,35S::超量表达载体转化农杆菌菌株EHA105 感受态细胞,采用叶盘转化法异源转化烟草‘NC89’。
将35S::,35S::,35S::超量表达载体转化农杆菌菌株GV3101 感受态细胞,采用花序浸染法转化拟南芥()Col生态型和突变体-(Ler生态型)。
1.2.7 转基因植株的检测及表型观测
采集待检测的烟草和拟南芥植株的叶片,采用Trizol 法提取RNA 进行PCR 分子鉴定。分别以烟 草和 拟 南 芥作 为 内 参 基 因(见表3)。

表3 RT-PCR分析特异引物Table 3 Gene specific primers used for RT-PCR analysis
选取至少20株T0代转基因烟草植株进行表型观测的数据统计,包括3个指标—开花时主茎的叶片数量,初花时植株高度和从移栽到开花的时间。
选取至少20 株T1 代转基因拟南芥植株进行表型观测的数据统计,包括3个指标—抽薹时莲座叶叶片数量,抽薹时茎生叶叶片数量和从播种到开花的时间。
运用SAS 进行方差分析(one-way ANOVA)和显著性分析(Duncan’s multiple range test)。
2 结果与分析
2.1 西红花CsatFT 全长gDNA 和cDNA 的克隆及系统进化分析
以西红花叶片gDNA 和叶片、花芽cDNA 为模板,采用特异引物(见表1)进行PCR 扩增,分别得到了3 个西红花基因gDNA 和cDNA 的全长序列。如图1 所示,扩增出的3 个西红花基因gDNA 包含长度分别为835、1 642 和1 132 bp 的完整开放阅读框(ORF),和其它绝大部分物种中同源基因的结构一致,包含4 个外显子(exon)和3个内含子(intron),并且它们第二个和第三个外显子的长度一致,分别是62 和41 bp(见图1:A)。扩增出的3 个西红花基因cDNA 包含长度分别为528、525 和540 bp 的ORF,分别编码175、174 和179个氨基酸。
用Clustal W 软件进行多序列比对分析,发现分离出的3 个CsatFT 的序列相似性达到79.44%,与模式植物拟南芥AtFT 氨基酸序列的相似性也达到69.66%、72.57%和71.51%。并且它们都含有保守的氨基酸位点,即FT 中的Tyr85 和Gln140 氨基酸残基(见图1:B)。
同时,为了分析克隆出的西红花基因与其他被子植物同源基因的系统进化关系,我们从GenBank(http://www.ncbi.nlm.nih.gov)数据库中选取了已报道的功能确定(花期控制方面)的同源基因,利用MEGA 5.0 软件进行系统进化分析。如图1C 所示,CsatFT1、CsatFT2、CsatFT3 分别和同为单子叶植物的水仙()、麝香百合()LlFT 和洋葱()AcFT1表现出较近的遗传距离。同时,这3个同源基因都具有促进开花的早花功能。
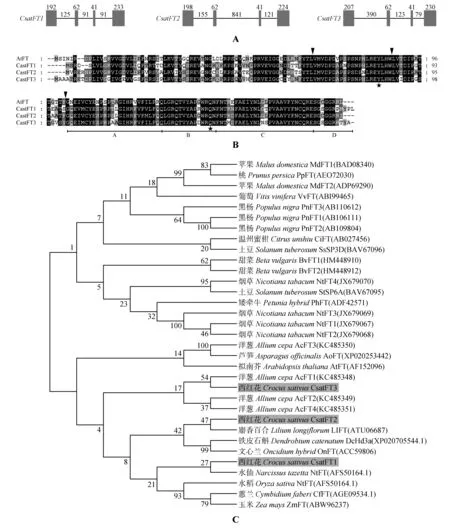
图1 西红花CsatFT基因的结构、氨基酸序列比对及系统进化分析A.FT同源基因结构;方框和横线分别表示外显子和内含子,数字表示各自的长度(bp);B.FT同源基因预测氨基酸序列比对;星号表示保守的氨基酸位点,三角表示拟南芥FT基因外显子和内含子的边界,第四个外显子被分为ABCD四部分[25];C.不同物种FT同源基因的系统进化分析,灰色方框表示3个西红花FT基因,CsatFT1,CsatFT2和CsatFT3Fig.1 Gene structures and alignment of amino acid sequences and phylogenetic analysis of CsatFT homologs of saffronA.Gene structures of FT;Boxes indicate exons and lines indicate introns,the numbers represent their corresponding lengths(bp);B.Alignment of amino acid sequences of FT homologs;Boxes and asterisks represent the conserved residues;Triangles show the exon boundaries of FT of Arabidop‐sis.The four segments of the fourth exon are shown as A,B,C and D[25];C.Phylogenetic analysis of the FT homologs from different plant species.Grey boxes represent three FT genes of saffron,CsatFT1,CsatFT2 and CsatFT3
2.2 CsatFT的表达模式分析
如图2 所示,1 月份,子球茎膨大至直径约1 cm,、、在叶片中表达水平最高,侧根中次之,子球茎、主根中极低几乎检测不到;4月份,子球茎膨大至直径约3 cm,叶片上部开始枯萎,此时剥开外层的膜质结构可见明显的顶芽,顶芽处于营养生长状态,、、都在子球茎中表达水平高,顶芽中极低几乎检测不到;在室内储藏开花阶段(5~11月),9 月份,顶芽已经萌发,剥开低出叶可见明显的叶片和花器官,、、在柱头中表达水平最高,叶中次之,花瓣和花药中较低,其中和在花药中几乎检测不到。
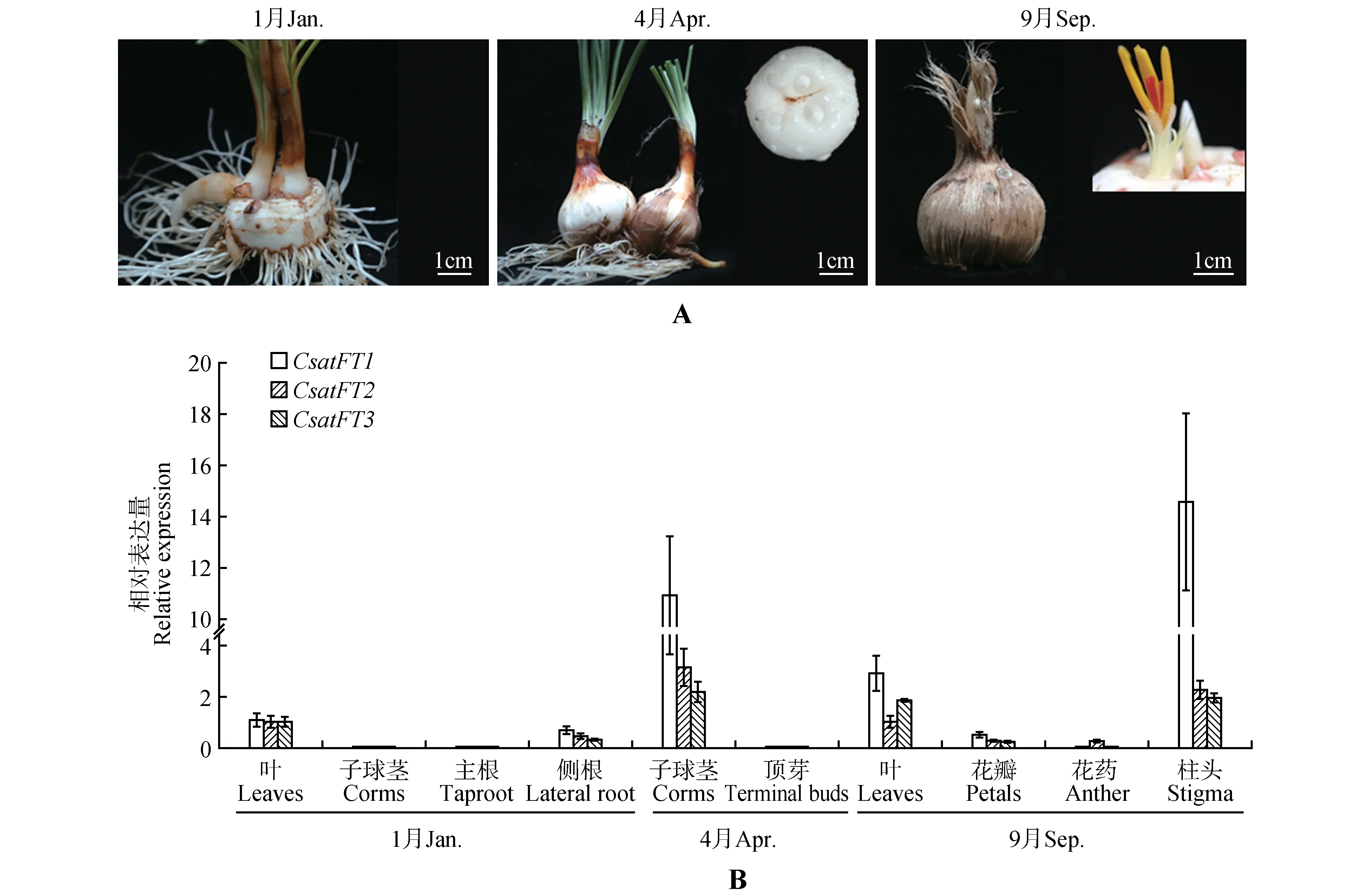
图2 西红花CsatFT的qRT-PCR表达分析A.西红花不同生长发育时期和采样部位;B.CsatFT1、CsatFT2、CsatFT3在不同组织部位的相对表达量Fig.2 qRT-PCR analysis of FT expression in saffronA.The different development phases and the tissues used of saffron;B.Relative expression levels of CsatFT1,CsatFT2 and CsatFT3 in different tissues
2.3 异源转化CsatFT基因烟草的表型分析
如表4 所示,、和转基因烟草植株开花时间都显著提前。T0代植株移栽60 d 后,几乎所有转基因植株均已开花,而野生型烟草还未显蕾(见图3:A)。35S::、35S::和35S::转基因植株的开花时间分别为(59.90±3.21)、(61.80±3.79)和(59.50±2.37)d,都显著低于野生型所需要的开花时间(68.10±1.86)d。但是,35S::、35S::和35S::转基因植株开花时主茎上的叶片数量与野生型相比没有显著性差异;35S::转基因植株开花时植株高度为(28.90±2.85)cm,与野生型(29.10±1.86)cm 相比没有显著性差异,35S::、35S::转基因植株高度显著高于野生型。
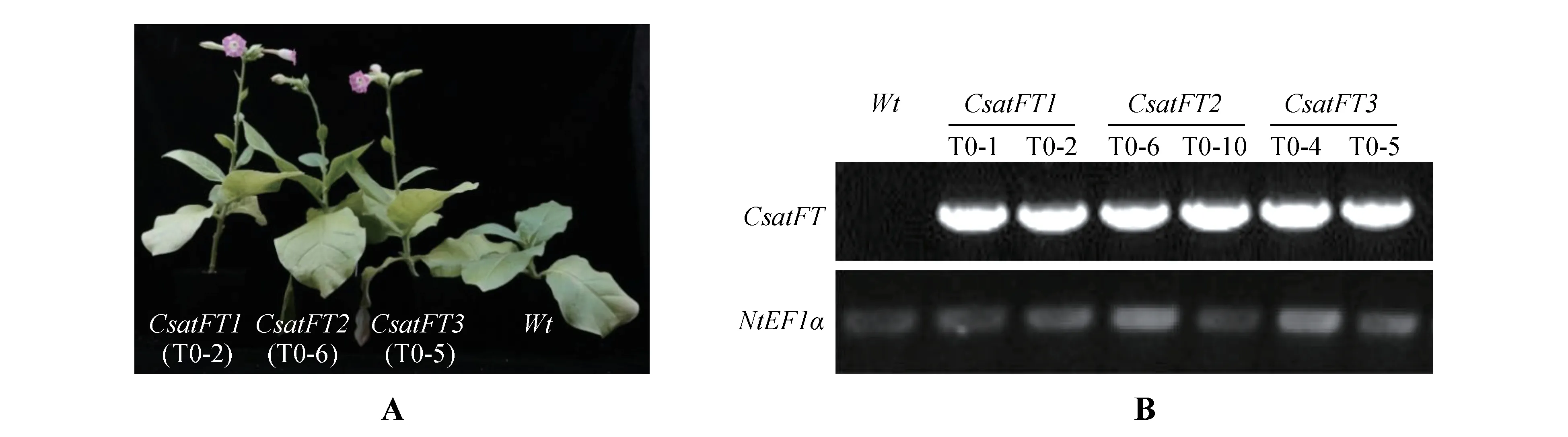
图3 西红花3个FT基因的转基因烟草植株表型A.从左到右分别是35S::CsatFT1-3,野生型,生长60 d后;B.转基因烟草植株的RT-PCR检测Fig.3 Phenotypic analysis of transgenic tobacco plants harboring three FT homologs of saffronA.FT homologs of saffron from left to right,35S::CsatFT1-3,wild-type,respectively,after growth for 60 d;B.RT-PCR analysis to confirm the trans‐genic lines

表4 西红花FT基因的T0代转基因烟草植株表型统计Table 4 Flowering phenotypes of representative T0 transgenic tobacco lines harboring FT homologs of saffron
2.4 异源转化CsatFT基因拟南芥的表型分析
为了进一步验证CsatFT1-3 的功能,我们又进行了拟南芥转化和功能互补试验。如图4A 所示,异源转化拟南芥Col的表型观测表明,在相同条件生长30 d 后,、和转基因拟南芥均已抽薹开花,如图4C~D 所示,转基因拟南芥株系#2 抽薹时叶片数量为(11.10±0.74)个,从播种到开花所需的时间为(30.70±1.16)d,均显著少于野生型Col 植株(14.30±0.82)和(34.20±1.14)d。如图4E 所示,异源转化拟南芥-(Ler 生态型)的表型观测表明,、和转化-突变体植株的开花期均早于-突变体,转基因株系的叶片数量和从播种到开花时间都显著低于-突变体,但显著高于Ler 生态型拟南芥(见图4:G~H)。综上,转基因拟南芥和功能互补实验的结果,与超量表达烟草的表型一致,即均表现出早花的表型,进一步说明西红花的3个基因都具有促进开花的功能。

图4 西红花CsatFT异源转化拟南芥Col和ft-1突变体表型A.从左到右分别是30 d大的35S::CsatFT1,35S::CsatFT2,35S::CsatFT3,Col拟南芥植株;B.转基因拟南芥植株的RT-PCR检测;C.长日照条件下,拟南芥抽苔时的叶片数;D.长日照条件下,拟南芥从播种到抽苔的天数;E.西红花FT 异源转化拟南芥ft-1 突变体植株表型;F.转基因拟南芥植株的RT-PCR 检测;G.长日照条件下,拟南芥抽苔时的叶片数;H.长日照条件下,拟南芥从播种到抽苔的天数;CL.茎生叶;RL.莲座叶;相同的小写字母表示在P=0.05没有显著差异Fig.4 Phenotypic analysis of ectopically expressing CsatFT homologs of saffron in the Col and ft-1 mutantsA. 30-day-old 35S::CsatFT1,35S::CsatFT2,35S::CsatFT3,Col Arabidopsis;B. RT-PCR analysis to conform the transgenic lines;C. Leaf num‐ber of wild-type Col and transgenic Arabidopsis plants under LD(16 h-light/8 h-dark)conditions;D.Time from seed to bolting of wild-type Col and transgenic Arabidopsis plants under LD(16 h-light/8 h-dark)conditions;E. Phenotype of ectopically expressing FT homologs of saffron in ft-1 mu‐tant;F. RT-PCR analysis to conform the transgenic lines;G. Leaf number of wild-type Ler,ft-1 and transgenic Arabidopsis plants under LD(16 hlight/8 h-dark)conditions;H.Time from seed to bolting of wild-type Ler,ft-1 and transgenic Arabidopsis plants under LD(16 h-light/8 h-dark)con‐ditions;CL.Cauline leaves;RL.Rosette leaves;The common letters within the same figures are not significantly different at P=0.05
3 讨论
对高等植物来说,开花对生殖成功和繁衍至关重要,及其同源基因位于多条开花途径的交汇点上,在植物开花过程中发挥着重要作用而受到研究者的关注,已经从大量物种中克隆获得了同源基因,并且通过异源或本物种转基因等分子遗传手段对其调控开花时间的功能进行了验证,大量结果表明过量表达可以缩短童期或营养生长时间,促进并加速成花。同时,随着研究的深入,发现也存在其它的潜在功能,例如,在长光周期条件下,控制侧枝的发育;响应蓝光的情况下,可以通过激活保卫细胞中的H-ATP 合酶,调控气孔张开;土豆同源基因作为移动的“块茎形成素”,诱导对光周期敏感的块茎形成过程;洋葱同源基因和在鳞茎形成中发挥功能。同时,也逐渐进化出抑制开花的功能,甜菜()中的2个基因参与了对冬天长时间低温和春化相关的开花响应,BvFT2 促进开花,而BvFT1 抑制开花,并且BvFT1 的下调表达对甜菜对春化作用的响应至关重要。在烟草中也发现了4个旁系同源基因,NtFT1-3 抑制开花,NtFT4 促进开花。同样地,在龙眼()、杨树()等物种中都报道了旁系同源基因自然分化出拮抗功能的例子,同时功能的改变是由于关键氨基酸位点的变异导致的,并且这些位点在不同物种之间是保守的。
本研究中涉及的西红花3 个同源基因,、和,均具有4个外显子和3 个内含子,将其编码的氨基酸序列与拟南芥At‐FT 进行比对,发现彼此之间都有较高的序列相似性,说明不同物种间基因序列是非常保守的。与同家族基因,两者高度同源却功能相反,FT 促进开花,TFL1 抑制开花。研究表明,拟南芥AtFT 和AtTFL1 单个氨基酸的改变,或者一段氨基酸的改变,能使两者的功能互换。序列比对发现CsatFT1、CsatFT2、CsatFT3 均具有行使FT 早花功能关键的氨基酸位点Y85、Q140 和第四个外显子中关键的B 段和C 段,同时,系统进化分析显示CsatFT1、CsatFT2、CsatFT3分别和同为单子叶植物的水仙NtFT、麝香百合LlFT和洋葱AcFT1表现出较近的遗传距离,这3 个同源基因都被报道具有促进开花的功能,说明本研究克隆的为同源基因且具有促进开花的功能。
普遍认为,基因的表达模式与其功能密切相关。拟南芥主要在叶片筛管中表达,经韧皮部运输至SAM,其在韧皮部和茎中过量表达,可促进提早开花;苹果主要在成年期的花果枝的顶芽中表达,在幼年期的组织中几乎无表达,而主要在花芽、花器官、花梗、幼果等生殖器官中表达,和异源转化拟南芥均能促进提早开花,过表达能使转基因苹果植株缩短营养生长期,提早开花。qRT-PCR 的结果表明,小球茎膨大阶段前期,、、在叶片中表达水平最高,侧根中次之,子球茎、主根中极低(几乎检测不到);小球茎膨大阶段后期,、、都在子球茎中表达水平高,在营养生长状态的顶芽中几乎检测不到。室内储藏开花阶段,、、在柱头中表达水平最高,叶中次之,花瓣和花药中较低(几乎检测不到)。这与Tsaftar‐is 等通过RT-PCR 半定量检测方法,得到的西红花3 个基因表达水平的结果部分一致,文中结果表明,和在10 月份和3 月份的叶片和球茎中有表达,但是没有检测到的表达,只在地下的未成熟的花中有表达,叶片和球茎中均没有。而我们的试验结果在1 月份的叶片和球茎中也检测到了的表达,虽然其相对表达量较和的低。可能是由于采样时间和国内外栽培模式存在差异,且检测方法不同,后续需要进行进一步验证。
超量表达、、的转基因烟草植株,均表现出提早开花的表型,和野生型烟草相比,营养生长阶段缩短。同时,拟南芥转基因和突变体互补试验,进一步证明了、、在促进成花转变中的早花功能。因此,说明3 个西红花同源基因在花期控制方面的功能和拟南芥等模式植物中报道的功能是保守的,均具有促进开花的功能。
西红花为同源三倍体,其栽培历史超过3 000年,一直进行无性繁殖。从进化角度来看,基因是在自然进化过程中进化出抑制开花的功能,同时在很多物种中,FT抑制子和FT诱导子在功能上具有拮抗作用。本研究中涉及的3个西红花同源基因的基因结构一样,序列相似性很高,行使关键功能的氨基酸位点和片段亦没有出现氨基酸的差异,异源转化的功能验证也呈现出相同的促进开花的功能,间接说明其功能和进化较保守。西红花3个同源基因在西红花球茎膨大过程中的子球茎中都有表达,而在储藏期间的球茎中几乎没有表达,因此,西红花3个同源基因是否和土豆、洋葱中同源基因一样,可能在球茎膨大过程中具有功能,也值得进一步的研究。
