微尺度电阻抗成像在肿瘤细胞检测中的应用进展
2022-03-01姚佳烽
姚佳烽
(南京航空航天大学机电学院,江苏 南京 210016)
目前,电阻抗成像(EIT)方法已经逐步被应用于宏观的生物组织检测,面向微尺度生物检测的EIT方法是发展趋势。EIT技术是20世纪80年代出现的一种安全、非侵入式、成本低廉的功能成像技术,是一种可视化的检测技术,其利用一系列分布在被测物体表面的电极,进行检测,确定目标内部各个位置的导电率或电容率分布,已被广泛且成熟地应用于工业检测与医疗成像[1]。EIT技术的原理是通过向待测场域施加一定频率的安全激励电流,并测量边界电压信号来计算出待测场域内部的电导率分布情况。相较于计算机断层扫描(CT)、磁共振成像(MRI)等断层成像技术,EIT功能成像的特点可以较好地应用在生物组织与细胞的检测中[2]。
1 EIT方法
在微观尺度下,当电场作用于流体进行阻抗检测时,溶液中的离子在电场的作用下迁移到电极,在电极表面形成双电层,双电层引起的接触阻抗屏蔽了电场对流体的作用,造成极大的噪声,降低了系统对流体阻抗检测的敏感度[3]。该噪声与信号之间的干扰导致设备开发难度较大,虽然目前研究较少,但EIT仍是非常有潜力的一种成像技术。2010年TAO等[4]人开发了直径为6 mm的16电极EIT传感器,实现了真菌的生长过程监测;2018年LEMMENS等[5]人开发了圆形8电极EIT传感器,并利用阻抗分析仪搭建了电阻抗成像系统,对细胞的培养过程进行了监控;2019年YANG等[6]人开发了用于三维细胞培养过程进行定量成像与检测的微型EIT系统,系统基于PCB板开发,传感器直径为15 mm,有16个激励电极与1个接地电极,见图1-A;将其用于MCF7乳腺肿瘤细胞检测并进行了实验验证,可以实现直径为0.5 mm肿瘤细胞团的检测,见图1-B。从现有微尺度EIT研究结果来看,还存在两个问题:第一,成像精度还不够高,不能满足肿瘤细胞检测的需求;第二,该研究过程还停留在静止状态下的检测,未涉及到流动状态下的细胞检测。
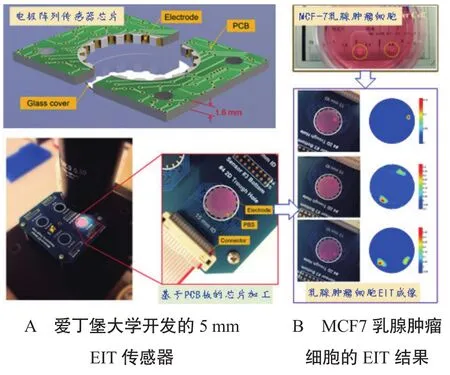
图1 面向微小生物组织检测的EIT方法
姚佳烽等[7-8]已经开发出了新型多电极阵列三维结构的微流控芯片,见图2,其突破了传统微流路尺寸的设计技术限制,将多电极阵列于流路周围,扩大了微流路的管道直径,与传统流式细胞仪相比,检测效率提高了10倍以上,现有研究报道尚未发现类似结构。该芯片可以实现血液循环系统中肿瘤细胞的高效率检测,并为肿瘤细胞高速分离提供了关键的细胞定位信息。

图2 多电极阵列微流路
图3为流量Q=10 mL/h时利用电阻抗扫描成像(EIS)法测量的微流道内不同截面细胞浓度曲线以及利用EIT技术重构的微流道内3个截面细胞的沉淀分布图,下部表示细胞,上部表示水,图中显示分布在微流道底部的红色区域逐渐减少[9]。在以前的研究[7]中已经分析了细胞沉降的速度,通过图3可以看到微流道截面z1、z3及z5中细胞沉降的重建图像,该结果与之前研究中通过电化学阻抗谱(EIS)法检测的细胞浓度分布相一致。细胞浓度从Φ= 17.5 vol%缓慢地降低到Φ= 4.9 vol%,可以看出由于沉降导致从第1个截面到第5个截面细胞积聚逐渐变化。微尺度EIT方法和EIS方法关于细胞沉降的一致性说明了开发微尺度EIT系统可以在多层电极微流道中成功地实现细胞沉降可视化。
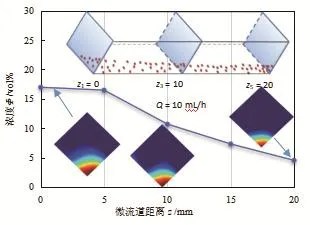
图3 沿着微流道中3个横截面的细胞沉降可视化的应用
2 生物电阻抗谱扫描(BIS)方法
BIS方法是一种利用生物组织的电阻抗特性提取相应病理信息的检测技术[10]。GABRIEL等[11]研究了人体组织及器官在10 ~ 20 GHz频率范围内的介电特性,根据测量数据建立阻抗谱分析模型和数据库网站,成为BIS研究的重要参考标准。LU等[12]人通过对离体组织在不同频率下电特性的研究,发现组织电阻抗实部和虚部具有不同且丰富的生理病理信息,这一发现为BIS进一步研究奠定了基础。
随着微机电系统(MEMS)技术的发展,借助于微流控芯片,BIS也逐步被应用于细胞检测[13]。生物细胞作为非均匀结构(细胞外、细胞膜和细胞质),其电学特性具有异质性,当交流电场作用于细胞时,细胞的介电响应出现α色散、β色散和γ色散的弛豫现象,可以利用该弛豫现象对细胞的不同结构特征进行检测识别[14]。BIS技术通过交流电阻抗技术检测生物细胞的电导率和介电常数,并引入电介质物理模型的数值计算,获得细胞外液、细胞膜和细胞质的电学信息,由此来区分不同种类的细胞。该检测包括具有流动聚焦区、测量电极和分类电极的阻抗式细胞仪,用于研究单个肿瘤细胞在三维基质中迁移的集成微流控装置的微电极传感器;集成并行BIS的微流控芯片,其可监测多个肿瘤球体的大小,在电极上滚动的微组织产生一个峰值,其厚度与球体的大小成正比,该BIS传感器允许细胞单列通过,限制了细胞的检测效率,见图4。
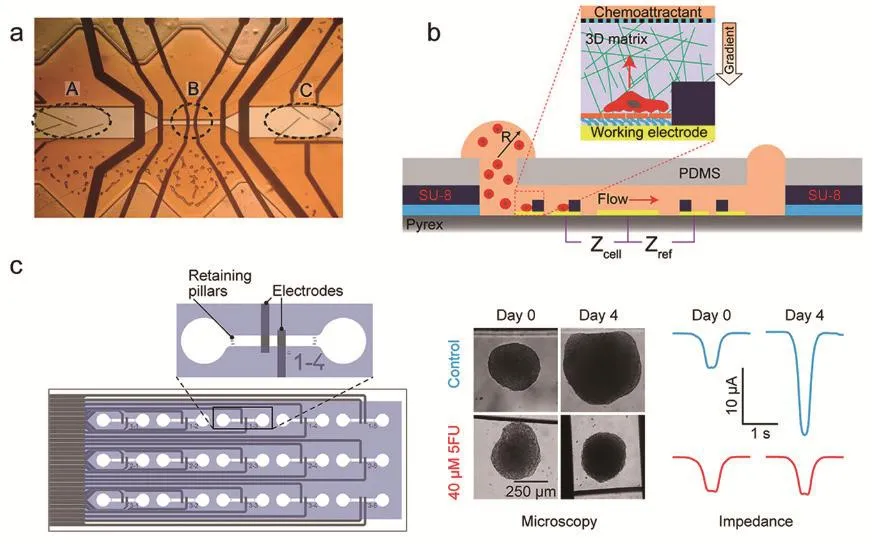
图4 BIS方法区分不同种类的生物细胞
由于BIS方法具有操作简单和信息丰富等特点,国内外已经有大量学者对该方法进行了研究。2008年PATEL等[15]研究采用BIS方法研究了细胞的死亡过程,由于细胞的死亡往往伴随着细胞膜完整性的丧失,细胞膜的介电参数值也会发生显著变化。2018年MODENA等[16]采用集成微流控装置的微电极传感器采集了生物细胞的阻抗谱,该传感器允许细胞单列通过,由此研究了单个肿瘤细胞在三维基质中的迁移规律。2018年LI等[17]采用BIS方法研究了体外循环系统中红细胞的凝聚过程,该方法可以实现对红细胞的浓度于凝聚状态的监控。
LIU等[18]已经将BIS技术应用于细胞 - 溶液两相流检测中,建立了细胞 - 溶液两相流的等效电路模型,并通过BIS方法实现了细胞生死状态的识别,见图5,该成果发表在了IEEE Transactions on Biomedical Circuits and Systems等期刊上。目前在基于以往理论与实验基础上,进一步采用机器学习方法来识别不同种类细胞。
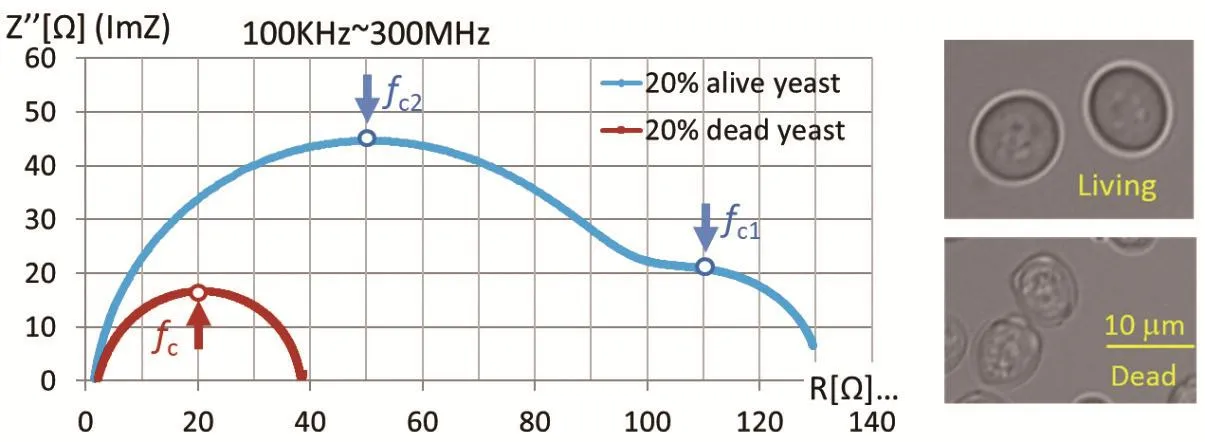
图5 BIS方法识别细胞生死状态
WANG等[19]在毫米级别电阻抗成像方面取得了一定的研究结果,实验采用一个装有水溶液的圆形水槽作为二维成像区域,水槽直径为5 mm,且圆形水槽周围均匀分布8个电极,鱼卵细胞直径为1 mm。最终实现了静止状态下一个截面电极鱼卵的电阻抗成像检测,为细胞流动过程的多截面检测提供了技术积累。由于鱼卵细胞比较小,不便于人眼识别,因此使用光学显微镜进行观察鱼卵具体位置,用来验证电阻抗成像检测的实验结果,见图6,该实验结果为多电极阵列肿瘤细胞的微尺度电阻抗成像提供了实践支撑。

图6 静止状态下一个截面电极鱼卵的电阻抗成像检测
3 BIS与EIT互为补偿方式
然而,在微尺度下,BIS得到的数据在实现细胞种类、数量、大小识别的时候,受到细胞位置分布的影响。当细胞数量和大小产生的阻抗值叠加时,也不容易区分细胞的个数与体积信息,这就需要借助于EIT成像方法来实现细胞信息的进一步识别。
YAO等[20]认为,BIS技术能够定量判断细胞的类型、大小和数量(一维信息);然而在高通量细胞群的检测中电气参数表征能力不完备,细胞群位置容易影响测量精度;EIT技术能够实现细胞位置的二维图像重构,但是检测信号受到微尺度下双电层等噪声影响,检测精度很难提高。因此,姚佳烽等提出了一种肿瘤细胞精准电阻抗检测方法。采用EIT位置检测与BIS定量检测互为补偿的方法,并借助细胞识别的人工智能算法,着力构建出一套微尺度下肿瘤细胞精准电阻抗检测的新方法。
通过16电极阵列微流控芯片采集数据,采用BIS与EIT互为补偿的方式,获取精准的细胞电阻抗信息,其流程包括:首先,根据EIT初次获取的细胞群位置,选择离细胞群最近的电极作为BIS的激励 - 测量电极,消除细胞群位置对测量精度的影响,实现BIS的精准检测;同时,以EIT初次获取的细胞群位置作为最佳成像区域,选取EIT的最优激励 - 测量模式,提高EIT的成像质量;其次,提取EIT图像特征作为BIS电气特征的补充,建立完备的特征组,输入机器学习模型,准确判断细胞群种类、大小及个数;最后,根据得出的细胞群种类、大小及个数再次修正EIT图像,实现肿瘤细胞精准成像,见图7。
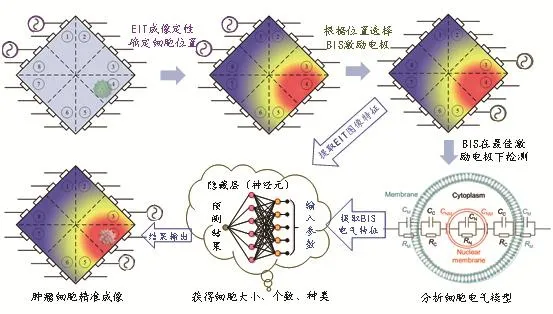
图7 EIT与BIS数据互为补偿的精准电阻抗检测过程
BIS与EIT数据融合的关键在于,电阻抗初次成像确定细胞分布位置后,为阻抗谱测量的激励 - 测量电极选择提供决策,电阻抗二次成像的图像特征和阻抗谱辨识出的电气特征一起形成完备的特征组,用于综合判断细胞群种类、大小及个数,而判断出的细胞种类提供了细胞图像边缘的平滑度信息,大小及个数则用于结合成像区域的质心位置修正细胞影像的尺寸,精确修正EIT的二次成像,最终实现肿瘤细胞的精准成像。
4 小结与展望
电阻抗成像在微尺度检测方面是未来的一个研究热点,并且已经表现出了一定的优势。其中EIT方法可以实现对0.5 mm以上粒子的检测,同时也可以实现对细胞群的检测,而在微尺度检测方面还存在精度低的问题;与此同时,BIS作为一维的电阻抗检测方法,在一定程度上能够反映出细胞的电学特性规律,可以用来实现微米级细胞的检测。将BIS与EIT互为补偿,获取精准的细胞电阻抗信息,最终实现肿瘤细胞的精准成像。针对目前的新冠疫情,纳米尺度的病毒检测很有可能成为电阻抗检测方法的下一个应用热点。
