镰刀菌及其伏马毒素的危害和防控
2022-03-01郭志青张霞刁立功许曼琳于静李莹何康宋新颖王维婷迟玉成
郭志青 张霞 刁立功 许曼琳 于静 李莹 何康 宋新颖 王维婷 迟玉成


摘要:真菌毒素(mycotoxin)是真菌产生的有毒次级代谢产物,其中伏马毒素对粮食的污染严重威胁人和动物健康,长期过量暴露于含有毒素的食品或饲料会引起人类和动物的中毒或各种疾病,严重者甚至死亡。本文综述了伏马毒素的结构、种类、毒性机理、生物合成基因序列群和基因调控机制及其控制和预防方法,为镰刀菌的生物防治和有效控制伏馬毒素污染提供理论基础,对其它真菌毒素的抑制和防治具有参考意义。
关键词:真菌毒素;伏马毒素;镰刀菌
中图分类号:S432.4+4 文献标识号:A 文章编号:1001-4942(2022)01-0157-08
近年来,国家在推动农业现代化过程中对粮食安全给予越来越多的关注。植物病原真菌一方面可引起粮食变质、腐烂造成巨大的经济损失,另一方面产生的毒素威胁动物和人类健康。真菌毒素是产毒真菌在生长过程中产生的次级代谢产物,在食用和饲用农产品加工原料中普遍存在,并已成为威胁粮食质量与安全的首要因素。根据联合国粮农组织(FAO)的统计,全球每年的粮食总产量约为25亿吨,有近25%的农作产品被霉菌污染,中国每年约3100万吨的粮食受到污染[1,2]。
本文以近几年在真菌毒素领域成为研究热点的伏马毒素为例,系统总结了其种类、毒性机理、生物合成基因序列群和基因调控机制及其预防控制技术等,以期为镰刀菌的生物防治和有效控制伏马毒素污染提供理论基础,为其它真菌及其毒素的防控提供参考,对保障粮食安全具有重要意义。
1 镰刀菌及其伏马毒素
在中国,真菌毒素对粮食作物侵染频率较高,污染较为严重的5类产毒霉菌分别为曲霉属(Aspergillusspp.)、镰刀菌属(Fusarium spp.)、青霉属(Penicilliumspp.)、链格孢属(Alternariaspp.)和麦角菌属(Clavicepsspp.)。其中,镰刀菌种类繁多,约1500种,常见的侵染作物的病原菌有70余种,多具土传性。由于不同小种的基因多样性和广泛的寄主特异性,能够引起100多种作物的枯萎病、梢腐病和根腐病等,是最具经济破坏性的真菌致病菌群之一[3]。镰刀菌作为半活体营养类型真菌,以活体营养真菌的形式在寄主上进行定殖;在死体营养阶段,通过产生毒素和纤维素分解酶导致寄主死亡以便其更好地吸收寄主营养[4]。
镰刀菌孢子侵染寄主植物后,引起寄主产生一系列反应。信号转导激活超敏(寄主防御)反应产生的抗性已被证明是基因对基因系统的结果,在该系统中,病原菌无毒(avr)基因与寄主植物中的抗性(R)基因相对应。这种通过超敏反应获得抗性的基因对基因系统发生在由专性细胞内病原体(如病毒和软体动物)引起的疾病中,以及由专性和兼性病原体(如细菌、真菌和线虫)引起的疾病中。无论是哪种病原体,通过超敏反应产生的抗性响应是植物识别特定信号分子(激发子)的结果,激发子由病原体的无毒基因产生,并由植物中R基因编码的特定受体分子识别。这样的识别引起宿主基因级联的激活,导致氧爆发、细胞膜破坏、酚类和其他有毒化合物的释放、高致病性-敏感反应、程序性细胞死亡、抑制病原体生长,从而产生抗性。还可导致许多其他防御相关基因的激活,从而产生其他类型的抗性,包括水平抗性和系统获得性抗性[5](图1)。镰刀菌侵染寄主植物后除了引起寄主植物细胞的一系列免疫反应,还能产生3类主要真菌毒素,分别为单端孢霉烯族毒素类(trichothecenes)、玉米赤霉烯酮类(zearalenones)和伏马毒素(fumonisins)。
伏马毒素主要由轮枝镰刀菌(Fusariumverticillioides)、层出镰刀菌(F.proliferatum)、尖孢镰刀菌(F.oxysporum)等丝状植物病原真菌产生[6]。其中,F.verticillioides是非宿主特异性、非专性的病原真菌,可侵染玉米、水稻、小麦、高粱等多种粮食作物,引起玉米穗腐病、玉米苗枯病、小麦根腐病、水稻幼苗的苗枯、根腐等[7]。F.proliferatum具有更广泛的植物寄主和繁殖能力,除侵染玉米、水稻、小麦、高粱等主要粮食作物,还侵染芦笋、洋葱、大蒜等蔬菜及香蕉、无花果、李子等水果[8,9]。F.oxysporum 具有高度的寄主专化性[10],其侵染引起的植物枯萎病是一种世界性的土传真菌病害,病菌从根部危害植物,引起维管束病害,造成植株枯死,在植株的全生育期均可发生,对作物生产造成了巨大的经济损失。
2 伏马毒素种类、毒性及合成调控基因
2.1 伏马毒素的结构、种类和毒性
伏马毒素是一类由不同多羟醇和丙三羧酸组成的结构类似的双酯化合物,分子极性较强,能溶于水和其他极性溶剂,包括FA1、FA2、FA3、FB1、FB2、FB3、FB4、FP1、FP2、FP3(表1)。B族具有较强毒性,其中,伏马毒素B1(FB1)是产量最多且毒性最大的毒素。
伏马毒素常污染玉米和玉米制品,人摄食被伏马毒素污染的玉米食品会引起疾病[11,12]。在巴西食用伏马毒素污染玉米的人群得食道癌的几率增大[13]。此外,动物取食被伏马毒素污染的玉米饲料也会引起疾病,在美国、阿根廷、巴西、澳大利亚、日本、中国、德国和法国等许多国家均有报道[14]。1989年,美国爱荷华州南部1100余头猪因取食霉变玉米而死于肺水肿和胸腔积水,引起人们的广泛关注。后期大量试验证明,霉变玉米中主要毒素成分是FB1[15,16];除肺水肿,伏马毒素还可造成猪生殖系统的紊乱,如早产、流产、死胎和发情周期异常等[14]。在巴西,取食伏马毒素污染的玉米中毒马匹死亡前症状为视力模糊甚至失明,走路不稳,转圈,用头撞墙壁、饲槽或者栓桩,死亡后剖检发现大脑白质有大小不一的灰黄色液化,被确定为马脑白质软化症[17]。2015年11月,新疆奇台县半截沟镇石河子乡牧场5匹马因取食发霉玉米中毒死亡,临床症状和病理解剖与马脑白质软化症一致[18]。
伏马毒素B1对老鼠具有肝脏毒性和致癌的风险[19];引起雏鸡的体重下降和多个器官(肾脏、肝脏和心脏)的损伤[20]。动物细胞的离体试验表明伏马毒素B1抑制细胞的繁殖并导致细胞毒性[21-23]。此外,伏马毒素B1被证明能够致癌、致畸形,有研究证实其与食道癌的发生成正相关[24,25],还可导致儿童神经管缺陷[26]。
2.2 伏马毒素的毒性机理
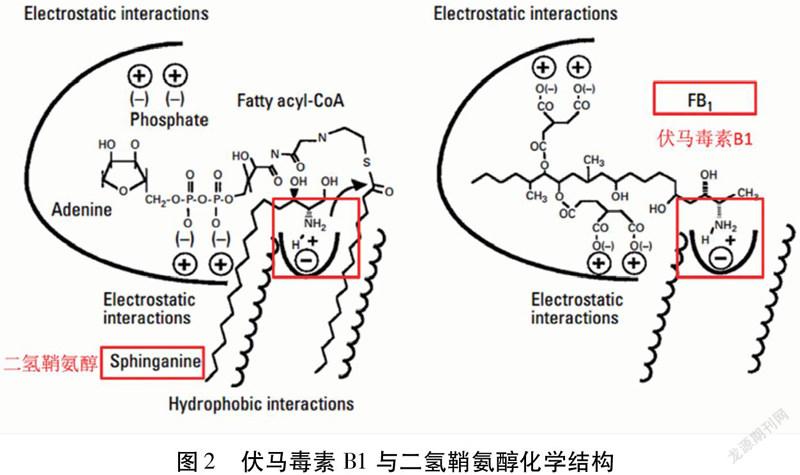
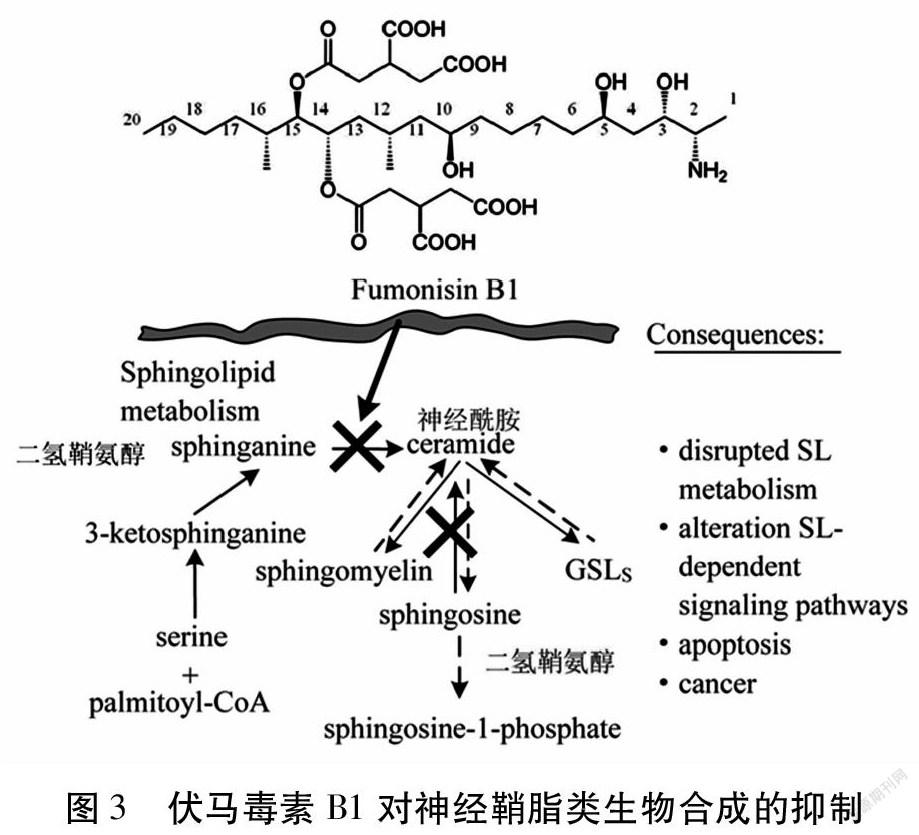
Wang等[27]发现伏马毒素B1抑制神经鞘脂类物质的生物合成,鞘脂类物质作为细胞膜的重要构成成分和细胞功能调节剂,在细胞的生长和分化中起重要作用。由于伏马毒素的化学结构与人或动物机体内的二氢鞘氨醇有高度相似性(图2),因此在神经鞘脂类的代谢过程中,伏马毒素B1竞争性地结合神经鞘氨醇N-2酰基转移酶,从而抑制二氢鞘氨醇的生物合成,阻碍鞘脂类代谢[22,27,28](图3)。神经鞘脂类生物合成的破坏给人类以及动物的健康造成严重危害。
2.3 伏马毒素生物合成基因序列群及其表达
目前为止,在F.verticillioides基因组中共鉴定出11个FUM基因族类基因。其中,所有能产生伏马毒素B族的F.verticillioides中都含有其生物合成所必需的多酮肽合成酶基因fum5[29];启动伏马毒素的生物合成基因fum1[29];与伏马毒素生物合成相关的基因fum2、fum3、fum4[30];生物合成協同调节基因簇fum6、fum7、fum8、fum9[31,32]。然而,这些基因如何调控伏马毒素的合成,并与FUM基因家族之间具有怎样的调控关系和途径需进一步研究。此外,在FUM 基因家族以外,其他与伏马毒素产量相关的基因也正在日益发掘,如AREA、CPP1、FCC1、FST1、FvVE1、GBP1、GBB1等多个基因均被报道在伏马毒素合成和产量上具有重要调控作用[33-40]。
2.4 伏马毒素合成的基因调控
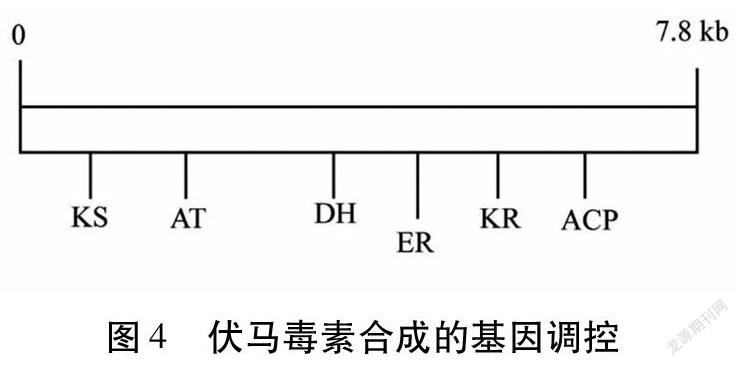
生化分析表明,伏马毒素是镰刀菌属产生的有毒次级代谢产物,其来源于脂肪酸还是多酮肽尚不清楚,因为该两类化合物皆来源于乙酸脂。通过对参与伏马毒素生物合成的多酮肽合成酶(PKS)基因进行PCR扩增[29],发现一个具有7.8kb编码区的基因(fum5)的转录产物(Fum5p)与细菌和真菌Ⅰ型多酮肽合成酶非常相似。携带fum5的黏粒克隆转化到F.verticillioides加强了这些菌株产生伏马毒素的能力,并且使不产生伏马毒素的突变株恢复了野生型的能力。反之,阻断fum5可降低99%伏马毒素的产生。有研究表明,Fum5p可能催化伏马毒素C-3到C-20骨架的合成[41]。尽管Fum5p与脂肪酸合成酶相似,但其在一条链单一转录产物上具有6个公认的功能区(图4):β-酮酰基合成酶(ketoacylsynthase,KS)、酰基转移酶(acyltransferase,AT)、脱水酶(dehydratase,DH)、烯酰还原酶(enoylreductase,ER)、β-酮酰基还原酶(ketoacylreductase,KR)和酰基载体蛋白(acylcarrierprotein,ACP),而在真菌脂肪酸链上这6个功能区及一个丙二酰基/棕榈酰基转移酶区(malonyl/palmityltransferase,M/PT)分布于脂肪酸合成酶1(fattyacidsynthase1,FAS1)和脂肪酸合成酶2(fattyacidsynthase2,FAS2)两条多肽链上。由此推断Fum5p是多酮肽合成酶,而不是脂肪酸合成酶,相应的,fum5为多酮肽合成酶基因[32,42]。
3 预防和控制镰刀菌及其毒素积累技术
产生伏马毒素的镰刀菌可引起土传病害,多年来科学家们致力于探求更安全、有效的防治土传病害的方法。本文从生物防治、基因工程育种、选用优质种质资源、控制收获后粮食发霉腐烂等方面探讨从种质到收获后降低镰刀菌和伏马毒素污染的预防控制措施。
3.1 生物防治
枯草芽孢杆菌在植物中与F.verticillioides具有相同的生态位,能有效抑制真菌的生长。枯草芽孢杆菌被美国食品和药物管理局认为是安全的,并且易于培养和操作。研究发现,植物内寄生枯草芽孢杆菌RRC101可以在F.verticillioides的生长期中减少伏马毒素积累[43]。其表面活性素和丰原素型脂肽(surfactinandfengycintypelipopeptides)具有抗F.verticillioide的真菌活性,这种拮抗作用表现为对丝状菌丝生长的抑制,显微镜下显示有明显的菌丝萎缩、空泡化和裂解[44]。
焦铸锦[45]从玉米等寄主植物中分离、筛选出了内生菌R-4(KP998181),经鉴定为Bacillusthuringiens;植物体内抑制试验结果显示,接种层出镰刀菌(F.proliferatum)前喷洒内生菌R-4的抗侵染效果优于接菌后,表明菌株R-4有较好的开发应用前景,为开展层出镰刀菌的生物防治奠定了基础。
Guo等[46]从蚯蚓中分离纯化出一株具有高效抑制和降解伏马毒素的菌株粘质沙雷氏菌(Serratiamarcescens)。通过溶血活性检验,证明该菌株对人和动物不会造成健康威胁;可高效抑制F.verticillioides、F.proliferatum孢子萌发、菌丝生长及伏马毒素的产生;0.5%发酵液对层出镰刀菌产生伏马毒素的抑制率为99.86%;PCR扩增结果显示,此菌株具有几丁质酶基因(chiA、chiB、chiD),能够合成几丁质酶,具有降解镰刀菌及其他真菌细胞壁的活性;基因组测序发现粘质沙雷氏菌具有的羧酸酯酶(carboxyleasterase)和转氨酶(aminotransferase)对伏马毒素的降解率达98.50%。该菌株既能高效抑制伏马毒素的产生,又能降解伏马毒素,具有很高的研究和应用价值。
3.2 基因工程育种
魏铁松等[47]报道,棉铃虫对玉米果穗的危害能显著加重镰刀菌引起的玉米穗腐病的发病程度;玉米螟对玉米秸秆和谷穗组织造成的物理性伤口反过来促进了F.verticillioides孢子的萌发,导致谷穗的进一步损伤和谷粒腐烂,最终引起伏马毒素含量水平升高。在巴西,经苏云金芽孢杆菌(Bacillusthuringiensis,Bt)cry基因遗传修饰的玉米杂交种,其F.verticillioides侵染率和伏马毒素含量降低[48]。在南非,由于苏云金芽孢杆菌转基因作物的种植,使用化学杀虫剂数量有所减少[49]。
3.3 选用优质种质资源
层出镰刀菌可以系统侵染小麦。Guo等[8]研究表明,小麦种子若被层出镰刀菌侵染,将侵染后的小麦种子种植到灭菌土中并在无层出镰刀菌污染的温室中生长,在成熟的小麦粒中检测到层出镰刀菌DNA和伏马毒素。焦铸锦[45]根据层出镰刀菌菌丝在维管束中筛管和导管的分布,认为存在系统侵染的可能性。以上研究说明种子在收获前存在被病原菌侵染的可能性,可在播种前加强种子检疫,严格杜绝带菌种子在生产上推广使用,确保从种源上控制镰刀菌的传播蔓延。
3.4 控制收获后粮食发霉腐烂
防止谷物、豆类、饲料的采后霉变和腐败需要一定的预防措施和控制收获前、收获期间以及储藏期间的条件。如果作物在收获时是健康和高品质的,可采取以下方法避免随后的感染和贮藏中的腐败。(1)水分含量应保持在普通贮藏真菌生长所需水分最低限度以下。一些顽强的曲霉会在含水量13.0% ~13.2%的淀粉谷类种子和含水量约为11.5% ~11.8%的大豆中生长;一般最低含水量为14%或更多才会导致腐败。(2)贮藏谷物的温度尽量保持在较低水平,大多数贮藏真菌在20~35℃生长最快,12~15℃生长非常缓慢,5~8℃几乎停止生长。此外,低温还减缓了谷物的呼吸作用,阻止了谷物水分的增加。(3)通過使用熏蒸剂将储存产品受到昆虫和螨虫的侵害控制在最低程度。(4)贮存的粮食不得未熟或过老;而应清洁,有良好的发芽能力,无机械损坏和种子破碎,从而抵抗储存真菌的感染[5]。
以上措施在预防和控制真菌毒素的积累中均发挥着重要作用,若粮食不可避免被镰刀菌及伏马毒素污染,霉变粮食的处理措施主要包括封存、用作饲料或燃料,对霉变粮食单独清理、集中堆放、统一处理,严禁将发霉的粮食用于食品加工。具体措施:(1)受损较轻并符合国家饲料卫生标准的,降级用于饲料生产,如此可以降低经济损失且不会对人畜健康造成威胁;(2)真菌毒素污染的粮食一般用来发酵酒精,伏马毒素虽然不会在发酵过程中降解,但在蒸馏出的酒精中没有残留,主要留在酒糟里[1,50]。
4 研究展望
FB1在人和动物体内的有毒中间代谢产物不容忽视。在动物体内,FB1的代谢主要发生在肠道和肝脏中,代谢途径为水解作用和酰化作用。FB1可在肠道中发生完全水解,产物为水解型FB1(hydrolyzedFB1,HFB1),HFB1在细胞中的吸收速率更高,而HFB1的酰化产物N-酰基-HFB1具有比FB1更强的细胞毒性。此外,FB1的酰化产物N-酰基-FB1(N-acylationofFB1,N-acyl-FB1)的细胞毒性也比FB1大。因此,只有将伏马毒素中的毒性基团(丙三羧酸基团和氨基)完全降解成无毒的代谢产物才能从真正意义上消除毒素代谢过程中对人和动物的危害,这将是未来伏马毒素防控的研究方向之一[51]。
在自然环境中,伏马毒素还可能与其它霉菌毒素(如单端孢霉烯族毒素、玉米赤霉烯酮、黄曲霉毒素、赭曲霉毒素)同时污染食物和动物饲料,其毒性和危害有相加或协同作用,严重威胁人类健康和动物的生长繁殖。因此,建立同时检测样品中多种真菌毒素和原型及其有毒中间代谢产物的液质联用检测方法对食品进行全面监控是急需解决的问题。
针对上述情况,相关部门需加紧对伏马毒素和其他毒素及其有毒中间代谢产物风险监测和风险评估的步伐,在保障食品、饲料安全和充分考虑食品、饲料企业、初级农产品生产者等利益的情况下,建立科学的、严格的限量标准或制定微生物安全相关指标,这对我国有效控制粮食和饲料中伏马毒素的危害、减少养殖中带来的损失、提升消费者健康保护的能力和人民的健康生活具有积极而深远的影响。
