花生MITE反应体系优化及其遗传多样性分析
2022-03-01徐彪王佰众李玉发杨翔宇王伟牛海龙李伟堂刘红欣吴松权何中国
徐彪 王佰众 李玉发 杨翔宇 王伟 牛海龙 李伟堂 刘红欣 吴松权 何中国






摘要:为了建立适宜不同来源花生种质遗传差异分析的MITE反应体系,本研究从反应体系总量、TaqPCRMix用量、引物浓度、模板DNA浓度及退火温度、循环次数方面对反应体系进行优化,得到的最佳反应体系为:反应总体积10μL,模板DNA20ng,引物(15μmol/L)2μL,TaqPCRMix5μL。反应程序为95℃预变性3min;95℃变性30s,58℃退火40s,72℃延伸30s,循环32次;72℃延伸10min;4℃保存。利用优化的反应体系从50对AhMITE引物中筛选出11对多态性高的引物,并用于对22份不同来源的花生种质进行遗传多样性分析。结果表明,共扩增出23条带,其中,多态性带21条,多态性比例为91.3%,每个引物平均扩增的多态性带为1.91条。种质间遗传相似系数在0.222~0.957之间,平均值为0.644;通过NTSYS-pcVersion2.1软件基于UPGMA法进行聚类图绘制,在遗传相似系数为0.62时可将22份花生种质分为3大类。表明经过优化的AhMITE反应体系可以有效地用于不同来源花生种质的遗传多样性分析,表现出良好的多态性,可为進一步使用AhMITE标记对花生品种鉴定和遗传图谱构建奠定基础。
关键词:花生;AhMITE标记;反应体系优化;遗传多样性分析
中图分类号:S565.203 文献标识号:A 文章编号:1001-4942(2022)01-0001-06
栽培花生(ArachishypogaeaLinn.,AABB,2n=4x=40)是一种重要的异源四倍体作物,原产于南美洲,富含油脂、蛋白质、维生素和其他微量营养元素[1,2]。评估花生种质资源的遗传变异和种群结构,分析其遗传多样性,对于挖掘花生种质的遗传潜力、选育满足不同需求的花生品种具有重要意义[3]。
分子标记技术已被广泛用于花生种质资源遗传多样性分析,如姜慧芳等[4]用简单序列重复(SSR)标记和扩增片段长度多态性(AFLP)技术分析了31份具有不同青枯病抗性的花生种质的遗传多样性;杨海棠等[5]利用200对多态性较好的SSR分子标记对河南省近年推广及新选育的60个花生品种(系)进行了遗传多样性分析;闫苗苗等[6]应用RAPD和ISSR标记对24份花生材料进行了遗传多样性分析;Zou等[7]使用具有单核苷酸多态性(SNP)标记评估了384份花生种质的遗传多样性。
MITEs即微型反向重复转座元件(miniatureinverted-repeattransposableelements),最早是从玉米中发现的,后被证明广泛存在于动植物基因组中,是一种活跃的、非自主的DNA转座子,在调控基因表达、进化及生物多样性形成中起着重要作用[8,9]。研究表明,利用MITE标记辅助花生种质鉴定和多样性分析简单高效,且揭示的栽培花生DNA多态性明显高于SSR和其他类型分子标记[10-12]。建立适宜的MITE反应体系是扩增多态性条带的关键,决定了后续多样性分析结果的准确性;但不同基因型、不同来源花生种群因受环境影响其最佳AhMITE 反应体系会存在差异[13-15]。因此,本试验首先对AhMITEPCR反应体系的总量、TaqPCRMix用量、引物浓度、模板DNA浓度及退火温度、循环次数进行优化,然后用优化后的反应体系对不同来源的22份花生种质进行遗传多样性分析,评估品种间的遗传变异程度,以期为今后开发和利用AhMITE标记分析花生种群结构、进行种质鉴定及构建遗传图谱提供参考。
1 材料与方法
1.1 试验材料
所用22份花生种质材料均来自于吉林省农业科学院花生育种研究团队,其中,珍珠豆型花生种质19份,多粒型花生种质3份。材料名称和来源见表1。
1.2 DNA提取及PCR扩增
采用CTAB法提取花生组DNA[13],用1.5%琼脂糖凝胶电泳检测花生组DNA的片段和质量,并用超微量分光光度计对DNA的浓度进行测定,将DNA稀释为20ng/μL,放于-20℃冷冻备用。
PCR预先设定的反应程序为:95℃预变性3min;95℃变性30s,56~61℃退火40s,72℃延伸30s,循环28~33次;72℃延伸10min;4℃保存。
PCR产物使用2.0%的琼脂糖凝胶电泳进行检测,电极缓冲液采用0.5×TBE,核酸染料(goldview)染色后在凝胶分子成像系统(JY04S-3E型)中拍照保存。
1.3 AhMITE引物的筛选
将来源不同的东北王、花育20、商花5、宇花16、开农310、冀花13号的花生组DNA以相同比例混合在一起作为DNA模板,对50对AhMITE引物进行特异性筛选[14],最后筛选出11对多态性AhMITE引物(表2),用于花生资源的遗传多样性分析,其中AhTE0577用于AhMITE反应体系的优化。
1.4 AhMITE-PCR反应体系和反应程序优化
对影响PCR反应的6个主要因素进行优化:①反应体系总量设置5、10、15、20、25、30μL,6个梯度;②TaqPCRMix用量设置1、2、3、4、5、6μL,6个梯度;③ 退火温度设置56、57、58、59、60、61℃,6个梯度;④循环次数设置28、29、30、31、32、33,6个梯度;⑤引物(15μmol/L)用量设置1、2、3、4、5、6μL,6个梯度;⑥模板DNA用量设置5、10、15、20、25、30ng,6个梯度。
1.5 数据处理与分析
根据扩增的电泳条带,在NTSYS-pcVersion2.1软件的ntedit中输入“1”(有条带)、“0”(无条带)、“9”(条带缺失),使用软件中的Similarity程序计算花生种质间的遗传相似系数,最后使用Clustering程序基于UPGMA的方法绘制聚类图。
2 结果与分析
2.1 花生基因组DNA浓度及质量检测
提取的花生组DNA经超微量紫外分光光度计检测,OD260/OD280值在2.0左右;琼脂糖电泳检测结果如图1所示,条带明亮、整齐、无污染,浓度较高,可以进一步用于后续试验。
2.2 AhMITE反应体系的优化
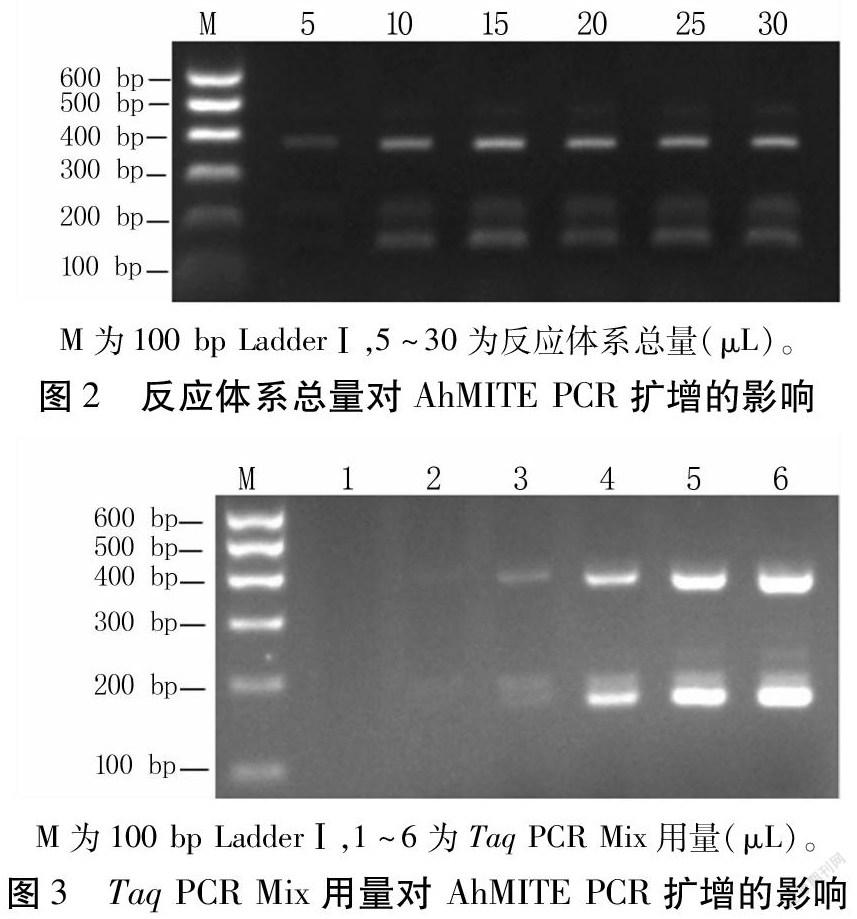
2.2.1 反应体系总量和TaqPCRMix用量对PCR扩增的影响 反应体系总量会影响扩增效率,当反应体系总量为5μL时,部分条带模糊、缺失,而在10~30μL时扩增条带基本一致(图2)。当TaqPCRMix用量为1~3μL时,条带模糊不清,用量为5、6μL时,条带清晰明亮(图3)。综合考虑,反应体系总量选用10μL,TaqPCRMix用量选用5μL。
2.2.2 退火温度和循环次数对PCR扩增的影响
由图4可见,当退火温度为56℃和57℃时条带模糊不清晰,退火温度为58℃时条带清晰可见;退火温度继续升高,条带又变得模糊且亮度减弱。因此,退火温度选用58℃。由图5可见,循环次数为28~30时,180~190bp的条带模糊;循环次数为31时,180bp的条带弥散不清楚;循环次数为33时,条带也模糊不清;只有循环次数为32时,条带清晰可见。因此,循环次数选用32。
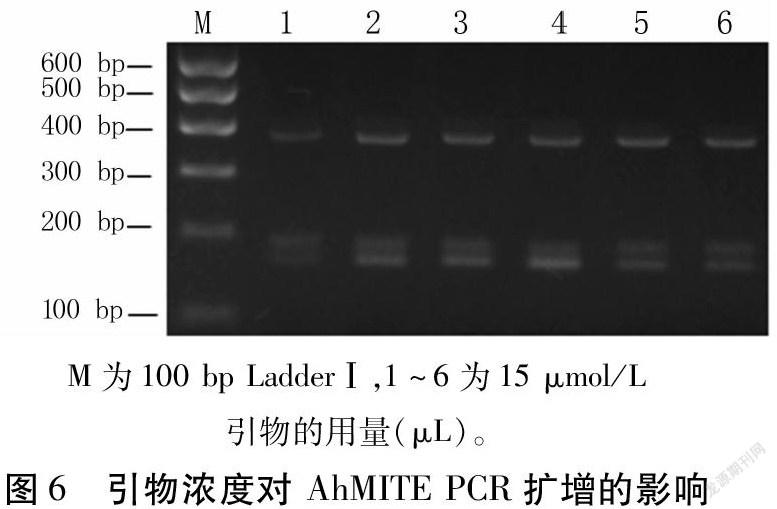
2.2.3 引物和DNA用量对PCR扩增的影响 引物浓度是影响AhMITEPCR扩增效果的重要因素之一。结果(图6)显示,当引物(15μmol/L)用量为1μL时条带模糊,2μL时180、190bp的扩增条带清晰;超过2μL,随着引物用量的增加,扩增条带逐渐模糊、变暗。因此,2μL是最佳引物用量。
结果(图7)显示,模板DNA用量为5~20ng时,条带逐渐变得清晰明亮;DNA用量为25ng和30ng时,条带明亮程度不变。综合考虑,选用20ng作为最适模板DNA用量。
2.3 遗传多样性分析
从50对AhMITE引物中筛选出重复性好、多态性高的引物11对,用于对22份花生种质进行遗传多样性分析,获得了较理想的扩增结果(表2)。图8为以多态性引物AhTE0254为例的扩增结果。
11对AhMITE引物共扩增出23条带,多态性带21条,多态性比率为91.3%;每个引物扩增的条带数为1~3,平均每个引物扩增1.91条多态性带;引物AhTE0622扩增出的带最多,为3条,其余引物均扩增出2条带。
2.4 聚类分析
22份花生种质材料间的遗传相似系数变异范围为0.222~0.957,平均值为0.644。其中,商花511和宇花4的遗传相似系数最小,为0.222,二者遗传距离最远;白院花9号和花育20的遗传相似系数最大,为0.957,二者遗传距离最近。
在遗传相似系数为0.62时,可将22份花生种质分为3大类(图9):第Ⅰ、Ⅱ、Ⅲ类分别包括9、10、3份花生材料。在遗传相似系数为0.754时,第Ⅰ大类又可分为两个亚类,第1亚类包括东北王、白院花9号、吉花9号、I2S2、花育20,第2亚类包括白沙308、宇花16、宇花4、宇花9;第Ⅱ大类在遗传相似系数为0.703时也可分为两个亚类,第1亚类包括花育25、吉花50、阜花22、商花511、宇花5、花育961,第2亚类包括9102、商花5、冀花甜1号、开农310。
3 讨论与结论
3.1 AhMITE反应体系优化
AhMITEPCR反应体系的模板DNA浓度、引物浓度、TaqPCRMix用量和退火温度等因素都会对扩增结果造成明显影响,从而影响后续遗传多样性分析的结果;而且不同花生种质因基因型差异和环境影响,其最佳AhMITEPCR反应体系也会存在差异[15]。因此,优化AhMITEPCR反应体系对试验结果起着至关重要的作用。
PCR反应体系总量会影响扩增效率。本试验结果显示,反应体系总量过低会导致扩增条带模糊、缺失,总量在10~30μL时条带比较清晰、一致。
TaqPCRMix用量过少会导致PCR扩增产物不足,用量过多则会导致非特异性扩增产物增多且增加检测成本[16]。本试验结果表明,TaqPCRMix用量为1μL和2μL时,出现扩增条带缺失现象;随用量增加,逐渐出现清晰条带,当用量为5μL和6μL时条带清晰明亮,效果最佳。
引物浓度过高会导致不匹配和非特异性扩增,而过低则导致无法进行有效扩增;模板DNA浓度过高会使引物或dNTP过早耗尽,导致非特异性扩增,而过低则会导致反应产物减少、扩增条带变弱[17]。本试验结果表明,当15μmol/L引物用量低于或超过2μL时,扩增条带模糊、发暗,用量2μL时扩增条带最清晰;在5~20ng范围内,随着模板DNA用量的增大,扩增条带清晰度增加,15~30ng时条带清晰度无明显差别,与前人研究结果[18,19]基本一致。
退火温度对PCR扩增结果也有较大影响。在一定范围内,退火温度高时扩增产物的特异性较好,退火温度较低则会导致模板DNA与引物的非特异性结合[20]。本试验结果表明,退火温度为58℃时条带清晰,低于或高于该温度时扩增条带均模糊,呈现出低则结合率低、高则抑制的现象。循环次数亦如此,仅当循环32次时可得到清晰条带。这与徐雯等[21]的研究结果基本一致。
综合考虑成本和时间等问题,最终确定AhMITEPCR的最佳反应体系为:反应总体积10μL,模板DNA20ng,15μmol/L引物2μL,TaqPCRMix5μL。扩增程序为:95℃预变性3min;95℃变性30s,58℃退火40s,72℃延伸30s;共循环32次;4℃保存。
3.2 22份花生种质材料的遗传多样性分析
目前花生中应用MITE标记进行的研究多是基于Shirasawa等[22]开发的AhMITE1标记进行的,根据标记在特定位点的插入或缺失判断PCR产物多态性[23,24]。本研究选用Shirasawa等[22]开发的50对引物,并从中筛选到11对多态性引物,对22份花生种质进行检测,结果共扩增出23条带,多态性条带21条,多态性比例为91.3%,每个引物平均扩增的多态性条带为1.91条,多态性较高,表明这些引物可以用于對不同来源花生种质资源的遗传多样性分析。本试验供试材料间的遗传相似系数在0.222~0.957之间,平均值为0.644,具有比较丰富的遗传多样性,这与白冬梅[25]、侯睿[26]等的研究结果类似。聚类分析结果表明,在遗传相似系数0.62处可将22份花生种质分为3大类,其中,商花511和宇花4的遗传相似系数最小(0.222),亲缘关系较远;白院花9号和花育20的遗传相似系数最大(0.957),说明两者亲缘关系较近,也可能是由于AhMITE引物对两花生材料没有特异性。
综合上述分析,优化后的AhMITE反应体系能够扩增出清晰的多态性条带,可用于不同来源花生种质资源的遗传多样性分析。开发更多AhMITE标记对于进一步促进花生分子辅助育种水平及加快新品种选育进程具有重要意义。
