柠檬酸工业生产菌黑曲霉TNA09基因敲除体系的构建
2022-02-28张久祎李洁薛鲜丽王德培周昊
张久祎,李洁,2,薛鲜丽,2,3,王德培,2,3*,周昊
(1.天津科技大学生物工程学院,天津 300457;2.工业发酵微生物教育部重点实验室,天津 300457;3.天津市微生物代谢与发酵过程控制技术工程中心,天津 300457;4.日照金禾生化集团股份有限公司,山东 日照 276800)
黑曲霉作为曲霉属中广泛应用于发酵工业的重要食品安全性微生物菌种,可生产糖化酶、半纤维素酶和纤维素酶[1]、果胶酶[2]等多种水解酶,同时还是发酵生产有机酸(柠檬酸[3]、苹果酸[4]、葡萄糖酸等)的重要菌种。高产柠檬酸工业菌株黑曲霉是经过多次物理和化学诱变筛选而来,具有复杂的细胞结构,增加对其进行分子遗传改造的难度,因此,亟待建立适用于该柠檬酸工业菌株高效的遗传转化体系。
丝状真菌常见的遗传转化方法有聚乙二醇(polyethylene glycol,PEG)-CaCl2介导的原生质体转化法、醋酸锂转化法、电穿法[5]、根癌农杆菌介导转化法(Agrobacterium tumefaciens-mediated transformation,ATMT)[6]。其中PEG介导是指通过化学方法将外源DNA转移至原生质体细胞,且PEG介导的原生质体转化法则可以将多基因及多片段同时转化[7],该方法已被广泛应用于丝状真菌遗传转化。原生质体作为良好的瞬时表达系统,可以同时摄取两个及以上外源质粒或DNA片段以及蛋白酶等大分子物质[8],且由于其受体细胞数量大,故易获得纯合型转化子[9],提高遗传物质交换和基因重组效率,实现通过同源重组对靶基因进行敲除。Zhang等[10]在出芽短梗霉菌(Aureobasidium pullulans)中利用原生质体转化法将含Cas9基因的质粒和一个靶向umps基因的sgRNA共转化至出芽短梗霉菌,实现将突变引入umps基因使得突变率由4%提升至40%,为PEG介导的原生质体转化法在出芽短梗霉中的分子改造提供了新思路。Gao等[11]于耐碱性芽孢杆菌中利用电穿孔方法进行转化但并未成功,改用原生质体转化法,利用PEG诱导原生质体吸收DNA获得1.10×105个转化子/mg质粒DNA,证明原生质体转化法的广泛适用性。
目前,在黑曲霉模式菌株中已经成功建立了PEG介导的原生质体转化方法,王发祥等[12]通过单因素试验、PB试验和响应面法对一株产酸性α-淀粉酶黑曲霉的孢子进行了原生质体制备和再生的条件优化,大大提高了原生质体制备率及再生率,为后续的酸性α-淀粉酶高产黑曲霉菌株的原生质体诱变选育工作提供试验依据。张卫兵等[13]通过混合酶处理产植酸酶黑曲霉PX菌丝,优化原生质体制备和再生的条件,为曲霉孢子原生质体制备提供了参考,也为其后续的原生质体诱变育种提供方便。鲁秀婷[14]利用PEG-CaCl2介导的原生质体转化法将pPTRⅡ-cbh1成功转入黑曲霉Y14原生质体并成功表达,可见PEG-CaCl2介导的原生质体遗传转化对丝状真菌的遗传操作是较为有效的方法。但针对成功在工业黑曲霉菌株中建立PEG介导的原生质体转化方法的鲜见报道,张晓立等[3]将带有amdS筛选标记的质粒pGm转化至柠檬酸工业生产黑曲霉菌株中,成功在柠檬酸工业菌株黑曲霉中建立了以原生质体-PEG法介导的遗传转化体系,但该研究并未实现将DNA外源片段转化至原生质体,两个及以上外源质粒或片段同时转化至原生质体,故黑曲霉高产柠檬酸工业菌株原生质体再生及转化条件仍需研究。
尽管丝状真菌原生质体的分离及制备上的应用研究已有报道,但是黑曲霉高产柠檬酸工业菌株原生质体的转化体系等相关研究较少。本研究以高产柠檬酸黑曲霉工业菌株TNA09(CGMCC5751)为出发菌株,通过对黑曲霉菌丝培养,及其菌丝最佳酶解条件进行优化,确定最佳原生质体制备及再生体系,以黑曲霉次生代谢物的全局转录调节因子laeA[11]基因作为敲除目标,通过PEG-CaCl2介导的原生质体转化法将DNA片段转入细胞中并借助同源重组敲除目的基因;此外,以柠檬酸转运蛋白cexA基因[12]为敲除目标,通过PEG-CaCl2介导的原生质体转化法将外源PFC330质粒及DNA片段转入细胞实现目的基因敲除。本文通过确定黑曲霉TNA09原生质体制备和再生的最佳条件从而实现黑曲霉柠檬酸工业菌株高效原生质体的制备和转化,为黑曲霉工业菌株基因工程遗传改造建立较好的方法,进一步推动高产柠檬酸工业黑曲霉菌株的分子改造过程。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株及质粒
黑曲霉工业菌株TNA09(CGMCC5751):日照金禾博源生化有限公司;用于敲除黑曲霉laeA基因的DNA片段由天津科技大学生化过程与技术实验室构建;用于敲除黑曲霉cexA基因的PFC330质粒由天津科技大学生化过程与技术实验室保藏,用于cexA敲除的sgRNA片段由北京六合华大基因科技有限公司合成。
1.1.2 酶及试剂
裂解酶(200 U/mg)、蜗牛酶(40 U/mg)、溶菌酶(20 000 U/mg):上海索莱宝生物科技有限公司;rTaq酶(5 U/μL)、PrimerSTAR 高保真酶(2.5 U/100μL):日本TaKaRa公司;山梨醇、2-(N-吗啡啉)乙磺酸[2-(N-morpholino)ethanesulfonic acid,MES]、氯化钙(CaCl2)、三羟甲基氨基甲烷-盐酸(Tris-HCl)(均为分析纯):天津市北方天医试剂公司。
1.1.3 渗透压稳定剂及培养基
SMC溶液由山梨醇、MES、CaCl2配制;STC溶液由山梨醇、Tris-HCl、CaCl2配制;TC 溶液由 Tris-HCl、CaCl2配制;聚乙二醇(polyethylene glycol,PEG)buffer参考文献[3]的方法配制;马铃薯葡萄糖肉汤(potato dextrose broth,PDB)培养基参考文献[15]的方法配制;双层固体CM再生培养基参考文献[16]的方法配制,上层下层均含2%琼脂;PDB-溴甲酚绿培养基参考文献[17]的方法配制。
1.2 仪器与设备
CX23光学显微镜:日本OLYMPUS公司;ChampGel全自动凝胶成像仪:北京赛智创业科技有限公司;Mastercycler X50SPCR仪:德国Eppendorf公司;AELTA 320 pH计:梅特勒托利多仪器(上海)有限公司。
1.3 方法
1.3.1 黑曲霉菌丝获得条件的优化
1.3.1.1 不同培养基的选择
取等量黑曲霉孢子悬液接种至PDB培养基及CM液体培养基,37℃培养,比较不同培养基对孢子萌发生长情况的影响。
1.3.1.2 不同孢子接种量及培养方式的优化
在液体培养基中通过比较不同黑曲霉孢子接种量(1×108、5×107、1×107个黑曲霉孢子)和37℃下不同培养方式(静置培养、180 r/min摇床液体培养)对孢子萌发的影响。
1.3.1.3 黑曲霉菌丝生长时间的优化
在同一培养条件下,比较黑曲霉菌丝不同培养时间10、14、17、20 h黑曲霉菌丝制备原生质体的观察。
1.3.2 黑曲霉菌丝最佳酶解条件的优化
1)酶裂解液的配制:复合酶体系为1.50%裂解酶+0.50%蜗牛酶+0.20%溶菌酶。
2)黑曲霉菌丝制备:将滤布和针细滤纸放置于玻璃漏斗,过滤收集新鲜黑曲霉菌丝,无菌水洗涤菌丝后,再用SMC溶液冲洗除去残留液体培养基。
3)黑曲霉菌丝酶解:取不同质量 0.60、0.70、0.80、0.90、1.00 g新鲜菌丝于10 mL酶裂解液中,于37℃、100 r/min 条件下酶解 2.00、3.00、3.25、3.50 h,镜检观察原生质体形成及释放情况,确定最佳酶裂解菌丝质量及最佳酶裂解时间。
1.3.3 黑曲霉原生质体收集
收集原生质体前向裂解液中加入10 mL等体积STC溶液,用大枪头轻轻上下吹打5次,使附着在菌丝体上原生质体释放至溶液中。用已灭菌的双层针细滤纸收集原生质体于新无菌离心管中,于10℃、3 000 r/min离心10 min,弃上清液;以STC轻轻重悬原生质体,于10℃、3 000 r/min离心洗涤3次,最后用 200 μL STC重悬沉淀获得黑曲霉原生质体悬液,通过血球计数板计算原生质体浓度和得率,用于原生质体再生与转化。
1.3.4 原生质体的再生
采用双层平板进行原生质体再生,以CM(含山梨醇)作为底层培养基,采用血球计数板对原生质体数量粗略估计,对收集的原生质体进行梯度稀释,取适量原生质体混匀至上层再生培养基,于37℃倒置培养3 d~4 d,对生长的菌落进行计数,计算原生质体再生率。原生质体再生率计算公式如下。
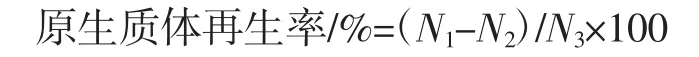
式中:N1为第3天萌发菌落数;N2为第2天菌丝萌发菌落数;N3为显微镜下观察原生质体数。
1.3.5 原生质体转化法介导的laeA基因的敲除及转化子筛选
于50 mL离心管中依次加入以下转化体系,轻弹混匀:TNA09原生质体悬液100 μL(原生质体细胞数应达到1×107个/mL);laeA同源臂、左右臂及Hyg基因的融合片段 10 μL(浓度约 10 μg);PEG buffer 25 μL,冰浴30 min后缓慢加入1 mL PEG buffer,混匀,精确计时5 min后,依次加入2 mL STC溶液,将上述体系加入CM-Hyg(含山梨醇)上层筛选培养基,混匀后平铺至90 mm平板上(已有下层CM+山梨醇筛选培养基),正置1 h后于37℃培养箱倒置培养3 d~4 d。
经过潮霉素抗性筛选获得转化子,提取基因组以laeA-F/laeA-R引物扩增序列包括laeA同源臂、左右臂及Hyg基因为阳性转化子,同时出发菌株基因组DNA为阴性对照,检测是否将laeA基因敲除。
1.3.6 原生质体转化法介导的cexA基因的敲除及转化子筛选
于50 mL离心管中依次加入转化体系,轻弹混匀:黑曲霉TNA09尿嘧啶营养缺陷型菌株的原生质体悬液200 μL(原生质体细胞数应达到2×107个/mL);含pyrG 筛选标记的 PFC330质粒 5 μL(浓度约 8 μg),sgRNA 片段 15 μL(浓度约 8 μg);PEG buffer 50 μL,冰浴30 min后缓慢加入2 mL PEG buffer,混匀,精确计时5 min后,依次加入4 mL STC溶液,将上述体系加至CM(含山梨醇)不含尿苷上层初筛板,混匀,平铺至90 mm平板上(已有下层CM+山梨醇筛选培养基),正置1 h后于37℃培养箱倒置培养3 d~4 d。
经尿嘧啶营养缺陷型回补及PDB-溴甲酚绿筛选获得转化子培养60 h观察产酸圈情况,提取基因组以Cas9-F/Cas9-R引物扩增Cas9基因为可能阳性转化子,以cexA-F/cexA-R引物跨越靶位点进行聚合酶链式反应(polymerase chain reaction,PCR)扩增 cexA 基因,转化子测序比对分析检测是否将cexA基因敲除。
2 结果与分析
2.1 黑曲霉菌丝获得条件的优化
2.1.1 不同培养基对黑曲霉孢子生长的影响
黑曲霉TNA09菌株在不同培养基中菌丝球生长形态见图1。

图1 黑曲霉TNA09菌株在不同培养基中菌丝球生长形态Fig.1 The growth morphology of mycelium pellets of Aspergillus niger TNA09 strains in different media
由图1可知,培养基种类对黑曲霉孢子萌发和菌丝生长有较大影响,CM培养基培养20 h孢子生长缓慢,未萌发成菌丝;而PDB培养基培养20 h孢子萌发较快,菌丝球生长迅速,菌丝细而长,有大量新鲜菌丝产生,菌体量较大,因此PDB液体培养基为原生质体制备的最佳培养基。
2.1.2 不同孢子接种量及培养方式的优化
当相同孢子浓度接种至50 mL培养基时菌丝萌发较慢,约20 h后部分孢子萌发成菌丝,大部分孢子仍呈未萌发状态;接种至100 mL培养基时,约17 h后大量孢子萌发产生新鲜菌丝;接种至250 mL培养基时,需20 h部分孢子萌发形成菌丝。因此100 mL液体培养基装液量为原生质体制备的最佳培养条件。
黑曲霉孢子接种量的多少对幼嫩菌丝的形成时间及原生质体的形成影响较大。结果显示,原生质体制备所需接种最佳孢悬浓度为1×108个/mL,取1 mL菌液接种至100 mL PDB培养基,此条件下大部分孢子呈萌发状态,菌丝细长,利于原生质体制备及释放。当接种量过少时,如接种量为1×107个/mL和5×107个/mL时,菌丝培养时间过长,菌丝老化不适宜制备原生质体。
2.1.3 黑曲霉孢子萌发时间的优化
斜面孢子培养时间的控制对形成幼嫩的菌丝球至关重要,黑曲霉TNA09孢子培养时间对原生质体释放影响见图2。

图2 黑曲霉TNA09孢子培养时间对原生质体释放影响Fig.2 Influence of spore culture time of Aspergillus niger TNA09 on protoplast release
由图2可知,当培养时间为17 h时,菌丝可以释放最大数量的原生质体,此时的菌丝细胞壁结构更容易被裂解,最适宜原生质体的制备。培养时间短,导致原生质体释放量不足;而培养时间过长时,菌丝细胞壁结构成分改变,不适宜原生质体的释放。
综合菌丝获得条件的优化,菌丝生长最佳条件为接种菌龄5 d的黑曲霉孢子1×108个,于100 mL液体培养基,37℃、180 r/min摇床培养。
2.2 黑曲霉菌丝最佳酶解条件的研究
2.2.1 酶解时间的优化
用混合酶处理新鲜菌丝,设定酶解时间为2.00、3.00、3.25、3.50 h 4个时间组,定时取样观察原生质体形成情况见图3。
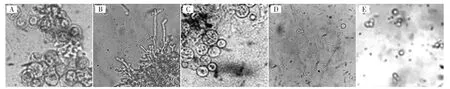
图3 不同酶解时间下原生质体释放及回收情况Fig.3 Release and recovery of protoplasts under different enzymatic hydrolysis time
由图3可知,酶解时间为3.50 h时菌丝消化过度,原生质体状态不佳,而酶解3.25 h原生质体释放情况最佳,故通过血细胞计数板计算原生质体回收数目,浓度可达5×107个/mL,此时制备出的原生质体大小均匀,呈均匀圆球状且比较稳定、分散性好。菌丝酶解时间过短,菌丝酶解不充分;菌丝酶解时间过长,原生质体开始消解变形,大大影响后续原生质体再生试验。
黑曲霉菌丝在裂解酶的作用下释放原生质体,酶解2.00 h(图3A)菌丝的顶端或其他部位出现细胞膜突起,部分孢子出现质壁分离,基本没有完整球状原生质体释放;3.00 h后(图3B),菌丝膨胀形成小球体并从菌丝顶端或其他部位释放原生质体,最后脱离菌丝,此时可见大量的原生质体形成;3.25 h后原生质体细胞壁被完全酶解,大部分菌丝释放原生质体(图3C),经原生质体回收获得球状体单个或串珠状排列的原生质体,此时原生质体大小均匀,形态稳定分散性好(图3E);3.50 h后菌丝多被酶解成细小的片段(图3D),由于酶解时间过长消化过度,经原生质体回收出现原生质体残骸及部分破裂菌丝,说明由于脱壁过于彻底可能给原生质体造成了难以恢复的损伤。因此,高产柠檬酸生产菌株的原生质体制备与再生的最佳酶解时间为3.25 h,且酶解后应尽快除去酶解液,以防止过度裂解,影响原生质体的制备与再生效率。
2.2.2 酶裂解菌体量对原生质体再生影响
酶解菌体量对原生质体形成与再生的影响结果见表1。
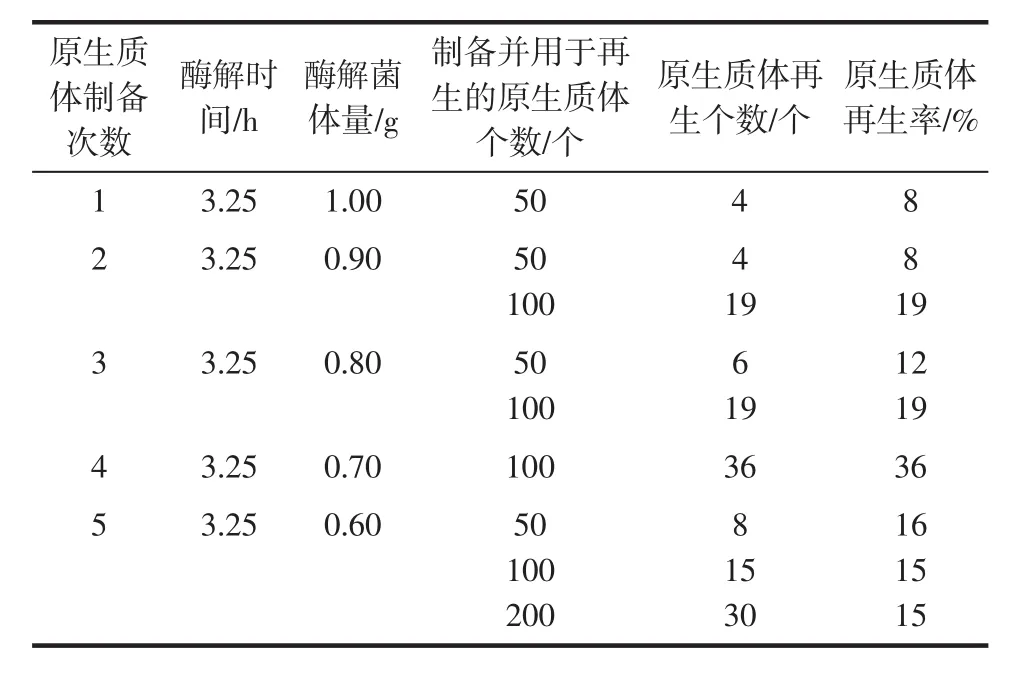
表1 酶裂解菌体量对原生质体再生影响Tabel 1 Influence of enzymatic lyzing bacteria on protoplast regeneration
由表1可知,原生质体再生率随着菌体量增加整体呈现先增后减的趋势,在酶裂解菌体量为0.70 g时,原生质体的再生率最高达到36%。
2.3 PEG-CaCl2介导的原生质体转化
2.3.1 PEG-CaCl2介导的原生质体转化对laeA基因敲除
laeA敲除菌株PCR鉴定见图4。
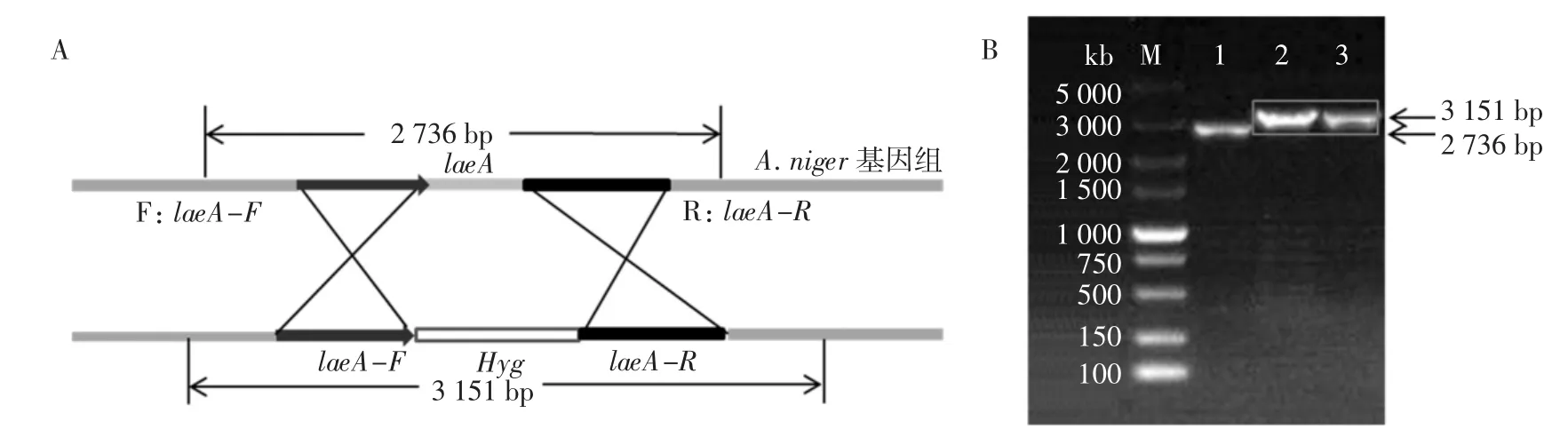
图4 laeA敲除菌株PCR鉴定Fig.4 PCR identification of laeA knockout strain
采用PEG-CaCl2介导的原生质体转化方法将带潮霉素筛选标记的laeA敲除片段转化至菌株TNA09中(图 4A),所用原生质体数达 5×106个,在含 150 μL/mL潮霉素平板初筛约80个,在含200 μL/mL潮霉素复筛获得48个转化子,随机选取其中8个转化子提取基因组进行PCR验证,从中筛选到2株原位插入阳性转化子,即laeA基因敲除的转化子,由图4B可知,1号泳道为黑曲霉柠檬酸工业菌株TNA09基因组为模板作为阴性对照,PCR扩增出laeA基因条带,长度为2736 bp;2、3号泳道有唯一的laeA左右臂加Hyg阳性条带,长度为3 151 bp,说明获得敲除laeA基因的阳性转化子,最终成功在高产柠檬酸黑曲霉工业菌株中建立了PEG-CaCl2介导的原生质体转化方法。
2.3.2 PEG-CaCl2介导的原生质体转化对cexA基因敲除
菌株50号酸圈观察及PCR鉴定见图5。
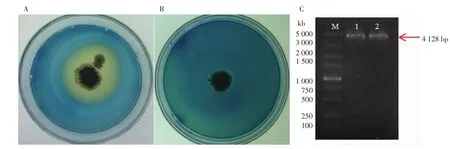
图5 菌株酸圈观察及PCR鉴定Fig.5 Acid circle observation and PCR identification of strain
采用PEG-CaCl2介导的原生质体转化法对cexA基因敲除,于CM不含尿苷初筛板上挑取61个转化子至CM溴甲酚绿平板,培养观察产酸圈,选取产酸圈较不明显菌株50号及出发菌株TNA09至60 mm CM-溴甲酚绿平板观察酸圈情况,由图5可知,60 h后TNA09酸圈明显,酸圈部分呈黄色,圈径比达3.10,50号转化子不产酸,呈蓝绿色。
通过PEG-CaCl2介导的黑曲霉原生质体转化进行基因编辑的瞬时表达,将PFC330质粒及作用于cexA靶基因的sgRNA片段同时转化至黑曲霉原生质体,对PFC330质粒表达进行检测,1号泳道为以PFC330为模板作为阳性对照,PCR扩增出Cas9基因条带,长度为4 128 bp;2号泳道以提取出黑曲霉转染3 d后的50号转化子基因组DNA为模板,有唯一的Cas9阳性条带,长度为4128 bp,说明转化子实现pyrG回补并成功转入Cas9基因。
原生质体基因组编辑的突变检测见图6。

图6 原生质体基因组编辑的突变检测Fig.6 Mutation detection after genome-editing using a protoplast transfection system
对靶向编辑能力进行检测,以阳性转化子跨越靶位点的特异性引物(cexA-F/cexA-R)进行PCR扩增,获得目的片段测序。由图6可知,被转化的原生质体基因组DNA存在基因编辑,靶位点序列位于靶基因cexA基因的CDS区,于靶位点后469 bp因脱靶效应造成碱基G替换成A,比对全基因序列,只有该处有碱基替换,导致甘氨酸变异成谷氨酸,初步推测利用Crispr/Cas9基因编辑实现利用原生质体法,将柠檬酸工业黑曲霉TNA09中柠檬酸转运蛋白cexA基因突变,cexA基因功能丧失,50号转化子不产酸。实现同时将质粒及外源DNA片段转化至柠檬酸工业生产菌黑曲霉原生质体,为后期工业黑曲霉菌株基因编辑提供技术平台。
3 讨论与结论
近年来高产柠檬酸黑曲霉工业菌株的分子遗传改造技术逐渐引起人们重视,建立高效的遗传操作系统是通向分子改造提升菌株生产性能的关键。目前,丝状真菌的遗传转化方法主要有根癌农杆菌转化方法和PEG-CaCl2介导的原生质体转化两种方法,其中原生质体转化方法可以实现多个质粒或片段同时转入细胞中。野生型黑曲霉菌株呈发散菌丝状生长,高产柠檬酸黑曲霉工业菌株TNA09菌丝聚缩成菌丝球形态,菌丝分支多相互缠绕,游离菌丝少且短,细胞壁成分复杂,导致其原生质体的制备较困难,无法获得大量高质量的原生质体,从而影响工业菌株的遗传改造。至此,本试验以柠檬酸工业生产菌株TNA09为研究对象,从新鲜孢子接种量、幼嫩菌丝培养条件、酶解菌丝量以及酶解时间等方面进行研究,最终确定了TNA09获得较高原生质体数量的最佳条件,即CM培养基斜面培养5 d黑曲霉孢子,以PBD液体培养基100 mL,孢子浓度108个/100 mL 37℃培养17 h,所获得的菌丝有利于酶解和释放原生质体,并且原生质体的再生率高。
本研究发现高质量的原生质体的获得及高再生率[18]是工业菌株原生质体转化方法的关键,且二者受多种因素的影响。例如Gong等[19]通过再生培养基、酶解温度、酶解时间和渗透稳定剂的研究,确定了纤维堆囊菌(Sorangium cellulosum)原生质体再生和制备的最佳条件,为提高埃坡霉素的产量提供了原生质体改造的依据。Liang等[20]研究不同渗透压稳定剂对原生质体再生影响,表明渗透压稳定剂浓度过高或过低,原生质体的制备和再生均会受到严重影响,同时渗透压稳定剂也会影响酶的活性,从而间接影响原生质体的产量;张晓立等[3]研究使用混合酶制备原生质体比单独使用一种酶的效果好,同样本研究采用的混合酶系形成的原生质体数量可达5×107个/mL;除此之外,本研究中选择的PDB作为菌丝生长最佳的培养基培养17 h时可获得大量菌丝体,而张晓立等[3]所使用的CMA培养基培养菌丝体则需要48 h。同样酶解时间对原生质体质量和产量影响较大,张晓烜等[21]研究表明,以里氏木霉40359为出发菌株,酶解时间2 h最佳,时间过长或过短都使原生质体质膜受到不同程度损伤。本研究中以黑曲霉TNA09为出发菌株时3.25 h为最佳酶解时间,较其它丝状真菌酶解处理时间更长,如张晓立等[3]制备工业黑曲霉菌株Co827的衍生菌株原生质体所需时间为2.50 h。总之,制备高质量的原生质体利于提高原生质体再生率以及后续的转化。
本研究确定了黑曲霉TNA09原生质体制备和再生的最佳条件,采用1.50%裂解酶+0.50%蜗牛酶+0.20%溶菌酶的复合酶体系处理0.70 g菌丝体3.25 h后,可获得形态完整大小均匀的原生质体,并且原生质体的再生率可达到36%。进而通过PEG-CaCl2介导的原生质转化方法敲除了黑曲霉中laeA、cexA基因,成功在黑曲霉高产柠檬酸工业菌株TNA09中建立了PEGCaCl2介导的原生质体转化方法,为后续利用原生质体实现更多DNA转化和通过同源重组敲除目的基因奠定基础,进一步推动高产柠檬酸工业黑曲霉菌株的分子改造过程。
