创伤性脑损伤大鼠模型中与铁死亡相关的基因探索
2022-02-28吴海鹰杨方林杨怡然钱传云
杨 莉, 李 坪, 吴海鹰, 杨方林, 杨怡然, 揭 娟, 钱传云
创伤性脑损伤(traumatic brain injury,TBI)是急诊常见损伤相关性疾病[1],世界范围内每年有约5000万人罹患TBI[2],占用大量宝贵的急诊医疗资源。TBI的原发性损伤不可逆转[3],继发性损伤导致的神经细胞死亡是TBI病理生理机制和潜在的治疗靶点[4],减少神经元死亡是治疗TBI继发性损伤的关键策略之一。有研究针对氧化应激、凋亡和自噬介导的细胞死亡对TBI进行干预,而取得的成就有限,TBI的临床治疗依然是一个待攻克的难点[5]。铁死亡是新近提出的程序性细胞死亡方式,有研究[6-7]表明,铁死亡可能与中枢神经系统损伤性疾病密切相关,但关于铁死亡在TBI中,尤其是自由落体损伤性TBI中的作用及价值,目前研究还很少。铁死亡(Ferroptosis)以特征性形态学及生物学改变有别于其他类型的程序性细胞死亡,其特征有细胞膜破裂、线粒体萎缩、ROS含量升高和铁离子聚集等[8]。虽然目前关于铁死亡分子机制的研究已经取得一定的进展,但铁死亡在TBI继发性损伤中的具体过程、相关机制仍然不清楚。本研究采用改良Feeney自由落体法建立大鼠TBI模型[9],通过普鲁士蓝(Perl′s)染色、透射电镜、荧光定量PCR、转录组测序和生物信息学分析等方法,探索铁死亡在大鼠TBI中的发生,筛选与铁死亡密切相关的基因,以期进一步完善TBI的病理生理机制。
1 材料与方法
1.1实验动物 选取雄性SD(Sprague Dawley)大鼠,体质量(300±20)g,年龄8~12周。实验方案通过昆明医科大学实验动物伦理委员会批准(kmmu2021148),实验过程严格遵照实验动物伦理要求,最大限度地减轻动物的痛苦。
1.2动物模型制备与分组 将SD大鼠随机分为对照组(Sham组)和TBI组(每组n=15),其中每组3个样本进行转录组测序,3个样本制备组织切片进行Perl′s染色,3个样本进行透射电镜检测,6个样本进行荧光定量PCR检测。根据改良Feeney自由落体法制备重型TBI大鼠模型[9]。使用七氟烷吸入联合10%水合氯醛(280 mg/kg)腹腔注射麻醉,头部备皮后固定于脑立体定位仪,消毒后取正中切口,切开头皮,分离至右侧颅骨完整暴露,以冠状缝后3 mm、矢状缝右3 mm为圆心,钻一直径约5 mm的骨窗,从25 cm高度将40 g砝码自由落下,打击脑组织,随后止血、缝合。Sham组只开骨窗,不做自由落体损伤。造模完成后将大鼠置于温箱复苏,再放回更换有新垫料的笼中饲养。
1.3Perl′s染色 将切片放入二甲苯20 min×2次,无水乙醇5 min×2次,75%乙醇5 min,随后蒸馏水洗3遍。擦干水分后放入染液中染色约30 min,随后蒸馏水洗2遍。擦干水分后在组织上滴DAB 显色液,染色5~10 min,显微镜下观察控制显色程度,染色结束后倾去染液用0.01 mol/L的PBS 溶液浸洗切片1次,蒸馏水洗3次。使用苏木素染核 1 min,随后自来水冲去染液,将切片放入盐酸酒精中分化30 s,随后放入氨水中返蓝。最后,切片放入无水乙醇脱水5 min×3次,二甲苯浸洗切片5 min×2次,使其透明。封片,待干燥后镜检分析。
1.4透射电镜扫描 TBI致伤24 h后大鼠脑组织活体取材(每组n=3),将损伤周围皮质用锋利的刀片修整为1 mm3的组织块,保存于电镜固定液中,后续检测委托武汉赛维尔生物科技有限公司完成。
1.5差异表达基因(differentially expressed genes,DEGs)筛选 TBI大鼠致伤24 h后取损伤区域周围皮质(每组n=3),转录组测序由北京诺禾致源科技股份有限公司完成,得到的数据集命名为自有数据集。对数据集进行质量控制、匹配、量化和标准化,得到mRNA表达矩阵,使用“edgeR”软件包,将筛选阈值设定为P<0.05,筛选出TBI组中差异表达的mRNA。
1.6公共数据集获取 从GEO数据库(http://www.ncbi.nlm.nih.gov/geo)下载GSE111452数据集,该数据集包含TBI后24 h及Sham组大鼠顶叶皮质测序数据各4个,在GPL2740平台上生成测序数据,与自有数据集结果进行比对分析,得到共有DEGs。
1.7铁死亡相关基因获取 从Ferrdb数据库(http://www.zhounan.org/ferrdb/)获取铁死亡相关基因,与共有DEGs进行比对分析。
1.8荧光定量PCR 取TBI组和Sham组大鼠损伤周围脑组织样本(每组n=6只),提取RNA,逆转录完成后配置扩增体系,设置参数如下:95 ℃,30 s;95 ℃,5 s;60 ℃,30 s(共40个循环);95 ℃,15 s;60 ℃,1 min;95 ℃,15 s。反应完成后,以GAPDH的Ct值为参照,采用2-△△Ct法计算每个基因的相对表达量,进行统计分析。研究中使用的引物见表1。
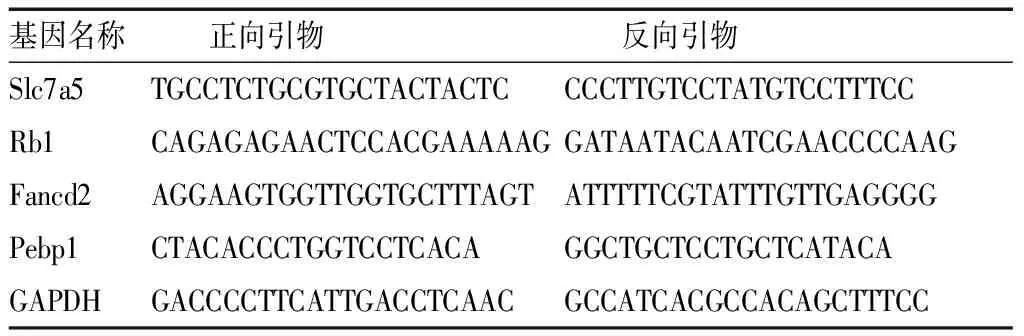
表1 本研究中使用的引物列表
1.9统计学处理 数据统计分析采用Graphpad Prism 8.3.0软件。使用差异倍数和P值筛选组间差异表达的mRNAs,将差异倍数对数的绝对值≥1且P<0.05 作为差异基因筛选标准,对差异表达的mRNAs进行聚类分析,并绘制聚类热图。两组间DEGs的mRNA表达水平使用t检验分析,P<0.05为差异有统计学意义。
2 结果
2.1TBI大鼠脑组织神经元发生铁死亡 Perl′s染色结果显示,TBI组大鼠脑组织损伤周围皮质铁沉积情况较Sham组明显。透射电镜扫描结果显示,Sham组中,神经元线粒体形态及体积正常,膜连续性好,内嵴显示清晰。TBI组大鼠脑组织神经元的线粒体萎缩变小,基质颜色较深,膜增厚致密度高,部分外膜模糊并破损,伴有内嵴扩张、减少,提示TBI组大鼠脑组织神经元发生铁死亡。见图1。
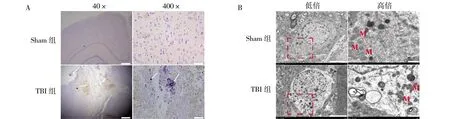
注:A为Perl′s染色显示大鼠脑组织损伤周围区域皮质铁沉积情况,白色箭头所示为铁沉积区域(标尺:40×为1 mm,400×为100 μm);B为透射电镜扫描显示大鼠脑组织损伤周围皮质神经元发生铁死亡;红色方框标识观察区域M为线粒体(标尺:低倍为1 μm,高倍为5 μm);Sham组为对照组,TBI组为创伤性脑损伤组
2.2基于转录组测序结果和公共数据集分析TBI大鼠脑组织中DEGs 将TBI组和Sham组测序数据进行质控、比对,共发现2786个DEGs,其中1426个为上调基因,1360个为下调基因。在GEO数据库查询到GSE11452数据集,该数据集包括4个TBI样本和4个Sham样本,为重型TBI后24 h大鼠顶叶皮质组织转录组测序结果。在GSE11452数据集中,以P<0.05为差异表达基因筛选依据,发现TBI组中共有2552个DEGs,其中1110个上调基因,1442个下调基因。将转录组测序结果与GSE11452取交集,共得到241个共有DEGs,其中135个为上调基因,106个为下调基因。见图2。

注:A为转录组测序DEGs热图;B为GSE111452中DEGs热图;C为转录组测序的DEGs和GSE111452中DEGs取交集的结果
2.3DEGs与铁死亡相关基因交集分析 将241个共有DEGs与铁死亡相关基因(来自FerrDb数据库,http://www.zhounan.org/ferrdb/index.html)取交集,发现4个共有DEGs同时也为铁死亡调控基因(见图3),分别为Slc7a5、Fancd2、Rb1和Pebp1。
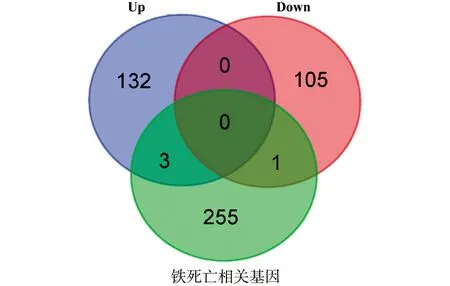
图3 TBI大鼠脑组织中DEGs与铁死亡基因取交集的结果
2.4荧光定量PCR验证与铁死亡相关DEGs mRNA表达 通过荧光定量PCR检测,发现与测序结果一致,TBI组中Slc7a5和Rb1 mRNA表达量显著上调,Fancd2 mRNA表达量也上调,但与Sham组比较差异无统计学意义(P>0.05);Pebp1 mRNA在TBI脑组织中表达水平显著下调。见图4。

图4 两组大鼠与铁死亡相关的DEGs mRNA表达量统计
3 讨论
铁死亡的概念[10]于2012年提出,目前,虽然铁死亡的确切病理和生理功能还在研究中,但铁死亡在人类疾病中的作用已经确定。大量研究[11]表明,通过抑制或刺激这种独特的细胞死亡方式可能对某些疾病产生显著的临床益处。本研究已证明,铁死亡参与了TBI的继发性损伤过程。有学者[12]发现,TBI小鼠模型脑组织中出现铁沉积现象,并且与铁死亡相关的基因表达被上调;另一项研究[13]则发现,HT22神经元细胞损伤模型和小鼠TBI模型中均出现铁死亡。本研究结果与此一致,大鼠遭受TBI后24 h内脑组织即出现显著铁沉积现象,同时透射电镜发现,线粒体萎缩,膜结构破损及内嵴减少等典型的铁死亡形态学特征变化,证实铁死亡与TBI的病理生理过程密切相关。
细胞死亡是TBI患者遗留神经功能障碍的主要原因之一,同时也是TBI后发生退行性疾病的关键驱动因素,本研究结果表明,调控铁死亡或许是未来TBI治疗方法的研究方向之一。虽然文献已证实铁死亡参与了多种中枢神经系统疾病,但具体机制,尤其是铁死亡在TBI中的机制研究较少。目前,关于铁死亡的机制研究主要围绕半胱氨酸和谷胱甘肽代谢,以及磷脂过氧化物酶GPX4阻止过氧化脂质积聚等方面[14],相关的分子标志物则有铁转运和代谢相关分子FTH1、细胞色素p450还原酶[15-16]等。此外,在肿瘤模型中,p53和Nrf2介导的信号通路还可以通过Slc7a11干扰氨基酸转运诱导铁死亡[17]。
本研究采用转录组测序和生物信息学分析的方法发现,铁死亡相关基因Slc7a5、Fancd2和Rb1在TBI组高表达,Pebp1则低表达。Slc7a5是溶质载体(solute carrier, SLC)是家族成员之一,在中枢神经系统主要存在于血脑屏障(BBB)内皮细胞,负责氨基酸、甲状腺激素的转运,影响神经细胞生长[18]。Slc7a5突变可能与运动、社交和语言功能发育迟缓有关,出现自闭症样症状和癫痫[19]。有研究[20-21]发现,敲除Slc7a5使颗粒细胞胞体萎缩,轴突分枝变少,甚至细胞死亡,说明Slc7a5对神经系统的发育与修复至关重要。本研究中,Slc7a5在TBI后显著上调,是否与BBB被破坏,内皮细胞中的Slc7a5大量释放有关,尚待进一步研究。Fancd2是DNA损伤修复相关核蛋白,文献[22]证实, Fancd2保护骨髓基质细胞免受铁死亡所致的损伤,Fancd2缺乏使细胞对铁死亡更敏感,提示Fancd2在骨髓瘤中是一种铁死亡抑制性因子。此外,Fancd2高表达与肾透明细胞癌和膀胱癌预后不良相关[23-24],但Fancd2如何调控TBI后脑组织铁死亡,目前文献[25]较少。Rb1可以负调控细胞周期,Rb1缺失导致小细胞肺癌耐药,可能与铁死亡有关。本研究中TBI组Rb1 mRNA表达上调,可能参与铁死亡的发生。Pebp1是一种蛋白激酶级联的支架蛋白抑制剂,通过调控脂质过氧化物的生成触发铁死亡[26]。支持Jiao等[27]发现,中成药逍遥散通过Pebp1/Gpx4途径调控小鼠海马神经元铁死亡,说明上调Pebp1能够减轻神经元铁死亡。本研究结果中TBI组Pebp1表达水平下降,从而诱导铁死亡的发现与文献一致。
本研究通过形态学、分子生物学和生物信息学分析的方法,证实TBI大鼠脑组织发生铁死亡,铁死亡的发生可能与脑组织中Slc7a5、Fancd2、Rb1和Pebp1基因表达谱的改变密切相关,丰富了TBI的病理生理过程。
