水产功能性发酵豆粕的工艺条件研究
2022-02-26袁泽珲杨红玲张姣锦孙云章
■袁泽珲 杨红玲 张姣锦 孙云章
(集美大学水产学院,厦门市饲料检测与安全评价重点实验室,福建 厦门 361021)
鱼粉由于蛋白含量高、氨基酸组成平衡及抗营养因子较少等众多优点一直是水产饲料重要的蛋白来源,在肉食性鱼类饲料中约占30%~50%[1]。根据FAO统计数据显示,由于全球鱼粉的供求关系不平衡,致使鱼粉价格居高不下[2]。利用大豆蛋白替代鱼粉是近十几年来水产动物营养与饲料领域的研究热点[3]。但是,大豆蛋白中抗原蛋白占比为65%~80%,难以通过热处理或饲料加工去除,显著影响鱼类肠道的微生态结构、破坏肠道黏膜结构完整性、影响机体对营养物质的消化和吸收、降低饲料蛋白质利用率等[4]。
近年来,生物发酵技术被广泛用于饲料原料的改造,豆粕经微生物发酵后,其抗营养因子含量显著下降,而且,微生物菌活动过程中能够将一些难以吸收的有机物分解转换为蛋白质饲料,增加了饲料的营养价值。另外,生物发酵饲料中所含的益生菌能够调节水产动物免疫功能,颉颃病原菌,提高动物的生产性能[5]。当前,用于制作水产用发酵豆粕的菌株多分离于环境和恒温动物中,很多菌株虽然具有降解抗营养因子等作用,但是难以发挥调控宿主免疫机能的作用,难以在动物消化道内定植或者是存活时间短、稳定性差、对肠道菌群调控能力弱[4]。因此,一些学者认为理想的发酵菌株应来自水产动物自身消化道[6-7]。目前对于水产动物而言,土著菌株资源的开发仍然严重不足[8]。另外,大量研究显示,与单菌发酵相比,复合菌发酵更有利于发挥微生物之间的互利共生作用,提高营养物质的利用率[9]。
本研究利用实验室前期筛选出3 株优良功能菌株(短小芽孢杆菌SE5、酿酒酵母菌Sa 以及乳酸乳球菌17)协同发酵豆粕,以抗原蛋白降解效果为评价指标,优化菌株比例、接种顺序、料液比、接种量、发酵温度和发酵时间等参数,再应用正交设计试验对上述参数进行优化,明确复合菌最佳发酵条件,建立一种生产优质水产功能性发酵豆粕的工艺。
1 材料与方法
1.1 试验材料
1.1.1 试验菌株
短小芽孢杆菌SE5(Bacillus pumilusSE5)分离自斜带石斑鱼肠道,菌落为乳白色、半透明、隆起、边缘整齐、菌落较小(直径0.5 mm)、革兰氏阳性菌、好氧。菌株以25%甘油为保护剂保存于-80 ℃冰箱。
乳酸乳球菌17(Lactococcus lactis17)分离自小丑鱼肠道,菌落为白色、湿润、极小、革兰氏阳性菌、兼性厌氧。菌株以25%甘油为保护剂保存于-80 ℃冰箱。
酿酒酵母菌Sa(Saccharomyces cereusSa)分离自酒曲。菌落为乳白色、湿润、隆起、菌落整体黏稠、表面较光滑、容易挑起、质地较均匀、直径在0.5~0.6 cm,兼性厌氧。菌株以25%甘油为保护剂保存于-80 ℃冰箱。
1.1.2 培养基
MRS 肉汤培养基:用作乳酸菌培养,购于青岛海博生物技术有限公司。
YPD 液体培养基:用作酵母菌培养,购于青岛海博生物技术有限公司。
2216E 液体培养基:用作短小芽孢杆菌培养,购于青岛海博生物技术有限公司。
1.2 试验方法
1.2.1 发酵种子液的制备
短小芽孢杆菌SE5发酵种子液制备:取保藏的菌液200 μL 接至50 mL 2216E 液体培养基中,30 ℃,150 r/min,活化24 h。活化后以5%的接种量进行传代2 次,根据菌株的生长曲线,取第二次传代的最佳生长期菌液[10]作为发酵种子液,待接种豆粕。
乳酸乳球菌17 发酵种子液的制备:取保藏的乳酸菌菌液200 μL 接至50 mL MRS 液体培养基中,30 ℃,150 r/min,活化24 h。活化后以5%的接种量进行传代两次,根据菌株的生长曲线,取第二次传代的最佳生长期菌液作为发酵种子液。
酿酒酵母菌Sa 发酵种子液的制备:酵母菌菌液200 μL 接至50 mL YPD 液体培养基中,30 ℃,150 r/min,活化24 h。活化后以5%的接种量进行传代两次,根据菌株的生长曲线,取第二次传代的最佳生长期菌液作为发酵种子液。
1.2.2 复合菌株配伍
复合菌株的比例是影响豆粕发酵效果的重要因素。试验设定的控制因素是料液比1∶1、总接种量10%、发酵温度30 ℃、发酵时间48 h,变量是菌株比例,考察菌株比例对发酵豆粕抗原蛋白降解程度的影响。菌株比例的试验设计见表1。

表1 菌株比例试验设计
1.2.3 复合菌株接种顺序
考虑到试验中复合菌各菌株的生长特性,芽孢杆菌是好氧型菌,酵母菌是兼性厌氧型菌,乳酸菌是厌氧型菌。为了使各菌株有更好的生长繁殖条件,试验在得到最佳菌株比例的基础上,设定的控制因素是料液比1∶1,总接种量10%,发酵温度30 ℃,发酵时间48 h,变量是菌株接入顺序,考察复合菌株接种顺序对发酵豆粕抗原蛋白降解程度的影响。菌株接种顺序的试验设计见表2。

表2 菌株接种顺序试验设计
1.2.4 正交试验设计
为提高豆粕的利用效率,在得到复合菌最佳配伍比例、最佳接种顺序以及单因素优化的水平基础上,研究复合菌发酵豆粕的工艺最大程度化降解大豆球蛋白和β-伴大豆球蛋白,采用Minitab软件设计的L9(34)正交表,通过正交试验来寻找降解大豆抗原蛋白的最佳工艺条件。因素水平设计见表3,正交试验设计见表4。
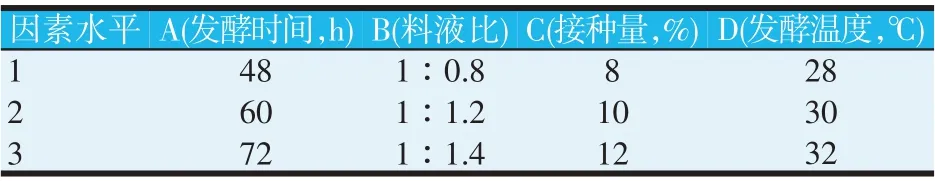
表3 因素水平表

表4 正交试验设计
1.2.5 大豆球蛋白和β-伴大豆球蛋白的测定
大豆球蛋白(Glycinin)(酶联免疫法)和β-伴大豆球蛋白含量(β-Conglycinin)(酶联免疫法)的测定采用北京龙科方舟生物工程技术有限公司提供的试剂盒进行,具体操作参考彭翔等[11]。
1.2.6 统计方法
试验数据采用Microsoft Excel 2013作初步处理,用SPSS 22.0软件分析处理各组试验的差异作数据描述性分析。正交试验设计表用Minitab设计,方差结果分析用SPSS 22.0作一般线性模型多变量方差分析。
2 结果与分析
2.1 不同配伍比例对大豆抗原蛋白含量的影响(见图1)
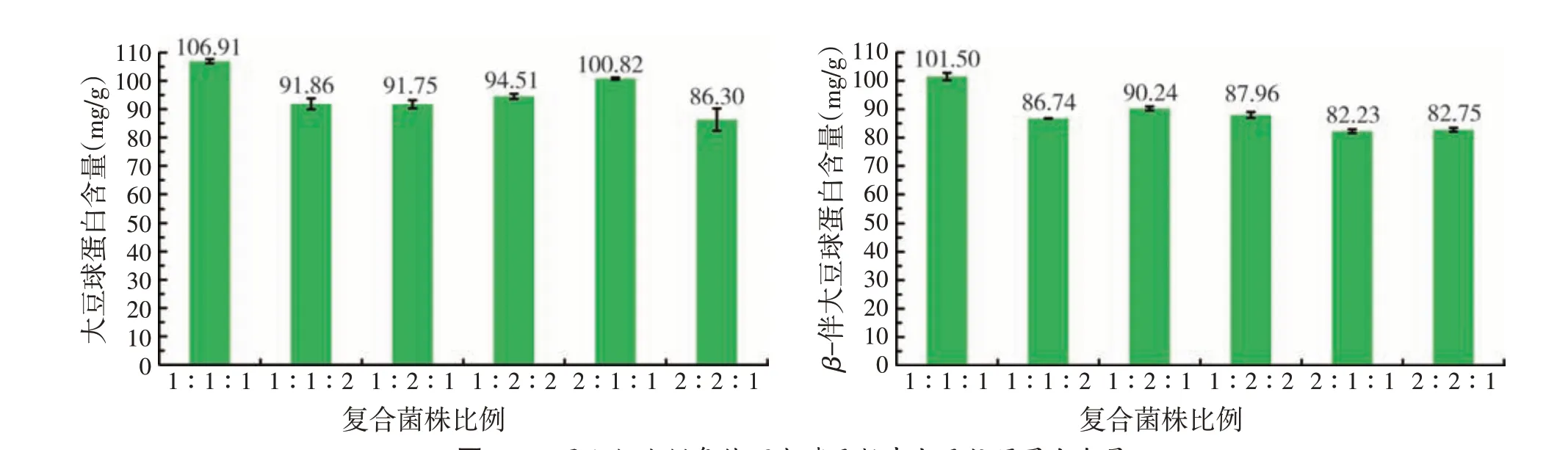
图1 不同配伍比例条件下发酵豆粕中大豆抗原蛋白含量
由图1 可知,短小芽孢杆菌SE5∶酿酒酵母菌Sa∶乳酸乳球菌17以2∶2∶1的比例接种发酵后,发酵豆粕中残留大豆球蛋白和β-伴大豆球蛋白含量相对少,其次是1∶2∶1和1∶1∶2的菌株比例。
2.2 不同接种顺序对大豆抗原蛋白含量的影响(见图2)
由图2可知,按照先接入短小芽孢杆菌SE5,12 h后接入酿酒酵母菌Sa,24 h后接入乳酸乳球菌17的接种顺序,抗原蛋白的降解效果最佳,大豆球蛋白和β-伴大豆球蛋白的含量分别是59.22 mg/g和24.83 mg/g。
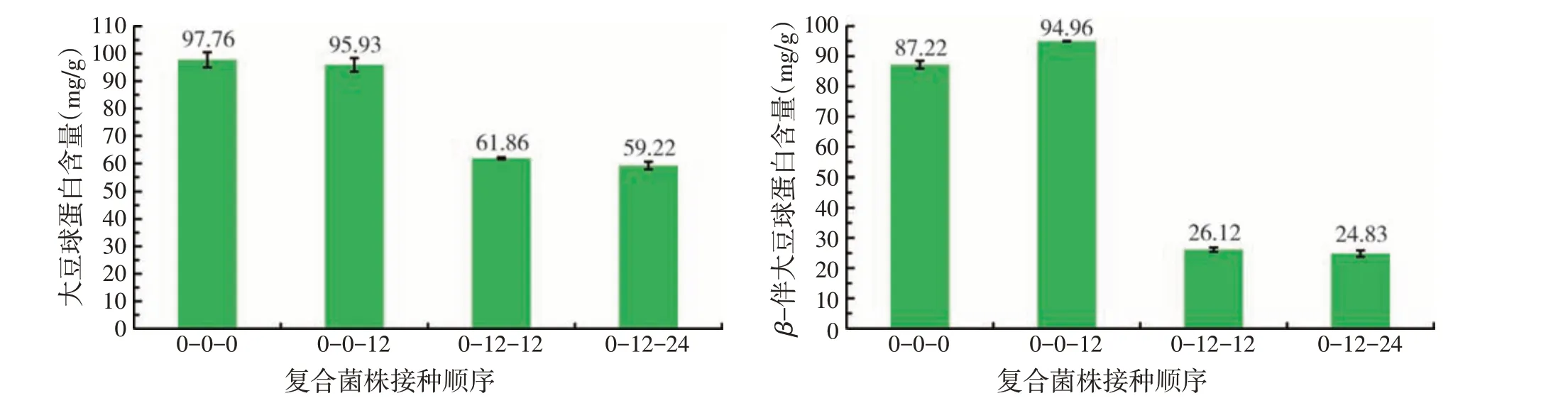
图2 不同接种顺序条件下发酵豆粕中大豆抗原蛋白含量
2.3 正交试验
2.3.1 正交试验极差分析
正交试验的极差结果如表5所示,从每个因素对应的极差值R的大小可以判断各个因素对试验指标影响程度,得到因素的主次影响顺序。极差值R越大,该因素对试验结果影响程度越大,该因素越重要。比较β-伴大豆球蛋白含量指标的极差值R的结果,可知B>D>C>A,因此因素B是主要因素,A是不重要因素。每个因素对应的k1、k2和k3表示该因素不同水平的平均值,优质的发酵豆粕中β-伴大豆球蛋白含量理应是少量的,因此试验结果中的k值最小,意味着该因素相应的水平是优水平。比较各因素的对应的k值,可知kA1
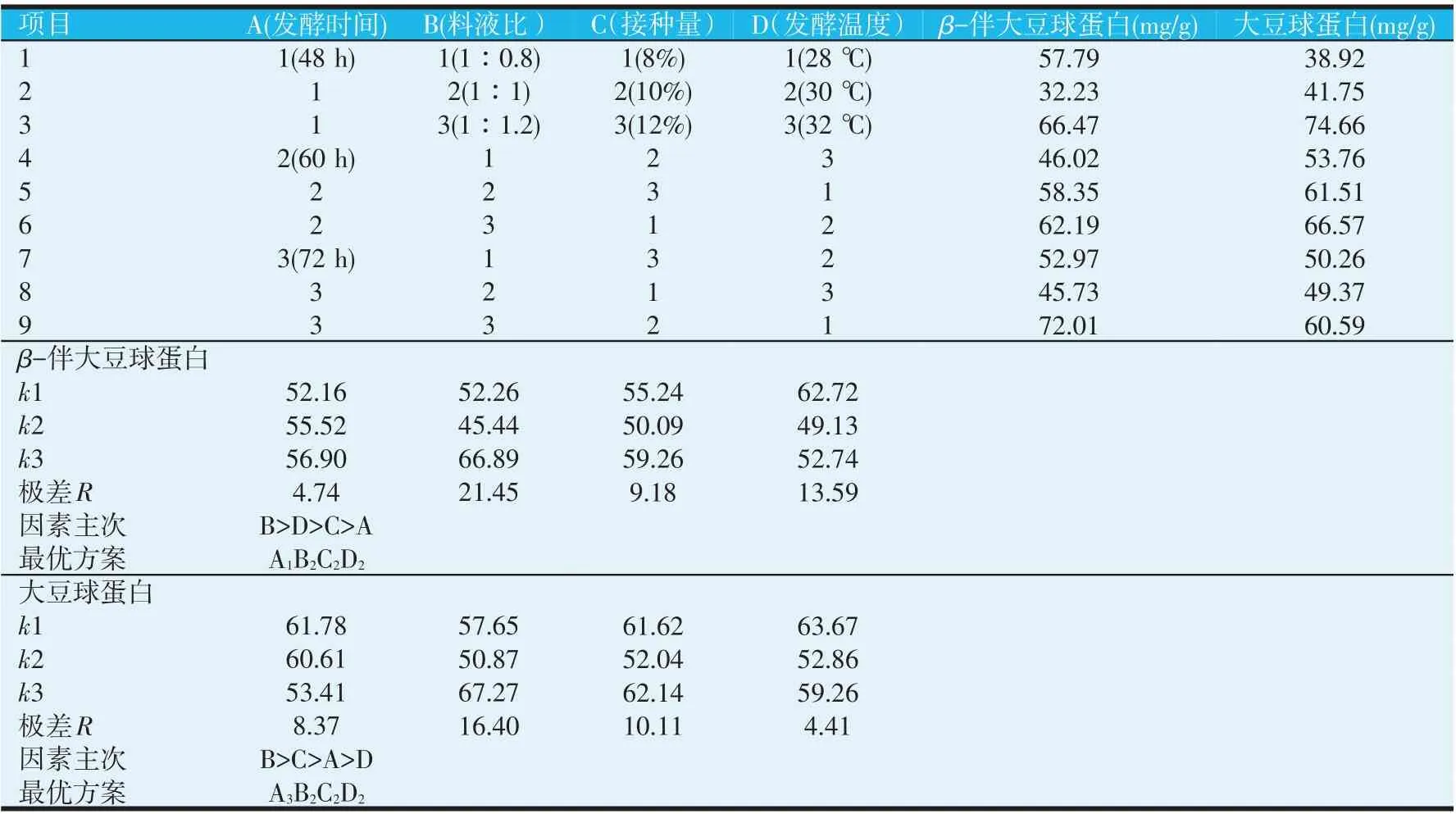
表5 正交试验结果
2.3.2 正交试验方差分析
正交试验结果的方差分析采用SPSS 22.0分析中的一般线性模型单变量分析。大豆球蛋白含量方差分析和β-伴大豆球蛋白含量方差分析结果如表6 和表7所示。R-sq能用回归平方和解释比例,一般认为R-sq 超过0.8 的模型拟合度比较高。同时对比表6、表7注中R-调整和R-sq的值,二者的值越接近,表示模型越优。本试验中大豆球蛋白和β-伴大豆球蛋白的含量指标下的R2数据均大于0.8,表明模型拟合度比较高。P值反映各因素对试验结果的显著性影响,从大豆球蛋白和β-伴大豆球蛋白的方差结果分析中,得到各因素均对试验结果有着显著性的影响。方差分析中的F值是效应项/误差项的比值,F值越大,说明处理之间差异越明显。由表6和表7可知,在大豆球蛋白和β-伴大豆球蛋白的方差分析中,B因素(料液比)中的F值最大,表明B因素对发酵豆粕抗原蛋白降解的影响程度最大,A因素(发酵时间)影响程度最小。

表6 大豆球蛋白含量方差分析
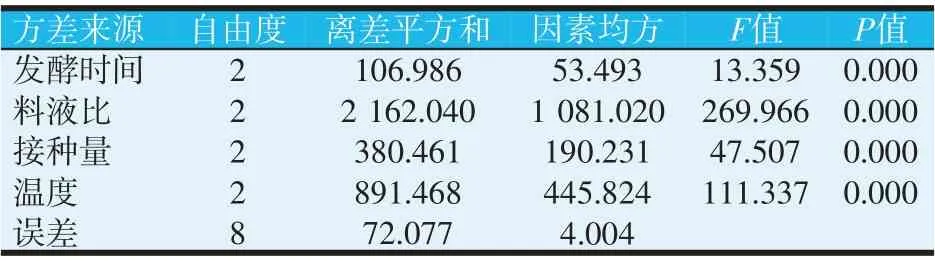
表7 β-伴大豆球蛋白含量方差分析
综合正交试验极差分析和方差分析结果得到,A1B2C2D2发酵条件对大豆抗原蛋白降解程度高,且结合生产中经济效益考虑,即发酵48 h,料液比1∶1,接种量10%,发酵温度30 ℃为复合菌最佳发酵条件。
3 讨论
发酵豆粕因具有抗营养因子少、小肽丰富及易于动物消化吸收等优点而被广泛应用于水产饲料。研究表明,不同菌株对发酵豆粕产品品质影响很大[12]。刘剑飞[13]试验发现,利用枯草芽孢杆菌NCU646 制作的发酵豆粕小肽占豆粕质量为15%,枯草芽孢杆菌NCU655发酵豆粕中小肽占比为6%,而未发酵豆粕小肽占比仅为2%。王腾浩等[14]研究发现,利用地衣芽孢杆菌和蜡样芽孢杆菌制作的发酵豆粕酸溶蛋白含量分别为12.98%和13.49%,而利用假丝酵母和粪肠球菌制作的发酵豆粕酸溶蛋白含量仅分别为3.57%和3.89%。此外,工艺参数对发酵豆粕产品的质量有很大的影响,如菌株比例、接种顺序、料液比、发酵时间、接种量和发酵温度等[15]。因此,本研究拟利用前期筛选的3株优秀功能微生物——短小芽孢杆菌SE5(分离自斜带石斑鱼肠道)、乳酸乳球菌17(分离自小丑鱼肠道)和酿酒酵母菌Sa(分离自酒曲),优化菌株配伍和发酵工艺,开发一种水产功能性发酵豆粕。
3.1 菌株比例对发酵效果的影响
复合菌发酵系统通常会优于单菌发酵系统,因为菌株之间多存在互惠共生关系[16]。本试验中当复合菌株短小芽孢杆菌、酿酒酵母和乳酸乳球菌的比例为2∶2∶1 时,发酵豆粕中大豆球蛋白含量最少,为86.30 mg/g,降解率达41.04%。Yuan 等[17]研究中,枯草芽孢杆菌、异常汉逊酵母和干酪乳杆菌的最佳比例为2∶1∶2,发酵后的大豆多肽的含量由2.16%提高到14.36%,同时胰蛋白酶抑制因子含量由35.34 mg/g降解到9.75 mg/g。程友飞[18]报道枯草芽孢杆菌、干酪乳杆菌和酵母菌混菌固态发酵豆粕过敏原蛋白被部分降解,致敏性随之降低。刘向敏等[19]研究发现当酵母菌和枯草芽孢杆菌比例为7∶3时,两菌达到了良好的共生关系,中性蛋白酶产率和淀粉酶产率得到提高。发酵过程实质上是由简单或复杂的微生物群落驱动的,显然,这些微生物不仅可以与底物相互作用,而且彼此间也能互相作用。微生物与微生物之间作用的机制是复杂的,复合菌接种发酵通常会产生优于单菌发酵效果[20],但也可能由于不同菌株间存在制约作用,发酵效果与单菌发酵效果无异甚至不如单菌发酵效果。
3.2 菌株接种顺序对发酵效果的影响
芽孢杆菌属于好氧型菌株,但能源物质耗损高;酵母菌属于兼性厌氧型菌株,能适应广泛的氧浓度区域;乳酸菌属于厌氧型菌株,但发酵周期长。因此,应当充分考虑微生物自身特性,分步接入不同菌株进行发酵。本试验结果表明,在发酵48 h 时间里,隔12 h分步接种短小芽孢杆菌SE5、酿酒酵母菌Sa和乳酸乳球菌17 发酵效果比同时接入3 株益生菌的发酵效果好,大豆抗原蛋白降解程度高,发酵后豆粕的大豆球蛋白含量和β-伴大豆球蛋白含量分别为59.22 mg/g,24.83 mg/g。这与其他学者的研究结果相似,石慧等[21]用好氧型枯草芽孢杆菌作为前发酵,兼性厌氧型酵母菌和厌氧型乳酸菌作为后发酵的分步发酵形式发酵生豆粕,抗原蛋白几乎完全降解。杨文宇等[22]在研究中将豆粕发酵分为两个阶段,前期发酵是以枯草芽孢杆菌和黑曲霉好氧发酵,后期发酵是以酿酒酵母及保加利亚乳酸杆菌厌氧发酵,以肽的转化率为指标评价发酵效果得到两步发酵优于一步发酵。
3.3 发酵工艺对发酵效果的影响
众多研究表明,料液比、发酵温度、发酵时间和接种量是影响发酵成败的重要因素。适宜的料液比能满足培养系统的气体流动,让微生物呈现良好的生长状态和最大程度发挥自身降解能力,水分偏高会导致基质透气性差,不利于散热和氧的传递,影响菌株的生长和繁殖[23]。分离于自然界的微生物,他们的最适生长温度一般会与其原本的生长环境相近[24],温度过高或过低都不利于微生物生长、繁殖和代谢[25]。在发酵生产上,发酵时间越长,发酵料被外界环境的腐败菌污染的风险越高,导致发酵豆粕氨基酸损失和腐败,散发较刺鼻氨氮味[26];但发酵时间太短,豆粕被发酵利用程度尚未达到预期的效果。合适的接种量有利于复合菌各菌株的生长繁殖,各酶系之间发挥最佳的协同作用,最大程度利用发酵基质[27]。当接种量过低,意味着并没有足够的生物量充分降解豆粕中的大分子物质;接种量过高,豆粕中的营养成分大部分被微生物生长利用,使得豆粕中营养成分减少,不利于提高经济效益。因此在预试验中,以大豆球蛋白和β-伴大豆球蛋白为指标,对以上4个因素进行了分析。结果显示最佳单因素水平是发酵时间48 h,发酵温度30 ℃,料液比1∶1,总接种量10%。朱平军[28]研究发现,在前48 h 用黑曲霉、枯草芽孢杆菌和酵母菌30 ℃好氧发酵,后48 h 用植物乳杆菌和瘤胃微生物37 ℃厌氧发酵,好氧发酵阶段料液比为1∶0.9,厌氧仿生发酵阶段料液比为1∶1.2,发酵后酸溶蛋白含量可达20.06%,粗蛋白含量可达52.03%。刘晓艳等[29]发现在料液比1∶1.2,接种量为25%,发酵温度为34 ℃,发酵时间为96 h 的条件下,最终发酵物中多肽得率达54.89%,发酵产物中大豆多肽产率最高,含量为21.47%。
正交试验是利用规格化的正交表,对多因素及因素的多个水平进行考察,因其简便高效在科学试验中得到广泛应用[30]。极差分析方法和方差分析方法可以对试验数据进行分析,且能验证结论可靠性[31]。正交试验在发酵工艺优化中被广泛应用。程友飞[18]使用正交设计优化了枯草芽孢杆菌、干酪乳杆菌和酵母菌混菌种固态发酵豆粕的工艺,杨柳等[32]利用单因素和正交试验优化饲用纳豆芽孢杆菌发酵豆粕工艺条件,吝常华等[33]以小肽含量为指标,对解淀粉芽孢杆菌单菌固态发酵豆粕以及解淀粉芽孢杆菌、植物乳杆菌和酿酒酵母菌3个菌种混菌固态发酵豆粕的工艺条件进行优化。本试验以大豆球蛋白和β-伴大豆球蛋白含量为试验指标,依据单因素试验的结果,使用Minitab软件设计四因素三水平的正交试验。结果表明:短小芽孢杆菌SE5∶酿酒酵母菌Sa∶乳酸乳球菌17 的配伍比例为2∶2∶1;发酵初始接入短小芽孢杆菌SE5,发酵12 h后接入酿酒酵母菌,发酵24 h后接入乳酸乳球菌17的分步接种顺序进行发酵,最优的发酵条件是发酵温度30 ℃,总接种量为10%,料液比为1∶1,发酵时间是48 h,此工艺下的发酵豆粕大豆球蛋白和β-伴大豆球蛋白含量分别下降到41.75 mg/g 和32.23 mg/g。接下来,我们还将对发酵豆粕的营养成分进行分析,并通过饲养试验评价发酵豆粕在水产动物上的应用效果。
4 结论
短小芽孢杆菌SE5∶酿酒酵母菌Sa∶乳酸乳球菌17的配伍比例为2∶2∶1;发酵初始接入短小芽孢杆菌SE5,发酵12 h后接入酿酒酵母菌,发酵24 h后接入乳酸乳球菌17的分步接种顺序进行发酵,最佳发酵条件是:发酵温度30 ℃,总接种量10%,料液比1∶1,发酵时间为48 h。获得的发酵豆粕大豆球蛋白和β-伴大豆球蛋白含量分别为41.75 mg/g 和32.23 mg/g,降解率分别为71.48%和73.29%。
