2型糖尿病患者血清GLP-1和lGF-1与周围神经病变的相关性分析
2022-02-26罗贤王华贺五风刘晓慧曾菊丽上海市东方医院吉安医院江西吉安343000上海市东方医院上海20020
罗贤,王华,2,贺五风,刘晓慧,曾菊丽(.上海市东方医院吉安医院,江西 吉安 343000;2.上海市东方医院,上海 20020)
糖尿病周围神经病变是糖尿病主要的慢性并发症之一,影响着糖尿病患者生存质量及生命安危。其发病率高,目前尚无有效的治疗方法。近年来的研究表明,胰高血糖素样肽-1(glucagon-like peptide-1,GLP-l)受体激动剂在神经系统中作
用广泛并成为研究热点,主要包括加快神经传导速度、增加神经轴突的数量、为神经细胞直接提供营养因子、抑制神经细胞凋亡、拮抗氧化应激等作用[1],但具体机制尚不清楚。胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)是一种重要的神经营养因子,其与糖尿病周围神经病变亦有着密切的联系[2]。在糖尿病患者尤其是糖尿病神经病变患者中,血清肠促胰素与IGF-1的相关研究目前报道较少。基于此,本研究将选择伴/不伴周围神经病变的2型糖尿病患者为研究对象,观察两组患者的MNSI问卷评分与神经传导等神经损伤的指标,观察这些指标与血清GLP-1以及神经营养因子如IGF-1、胰岛素样生长因子结合蛋白3(nsulin like growth factor binding protein 3,IGF-BP3)的表达水平是否有关。
1 资料与方法
1.1 一般资料 选取2020年1-6月上海市东方医院吉安医院收治的43例2型糖尿病患者。其中男性26例,女性17例,平均年龄(52.3±11.5)岁。试验程序符合赫尔辛基宣言并经上海市东方医院吉安医院伦理委员会同意,所有入选对象均签署知情同意书。所有入选者询问相关病史和完善体格检查如体重指数(body mass index,BMI)、糖尿病病程、空腹葡萄糖(fasting blood glucose,FBG)、糖化血红蛋白(glycosylated hemoglobin,HbA1c)、空腹胰岛素(fasting insulin)、空腹C肽(fasting C-peptide)、收缩压(systolic blood pressure,SBP)和舒张压(diastolic blood pressure,DBP)等。
1.2 纳入和排除标准
1.2.1 入选标准 ①确诊2型糖尿病患者(WHO标准,1999);18≤年龄≤70岁,男性或女性。②入选时,糖化血红蛋白(HbA1c)≤10%。③有临床症状(疼痛、麻木、感觉异常等)者,5项检查(踝反射、针刺痛觉、震动觉、压力觉、温度觉)中任1项异常;无临床症状者,5项检查中任2项异常,临床诊断为糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)[3]。④收缩压<160mmHg,舒张压<95mmHg;使用降压药者,降压药物保持不变且剂量稳定至少一个月。⑤入选者对药物治疗有良好的依从性。
1.2.2 病例排除标准 ①HbA1c>10%者;②糖尿病足;③DPPIV抑制剂、GLP-1类药物使用者;④糖尿病急性并发症如酮症酸中毒的患者,非糖尿病性神经病变,非糖尿病末梢血管疾病;⑤明显的神经系统疾病(帕金森病、癫痫、多发生硬化);⑥近三个月内参与其他临床药物研究;⑦恶性肿瘤;脏器功能不全,如明显的心功能不全(按纽约心脏学会标准分级为2级或3级)或肾功能不全[Cr>正常值上限(以各自单位正常值为准)]或肝功能不全肝功能各项指标>正常值上限的1.5倍以上;⑧有精神、智力异常,或不能理解试验或不合作;⑨孕妇、哺乳期妇女及没有避孕措施的育龄期妇女;⑩酗酒或药物滥用;11研究者认为无法安全完成试验或无法安全给药的任何临床情况。
1.2.3 退出标准 有下列情况之一者应退出本研究:①使用研究药物时出现过敏反应或其他严重不良反应及不能耐受者。②依从性差,不能按要求治疗、检查及随访者。
1.2.4 密歇根神经病变评分和肌电图 观察指标:①所有受试者按照参考文献[4]接受密歇根神经病变筛查表MNSI筛查,包括问卷(15个问题,满分13分)和体检(包含4项,满分8分)。主要评估患者的病情程度,分值越大表明病情越严重。②使用全功能诱发电位仪检测患者正中神经、胫神经及腓肠神经的感觉神经传导速度(SCV)和运动神经传导速度(MCV),SCV和MCV数值越大说明传导速度越快,病变程度越轻。
1.3 ELISA测定血清胰高血糖素样肽-1的表达 所有患者于空腹静脉取血2ml,置于预先加入DPP-4抑制剂(DPP4-010)(10μl/ml血液,Millipore,USA)的EDTA抗凝管,检测血清GLP-1、IGF-1、IGF-1BP3水平。肠促胰素GLP-1[EGLP-35K ELISA Kit,Glucagon ELISA Kit,Human GIP(total)ELISA Kit,Millipore,USA],批内差异<10%,批间差异<15%。
1.4 统计学方法 使用SPSS22.0软件进行数据分析。计量资料以均数标准差表示,采用独立样本t检验、单因素方差分析,计数资料比较采用χ2检验,多因素分析采用相关分析。统计学显著性水平α=0.05(双侧检验)。
2 结果
2.1 两组患者的一般临床资料情况 与DM组比较,DPN组的年龄、糖尿病病程、MNSI问卷得分、MNSI体检得分、GLP-1、IGF-1的差异有统计学意义,而其他的临床相关指标在两组间差异无统计学意义。见表1。
表1 两组患者的一般资料的比较(±s)

表1 两组患者的一般资料的比较(±s)
组别 性别(M/F)年龄(岁) DM病程(年) BMI(kg/m2) Glu(mmol/L) Ins(uUI/ml) C肽(ng/dl) HbA1c(%)DM组 10/7 46.4±9.6 1.1±0.3 24.7±5.1 11.3±3.9 13.8±9.8 2.1±0.9 8.7±1.3 DPN组 16/10 56.1±11.2 1.9±0.3 25.8±4.0 9.9±3.4 18.4±15 2.2±0.9 8.4±1.4 P-Value 0.554 0.006 0.000 0.438 0.241 0.310 0.854 0.482

续表1
2.2 两组患者肌电图/诱发电位报告数值的比较 与DM组比较,DPN组的腓总神经MCV的神经传导速度和诱发电位波幅的差异有统计学意义;右侧胫神经MCV、左侧腓浅神经SCV的神经传导速度在两组间差异有统计学意义;左侧腓浅神经SCV的诱发电位波幅在两组间差异有统计学意义;而肌电图/诱发电位报告中潜伏期各指标在两组间差异均无统计学意义。见表2-表4。
表2 两组患者肌电图/诱发电位报告中神经传导速度的比较(±s,m/s)
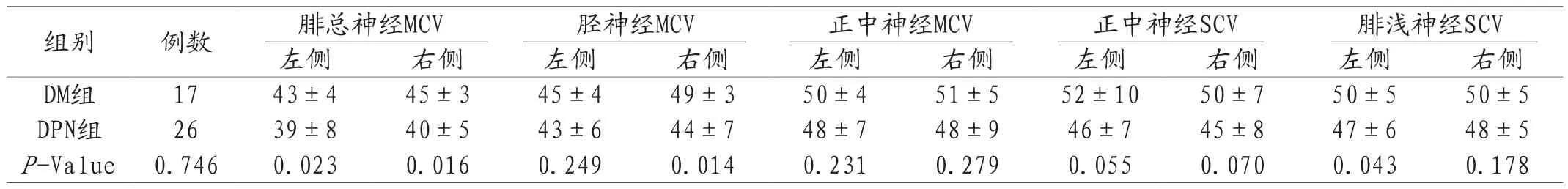
表2 两组患者肌电图/诱发电位报告中神经传导速度的比较(±s,m/s)
注:MCV:运动神经传导速度;SCV:感觉神经传导速度;P<0.05表示差异有统计学意义。
组别 例数 腓总神经MCV 胫神经MCV 正中神经MCV 正中神经SCV 腓浅神经SCV左侧 右侧 左侧 右侧 左侧 右侧 左侧 右侧 左侧 右侧DM组 17 43±4 45±3 45±4 49±3 50±4 51±5 52±10 50±7 50±5 50±5 DPN组 26 39±8 40±5 43±6 44±7 48±7 48±9 46±7 45±8 47±6 48±5 P-Value 0.746 0.023 0.016 0.249 0.014 0.231 0.279 0.055 0.070 0.043 0.178
表3 两组患者肌电图/诱发电位报告中潜伏期的比较(±s,ms)

表3 两组患者肌电图/诱发电位报告中潜伏期的比较(±s,ms)
组别 例数 腓总神经MCV 胫神经MCV 正中神经MCV 正中神经SCV 腓浅神经SCV左侧 右侧 左侧 右侧 左侧 右侧 左侧 右侧 左侧 右侧DM组 17 3.6±0.5 3.7±0.5 4.5±0.8 4.4±1.0 2.8±0.9 2.7±0.7 2.6±1.0 2.6±0.9 3.5±0.6 3.6±0.5 DPN组 26 4.4±1.6 4.2±1.4 5.0±1.0 4.9±1.2 3.2±1.0 3.1±0.8 3.0±1.0 3.0±0.8 3.7±0.6 3.8±0.8 P-Value 0.746 0.053 0.175 0.157 0.180 0.321 0.084 0.215 0.135 0.306 0.383
表4 两组患者肌电图/诱发电位报告中诱发电位波幅的比较(±s,mv/uv)

表4 两组患者肌电图/诱发电位报告中诱发电位波幅的比较(±s,mv/uv)
注:MCV:运动神经传导速度;SCV:感觉神经传导速度;P<0.05表示差异有统计学意义。
组别 例数 腓总神经MCV 胫神经MCV 正中神经MCV 正中神经SCV 腓浅神经SCV左侧 右侧 左侧 右侧 左侧 右侧 左侧 右侧 左侧 右侧DM组 17 5.3±2.4 4.6±2.0 7.2±2.6 8.6±2.4 11±2.2 11±3.1 36±21 29±14 9.4±2.8 8.6±3.0 DPN组 26 3.6±1.9 3.3±1.6 6.4±2.7 7.7±2.5 10±2.5 10±2.7 32±14 27±11 6.4±3.0 6.7±3.6 P-Value 0.746 0.016 0.024 0.395 0.288 0.189 0.373 0.483 0.613 0.003 0.090
2.3 Spearman秩相关分析GLP-1表达水平与观察的指标之间的相关性 见表5。

表5 与GLP-1表达水平有相关性的指标分析结果
3 讨论
糖尿病神经病变与长期的高血糖及由此导致的糖基化终末产物增加、微循环改变、神经营养因子异常、氧化应激和自身免疫紊乱等相关因素有关[5-6],但具体发病机制尚不清楚。本实验通过研究两组患者的MNSI问卷得分与神经传导等指标,观察血清GLP-1及神经营养因子如IGF-1、IGFBP-3的表达水平是否与糖尿病神经病变有关。
本研究结果显示,DPN患者空腹血清GLP-1水平为(10.3±2.8)pmol/L,较DM组的水平下降。GLP-1是最早发现的胰升血糖素样肽-1受体(GLP-1R)激动剂,多项研究包括临床研究[7]、动物实验[8]和细胞实验[9]表明GLP-1及其受体对神经系统具有保护作用,机制主要为GLP-1对神经元具有促增殖和抗凋亡作用。Perry[10]等进一步在动物模型中发现GLP-1能减轻前脑胆碱能神经元的免疫反应而减少胆碱乙酰转移酶的消耗,因此有望应用于神经退行性疾病,例如Alzheimer症或糖尿病性神经病变等。Himeno[11]等研究结果提示可能是通过GLP-1直接作用于背根节神经元及其轴突的受体,促进背根节神经元轴突生长,改善神经轴突受损。亦有研究[12]没有发现GLP-1受体激动剂对DPN患者有太大的益处,这可能与病例数量较少及治疗时间太短有关。尽管如此,GLP-1RA在糖尿病动物模型中对中枢和外周神经系统均能发挥良好的神经保护作用,显示了良好的临床应用前景。
本研究结果显示,DPN组患者游离IGF-1水平减少,IGF-1/IGFBP-3的比例明显下降,提示IGF-1与糖尿病周围神经损害密切相关。IGF-1作为一种神经营养因子,既支持感觉神经元修复再生又支持运动神经修复再生。有报道称,伴有DPN的糖尿病患者血清中IGF-1及IGF-1受体水平较不伴有DPN的患者及非糖尿病患者显著降低,患者的神经功能缺损评分与血中IGF-1水平呈负相关[13]。研究表明,重组人胰岛素样生长因子1(recombinant insulin-like growth factor-1,rIGF-1)可以改善STZ大鼠模型中的痛觉过敏[14]。循环中仅小部分游离的IGF具有生物学作用,其余的大部分IGF和IGFBP结合[15-17]。在血液及组织液中以IGFBP3含量最高,循环中约80%以上的IGF与IGFBP3结合而成150kDa的三分子复合体。因此从理论上分析,可以通过观察IGF-1/IGFBP3之间的水平变化估计IGF-1活性的改变。
本研究结果采用Spearman秩相关分析表明,空腹GLP-1表达水平与IGF-1(r=0.381,P=0.012)、糖化血红蛋白(r=0.350,P=0.021)、MNSI体检得分(r=-0.467,P=0.002)、腓总神经MCV神经传导速度(左r=0.343,P=0.030;右r=0.361,P=0.019)、正中神经SCV神经传导速度(左r=0.369,P=0.021;右r=0.418,P=0.008)、右侧腓浅神经SCV诱发电位波幅(r=0.377,P=0.018)、右侧正中神经MCV诱发电位波幅(r=0.396,P=0.009)、左侧正中神经SCV诱发电位波幅(r=0.350,P=0.023)呈正相关。与左侧正中神经MCV潜伏期(r=-0.333,P=0.031)、正中神经SCV潜伏期(左r=-0.371,P=0.020;右r=-0.337,P=0.036)呈负相关。这些均提示空腹GLP-1水平与糖尿病周围神经损害程度密切相关。
综上所述,本研究以糖尿病患者为研究对象,观察GLP-1及神经营养因子IGF-1的表达与糖尿病周围神经病变的关系。与未合并周围神经病变糖尿病患者相比较,糖尿病神经病变患者空腹血清GLP-1和IGF-1的水平降低,GLP-1、IGF-1的下降水平与糖尿病患者外周神经损伤程度呈负相关。这可能为预测糖尿病神经病变患者的病情发展和临床预后提供循证医学的证据。
