陆地棉GhPKE1的生物信息学分析及功能验证
2022-02-26王琴琴陈修贵陆许可王帅张悦新范亚朋陈全家叶武威
王琴琴, 陈修贵, 陆许可, 王帅, 张悦新,范亚朋, 陈全家, 叶武威*
(1.新疆农业大学农学院,教育部棉花工程研究中心,乌鲁木齐 830052;2.中国农业科学院棉花研究所,棉花生物学国家重点实验室,河南 安阳 455000)
土壤盐渍化和重金属毒性已成为作物可持续生产的主要威胁[1]。在众多农作物中,棉花是开发和利用盐渍化土地的理想作物之一[2],也是适合种植在工业污染地区的作物之一[3],但是棉花中与重金属胁迫相关基因的研究较少。
Fe、Cu、Zn、Co、Mn、Mo、Ni是植物生长所必需的微量元素,过量则具有毒性;而一些重金属元素,如Ag+、Cd2+、Pb2+、Hg2+等,即使在低剂量下也具有高度毒性[4-5]。重金属不仅对植物生长具有显著影响,而且对土壤微生物群落的结构和功能也具有显著影响[6]。重金属相关结构域(heavy metal-associated domain,HMAD)在植物重金属响应中起着重要作用。植物和微生物对重金属胁迫响应的信号网络主要包括钙信号通路、激素信号网络、丝裂原活化蛋白激酶信号(mitogenactivated protein kinase,MAPK)和过氧化物信号网络,其中以离子解毒和转运为主[7-8]。金属螯合物在离子解毒和转运过程中起重要作用[7-8],其主要包括植物螯合素(phytochelatin synthase,PCs)和金属硫蛋白(metallothioneins,MTs),MTs通过清除活性氧和螯合作用保护植物免受重金属的侵害,甚至对冷、热、盐、干旱等非生物胁迫抗性也具有重要作用[9-10]。与金属螯合物相比,重金属离子转运家族包括p型ATP酶和阳离子转运载体,例如,重金属腺苷三磷酸酶(heavy metal association,HMA)、ABC膜转运蛋白、自然抗性相关巨噬细胞蛋 白(naturalresistance-associated macrophage protein,NRAMP)、阳离子扩散促进子家族蛋白(cation diffusion facilitator family,CDF)、黄色条纹转运蛋白(yellow stripe-like YSL transporter)、锌铁调控蛋白(ZRT,IRT-like protein,ZIP)、阳离子交换剂(cation-exchanger,CAX)、铜转运蛋白(copper transporter,CTR)、多向耐药性蛋白(pleiotropic drug resistance,PDR)、金 属 响 应 转 录 因 子(metallic responsive transcription factors,MTF-1)[11-12]。对于重金属腺苷三磷酸酶超富集因子,液泡区隔化和重金属离子长距离易位依赖于p型离子泵(ATPases)和一组液泡质体转运蛋白在重金属稳态中发挥重要作用[13]。
Li等[14]从 野 生 番 茄(Solanum pennellii,LA0716)中分离到一个富含脯氨酸、赖氨酸和谷氨酸的基因SpPKE1,研究表明,PKE1具有脯氨酸、赖氨酸和谷氨酸的某些特征,而富含脯氨酸和富含赖氨酸的蛋白在非生物胁迫中发挥重要作用[15-16],由此推测PKE1可能参与植物的非生物胁迫响应[14]。因此,本研究从陆地棉中9835克隆了GhPKE1,对其展开生物信息学分析,并进一步构建pYL156:GhPKE1沉默载体,对其在棉花中的功能进行验证,为进一步研究棉花的抗逆机制奠定基础。
1 材料与方法
1.1 供试材料
1.1.1 种质材料 以陆地棉中9835为供试材料,由中国农业科学院棉花研究所抗逆鉴定实验室提供。
1.1.2 菌种和质粒 大肠杆菌(E.coli)DH5α和农杆菌(LB4404、GV3101)均购于上海唯地生物技术有限公司,pYL156、pYL192(辅助载体)和阳性对照PDS(phytoene desaturase)、pBI121载体等均由中国农业科学院棉花研究所抗逆鉴定实验室提供。
1.1.3 主要试剂和引物 棉花总RNA提取试剂盒购于北京天根生化科技有限公司;用于基因克隆和定量分析的反转录试剂盒、荧光定量试剂盒购于北京全式金生物技术有限公司;基因克隆高保真酶、基因克隆试剂盒、普通PCR酶均购自诺维赞生物公司;琼脂糖凝胶回收试剂盒购于上海创赛科技有限公司;限制性内切酶购于NEB有限公司;质粒提取试剂盒购自北京天根生化科技有限公司;所用CaCl2、亚精胺、MS盐、培养基、卡那霉素、利福平等实验用品均购于北京Solarbio有限公司;其他常规试剂都为国产分析纯。引物合成和基因测序均由上海生工生物工程有限公司完成。
1.1.4 仪器设备 试验仪器主要包括人工培养箱、PCR仪、电泳仪、全自动凝胶成像系统、Nanodrop2000、水浴锅、纯水/超纯水仪、制冰机、白光紫外照胶仪、超净工作台、紫外分光光度仪、恒温摇床、−20/−80℃低温冰箱、常温离心机、冷冻离心机、Bio-Rad CFX96实时荧光定量PCR仪、高压灭菌锅、烘箱、移液枪等。
1.2 试验方法
1.2.1 试验材料处理方法 将中9835种子进行浓硫酸脱绒后。挑选颗粒饱满的种子,依次用20%~30%双氧水浸泡3 h消毒灭菌,再用蒸馏水反复清洗6次(每次1 min),最后用无菌水浸种催芽12 h。将露白的种子播种于灭过菌的沙土,在人工培养箱培育至三叶期移到300 mmol·L−1Na2SO4溶液中胁迫处理12 h,分别取棉花的根、茎和叶组织各3份,同时取其第2片真叶放入液氮中速冻,置于−80℃保存备用。
1.2.2 试验菌液准备 分别将试验用到的4种菌液(pYL156:GhPKE1、pYL156、pYL192和PDS)活化12h,进行扩摇,培养基为高温灭菌的液体LB培养基(50℃,加卡那霉素和利福平),摇床中培养(28℃,黑暗培养),培养时长为16h左右,OD值(600 nm)达到1.5左右,5 580 r·min−1离心20 min,收集菌体。加入等体积已配制好的无菌重悬液(MES 10 mmol·L−1,AS 200 µmol·L−1,MgCl210 mmol·L−1,pH 5.6)震荡,重悬菌体,保证没有菌块存在,将菌液室温避光静置4 h,准备侵染。
1.2.3 qRT-PCR 实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)采用TransStart Top Green qPCR SuperMix荧光定量试剂盒。每个反应包含100 ng cDNA,上下游引物各0.4µL,SuperMix 10µL,加水至20µL。扩增程序:95℃ 5 min;95℃ 15 s,58℃20 s,72℃30 s,40个循环。3个生物学重复,3个技术重复,内参基因为GhHistone3。
1.2.4GhPKE1的克隆 用Premier 5软件设计GhPKE1引物(表1),以cDNA为模板进行扩增,PCR扩增程序:95℃ 3 min;95℃ 15 s,56℃ 15 s,72℃ 50 s,35个循环;72℃ 5 min;4℃保存。PCR产物经1.2%的琼脂糖凝胶电泳检测后回收和纯化。采用一步克隆法将连接载体进行线性化处理后与PCR纯化产物混合,将纯化后的PCR产物连接至pBI121载体。然后将一步克隆产物转入E.coliDH5α,试验步骤参照试剂盒使用说明书。最后进行蓝白斑筛选挑取阳性克隆进行测序,获取正确的克隆载体GhPKE1-t,置于−20℃保存。
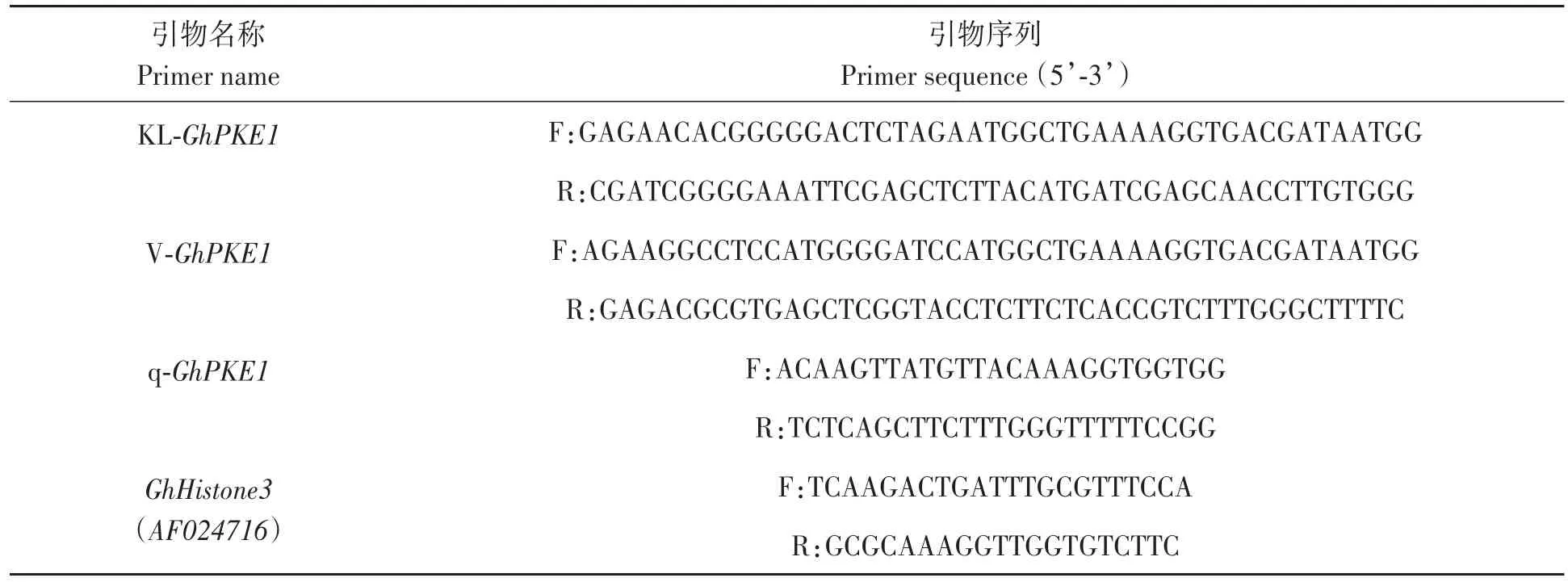
表1 GhPKE1的引物序列Table 1 Primer sequence of GhPKE1
1.2.5 构建pYL156:GhPKE1的VIGS载体 选择KpnⅠ和BamHⅠ作为pYL156的酶切位点,获得线性pYL156载体,双酶切线性化载体反应体系总体积 30 µL:10×Tango Buffer 5 µL、载体质粒pYL156 10µL、KpnⅠ 1µL、BamHⅠ 1µL、ddH2O 13µL。37℃水浴过夜。采用一步克隆法,将线性化处理后的载体与PCR纯化产物混合构建pYL156:GhPKE1载体,一步克隆反应体系总体积10µL,包含双酶切线性化载体pYL156 3 µL、5×CE Ⅱ Buffer 2µL、PCR纯化产物 4µL、ExnaseⅡ1µL。37℃水浴30 min。然后将一步克隆产物转入E.coliDH5α,转化步骤按照 pEASY-Blunt Clonging Kit使用说明书。最后进行蓝白斑筛选挑取阳性克隆,于LB液体培养基(含50 mg·L−1卡那 霉 素)200 r·min−1、37 ℃ 培 养 6 h,再 用V-GhPKE1上下游引物进行PCR扩增验证后,将阳性菌液送至生工生物工程股份有限公司进行测序。对测序结果正确的菌液用TianGen的HiPure BAC DNA小量提取试剂盒提取质粒转入农杆菌。
1.3 VIGS侵染棉花及目的基因表达量检测
采用1.2.1的方法育苗,待中9835植株两片子叶平展时,用一次性的医用5 mL注射器吸取事先准备好的菌液,在叶片背面进行注射,当菌液面积达叶片总面积85%时停止注射。然后将植株置于25℃黑暗培养24 h后,在适宜的温度(光照26℃16 h;黑暗24℃8 h)下继续培养以保证幼苗正常生长。当注射了PDS(PDS转化植株叶片变白,说明试验系统构建成功)的植株叶片出现白化后,再对VIGS侵染植株和未侵染植株分别进行Na2SO4和CdCl2胁迫处理,当VIGS侵染的植株出现变化时,采用1.2.1的取样方法进行取样,通过qRT-PCR测定GhPKE1的相对表达量。
2 结果与分析
2.1 GhPKE1蛋白的理化性质
GhPKE1基因全长1 048 bp,编码区753 bp,该基因存在2个内含子。通过ExPASY网站(https://web.expasy.org/protparam/)的 ProtParam 程序对GhPKE1编码的蛋白进行分析,该基因编码蛋白质分子式为C1224H1939N321O369S15,共计3 868个原子,相对分子质量27.54 kD,等电点9.3;编码250个氨基酸,其中50个带正电的氨基酸(Arg+Lys),37个带负电的氨基酸(Asp+Glu),不稳定系数为35.56,脂肪系数为41.84,总平均亲水性为−1.114;预测该蛋白为碱性蛋白,不含有吡咯赖氨酸、硒半胱氨酸和组氨酸,色氨酸含量最低,为0.4%,赖氨酸含量最高,为18.0%,其次是脯氨酸12.8%和谷氨酸11.6%。
2.2 GhPKE1蛋白质的亲水性//疏水性
利用ProtScale网站(https://web.expasy.org/protscale/)对GhPKE1蛋白的亲疏水性进行预测,结果(图1)表明,亲水性总平均值为−1.60,其中85位的K,88位和151位的D,98位、108位、119位、129位、139位的E,亲水性最强,分值均为−3.256;48位的T疏水性最强,分值为2.222。整体来看,该蛋白中亲水性氨基酸多于疏水性氨基酸,因此该蛋白为亲水性蛋白,具有一定的亲水能力。
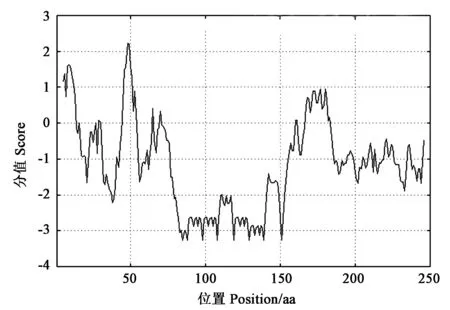
图1 GhPKE1蛋白的疏水性/亲水性Fig.1 Hydrophilicity/hydrophilicity analysis of GhPKE1protein
2.3 GhPKE1蛋白的亚细胞定位与跨膜分析
通 过 WOLF PSORT 网站(https://wolfpsort.hgc.jp/)对GhPKE1蛋白亚细胞定位进行预测,该蛋白在植物细胞细胞核的可能性最大。通过TMHMM网 站(http://www.cbs.dtu.dk/services/TMHMM/)对GhPKE1蛋白的跨膜结构域进行分析(图2A)表明,该蛋白不存在跨膜结构域,属于非跨膜蛋白,与其疏水性区域分析结果相一致。利用SignalP-4.0网站对GhPKE1蛋白的信号肽进行预测(图2B),结果表明,C值(剪切位点)为0.118,S值(信号肽)为0.171,Y值(综合剪切点)为0.131。综上所述,GhPKE1蛋白不是分泌型蛋白,不能在细胞中发生迁移。
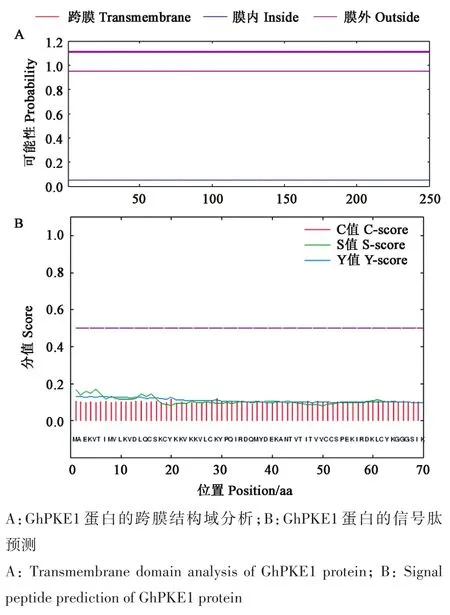
图2 GhPKE1蛋白的跨膜结构域分析和信号肽预测Fig.2 Prediction of transmembrane domain and signal peptide in GhPKE1 protein
2.4 GhPKE1蛋白的二级结构分析
通过SOPMA网站(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl? page=npsa_sopma.html)对GhPKE1蛋白的二级结构进行预测,结果(图3A)表明,无规则卷曲包含135个氨基酸,占54.00%;α螺旋包含48个氨基酸,占19.20%;β-转角包含19个氨基酸,占7.60%;延伸链包含48个氨基酸,占19.20%。通过GlobPlot 2.3网站(http://globplot.embl.de/)对 GhPKE1蛋白序列中的紊乱区、球蛋白区进行预测,结果(图3B)显示,该蛋白存在3个不稳定区,分别位于78~95、123~139和184~247氨基酸位置,在1~77位处形成一个较大的潜在球形蛋白区。以上结果与在PSIPRED 网站(http://bioinf.cs.ucl.ac.uk/psipred/)预测的GhPKE1蛋白二级结构(图3C)相一致。
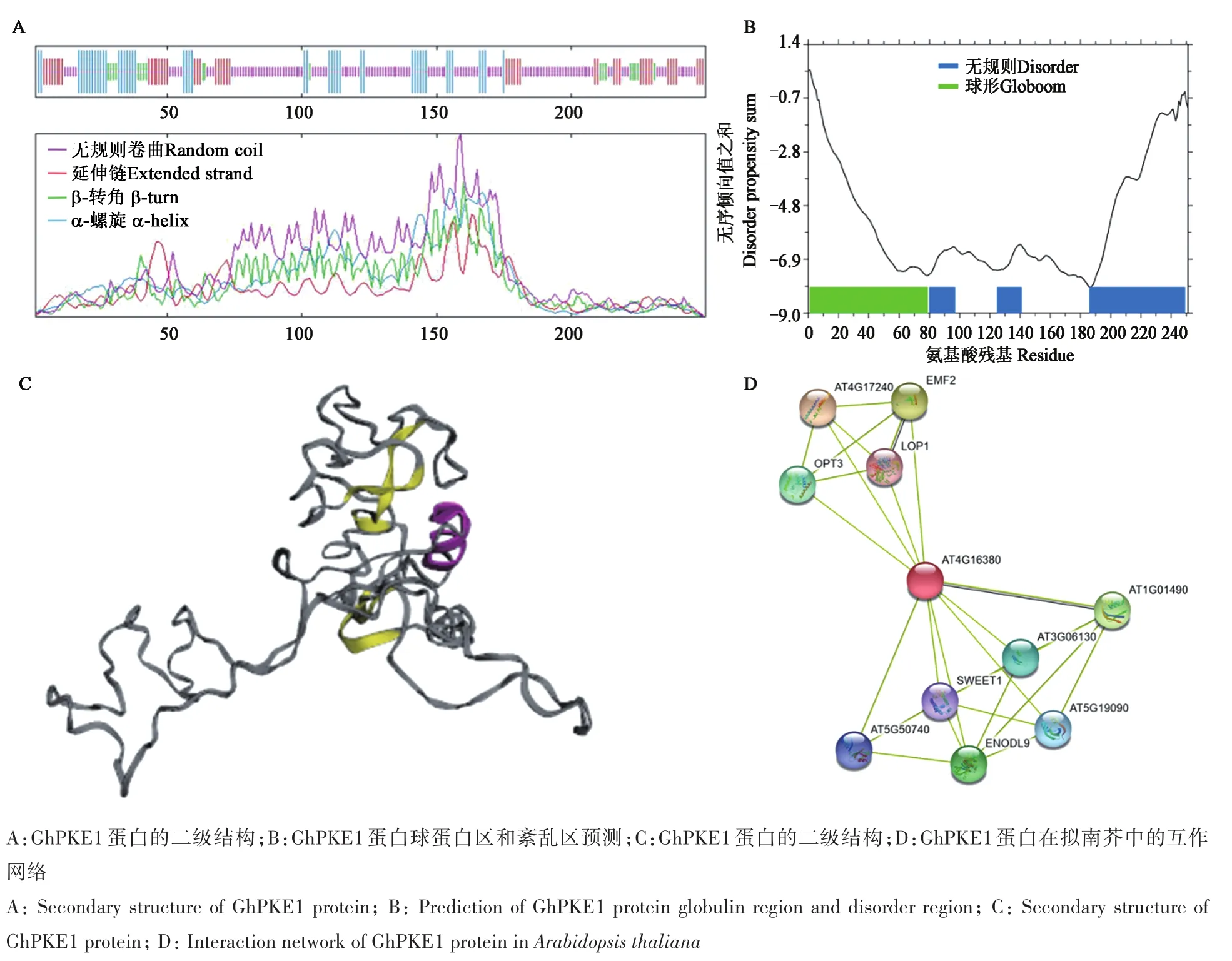
图3 GhPKE1生物信息学分析Fig.3 GhPKE1 bioinformatics analysis
2.5 GhPKE1蛋白的互作网络分析
通 过 InterPro(http://www.ebi.ac.uk/interpro/)网 站 和 STRING 网 站(https://string-db.org)对PKE1蛋白互作网络预测分析发现(图3D),含有HMAD功能结构域的GhPKE1蛋白(IPR006121)与拟南芥中AT4G16380相似度高达69.8%,与10个蛋白之间存在互作。
2.6 GhPKE1蛋白的作用位点分析
通过NetPhos3.1 Server网站(http://www.cbs.dtu.dk/services/NetPhos/)对 GhPKE1 蛋白进行磷酸化位点分析(图4A),发现有15个位点磷酸化;结合 PROSITE(https://prosite.expasy.org/)分析表明,GhPKE1中LYS_RICH结构域(18~154 aa)中含有1个磷酸化位点。对所预测的15个磷酸化位点进一步地分析鉴定(图4B),推测GhPKE1蛋白有4个重要位点,分别是56~63位的酪氨酸激酶磷酸化位点(tyrosine kinase phosphorylation site)、68~70位的蛋白激酶C磷酸化位点(protein kinase C phosphorylation site)、183~186位的酪蛋白激酶2磷酸化位点(Casein kinaseⅡphosphorylation site)和C端247~250位的 Prenyl group结合位点(CAAX box)。
2.7 VIGS侵染后棉花的表型和GhPKE1的表达量分析
根据生物信息学分析结果,针对GhPKE1的N端设计VIGS引物,以没有进行VIGS侵染的棉苗作为对照(CK),当侵染了PDS植株在三叶期叶片出现白化后,再对 CK、pYL156和 pYL156:GhPKE1侵染的植株分别进行Na2SO4和CdCl2胁迫处理。用 300 mmol·L−1的 Na2SO4处理 12 h 后(图5A),pYL156:GhPKE1侵染植株茎秆弯曲、真叶明显萎蔫,而CK和pYL156侵染植株仅真叶轻微萎蔫。用 20 mmol·L−1的 CdCl2溶液处理 VIGS植株12 h后(图5B),与CK和pYL156侵染植株相比,pYL156:GhPKE1侵染植株的真叶变为褐色且严重萎蔫,子叶枯萎凋落,茎部变为褐色。检测VIGS侵染植株中GhPKE1的相对表达量,结果(图5C和5D)表明,用pYL156:GhPKE1侵染过的植株中GhPKE1转录水平与CK组相比,叶片中表达量显著降低。
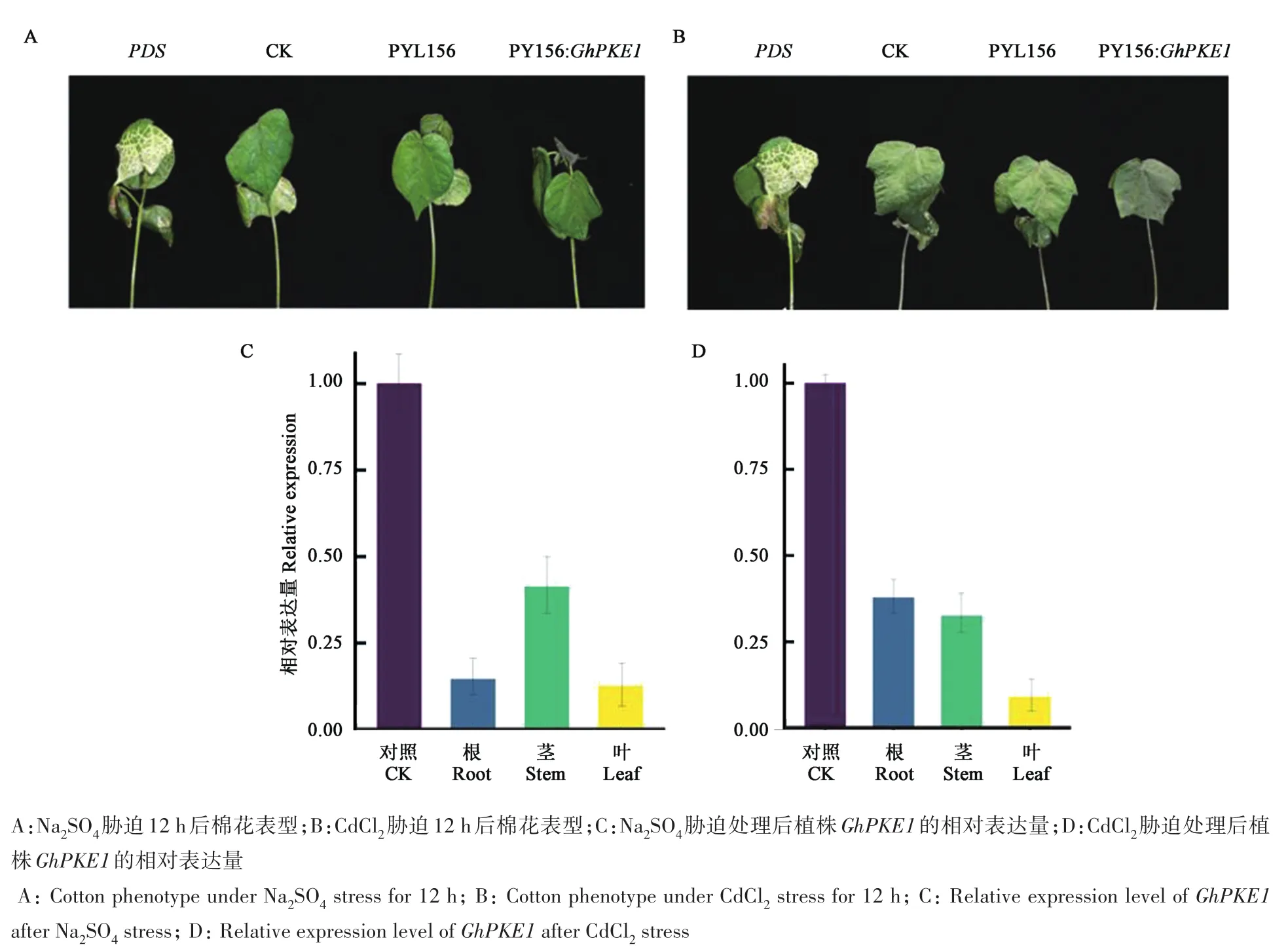
图5 VIGS侵染后的棉花表型及GhPKE1基因相对表达量Fig.5 Cotton phenotype and the relative expression level of GhPKE1 after VIGS infection
3 讨论
含有HMAD的基因一方面可以选择性地吸收和运输金属离子[17],另一方面与逆境胁迫存在交叉作用[18]。首先,液泡不仅作为Na+区隔化[19],也可以作为重金属区隔化,其中重金属腺苷三磷酸酶起到重要作用[18,20]。重金属腺苷三磷酸酶属于1b型离子泵,也称为CPx离子泵,负责离子解毒/转运[21-22]和液泡区隔[23]。在双突变体中,重金属腺苷三磷酸酶不仅影响重金属的转运[24],还影响植物的生长发育[25]。盐胁迫与重金属毒性在一定程度上存在重叠,多种综合的因素和化学信号参与了胁迫相关反应[26]。通过序列相似性搜索,本研究发现棉花中含有HMAD功能结构域的基因GhPKE1,其富含赖氨酸(18.0%)、脯氨酸(12.8%)和谷氨酸(11.6%),该基因的编码蛋白稳定且具有一定的亲水能力。GhPKE1蛋白不是分泌型蛋白,不具有跨膜结构域,在细胞中不发生迁移,二级结构以无规则卷曲和α螺旋为主。定位于细胞核的GhPKE1蛋白有4个重要的磷酸化位点,与其他蛋白间存在互作,这些生物信息学分析为GhPKE1蛋白的VIGS片段选择和未来的分子机制研究奠定了基础。
有研究显示,番茄中MYB或MYC转录因子可以直接调控PKE1,从而抵抗非生物胁迫[14]。PKE1在叶片中存在高甲基化,但在生殖器官中不存在,表明PKE1不仅在幼苗时期发挥作用,在生殖阶段也具有耐盐性[14]。PKE1可以与F-box蛋白结合[27],表明PKE1在转录后水平对耐盐基因起调控作用[14]。在番茄中过表达SpPKE1能增强转基因植株的耐盐性[14],在烟草中过表达SpPKE1能增强植株的耐旱性[27]。本研究在棉花植株中沉默GhPKE1基因,发现沉默后植株中GhPKE1转录水平较CK显著降低;盐或重金属胁迫后,植株更容易枯萎死亡,抗逆性显著降低。因此,推测GhPKE1基因不仅与耐CdCl2相关,而且也与耐Na2SO4相关,它们之间存在交叉作用,但该基因的具体功能还需要进一步研究。
