VIGS基因沉默技术在作物基因功能研究中的应用与展望
2022-02-26郝梦媛杭琦师恭曜
郝梦媛, 杭琦, 师恭曜
(1.郑州大学农学院,郑州 450001;2.郑州大学生命科学学院,郑州 450001)
随着大量作物基因组信息被公布,研究并验证基因具体功能是后基因组时代(post-genome era)的一项重要任务。基因功能缺失(loss-offunction)是揭示基因功能的重要手段。通常可以在3个水平上实现基因的功能缺失:第1种是基因组水平上的基因突变(gene mutation,GM),即基因编码序列的无义突变或缺失,导致基因功能缺失;第2种是转录水平的基因沉默(transcriptional gene silencing,TGS),即基因编码序列正常,但转录受到抑制,使其无法发挥功能;第3种是转录后水平的基因沉默(posttranscriptional gene silencing,PTGS),即基因可以正常转录,但无法正常翻译,如提前降解,造成基因功能缺失。目前,常用的基因功能缺失研究方法仍依赖转基因技术,如创制T-DNA插入突变体或CRISPR靶向突变体、通过CRISPRi抑制靶向基因、利用RNAi造成目标基因转录后沉默。而多种作物还未建立起成熟的转基因技术体系,使得以上方法无法应用于其基因功能研究。
病毒诱导的基因沉默(virus-induced gene silencing,VIGS)是一种不依赖转基因技术的基因功能缺失研究方法,其综合植物病毒的非转基因系统性侵染、植物的免疫应答及细胞RNAi沉默机制于一体,可以简易、快速且高效地沉默靶向基因,属于转录后基因沉默。相比于依赖遗传转化的基因功能缺失研究方法,VIGS技术具有不需要遗传转化、实验周期短、研究成本低及应用植物范围广等特征,被越来越多地应用于不同作物的基因功能研究中[1-2]。本文基于VIGS技术原理,系统阐述了植物VIGS技术的发展过程,重点归纳了VIGS在不同作物中的应用现状,并在此基础上进一步总结和讨论了影响VIGS基因沉默效率的主要因素,以期为VIGS技术在作物基因功能研究中的进一步应用和发展提供参考与借鉴。
1 VIGS技术原理
VIGS利用了植物固有的RNA干扰(RNA interference,RNAi)和病毒免疫应答的机制。RNAi是指通过一些长度为21~30 nt的小RNA特异调节序列互补基因表达和翻译的基因沉默过程。在生物体内,初级小RNA转录后形成双链RNA(double stranded RNA,dsRNA),dsRNA会被Dicer酶识别并切割成21~24 nt的成熟siRNA(short interfering RNA)[3]。 这 些 siRNA 与Agronaute1(AGO1)及其相关蛋白质形成沉默效应复合体RISC(RNA-induced silence complex),并特异性地结合并降解互补mRNA序列,引发转录后基因沉默(图1A)。植物的病毒免疫应答即利用了RNAi机制,当病毒侵染植物后,病毒复制形成的dsRNA同样会被植物体内的Dicer酶识别并切割成siRNA,进而触发RNAi机制特异识别并降解病毒RNA,免疫病毒入侵。VIGS技术巧妙地利用了植物的病毒免疫应答和RNAi机制,通过在病毒载体中插入目标基因片段,在侵染的植物细胞中诱发产生可以特异互补目标基因的siRNA,靶向降解目的mRNA,结合病毒的侵染能力,诱发全植株的靶向基因沉默[4](图1B)。
2 VIGS的发展
2.1 病毒沉默载体的发展
合适的病毒载体是影响VIGS技术应用的关键因素之一。对植物病毒序列的侵染性克隆,对病毒基因功能、侵染机理、病毒−植物互作的研究以及对病毒载体的改造都极大地推进了VIGS技术的发展。虽然现有的VIGS仍以RNA病毒载体为主,但已有多个DNA病毒及卫星病毒被成功开发成VIGS载体,它们各自具有不同特点以及应用范围(表1)。

表1 VIGS载体及其在植物中的应用Table1 VIGS vectors and their applications in plant

续表 Continued
构建VIGS载体常用的RNA病毒有烟草花叶病毒(tobacco mosaic virus,TMV)[5]、马铃薯X病毒(potato virus X,PVX)[6]、烟草脆裂病毒(tobacco rattle virus,TRV)[9]、大麦条纹花叶病毒(barley stripe mosaic virus,BSMV)[15]、黄瓜花叶病毒(cucumber mosaic virus,CMV)[28]和雀麦花叶病毒(brome mosaic virus,BMV)[23]等。1995 年,Kumagai等[5]首次基于烟草花叶病毒TMV构建了VIGS载体,将编码八氢番茄红素合酶(phytoene synthase,PSY)的cDNA和编码八氢番茄红素去饱和酶(phytoene desaturase,PDS)的反义cDNA片段置于烟草花叶病毒亚基因组启动子的转录控制下。当PDS表达水平受到抑制时,植物失去了类胡萝卜素的光保护作用,光照后会出现叶片白化效应。与预期结果一致,携带有反义PDS序列的TMV侵染烟草后,PDS的mRNA积累水平显著降低,侵染一周后烟草叶片表现出白化表型[5]。此后,多种RNA病毒被成功开发成VIGS载体,它们被广泛应用于拟南芥、马铃薯、番茄、大麦、辣椒等植物中[32-34]。
基于TRV病毒构建的VIGS体系具有寄主范围广、沉默效率高、持续时间长、病毒症状轻和可感染分生组织等优点,是目前应用最广泛的VIGS系统[35]。TRV是一种土传的杆状RNA病毒,其基因组由2条RNA链——RNA1和RNA2组成(图1B),其中,RNA1编码RNA聚合酶、运动蛋白以及其他蛋白质,RNA2主要编码病毒外壳蛋白和介导线虫传播的29.4和32.8 kD蛋白[12]。Ratcliff等[9]在2001年构建了TRV病毒的双元载体 pBINTRA6(TRV1) 和 pTV00(TRV2),将RNA2序列中的29.4和32.8 kD蛋白编码基因删除,替换为1个多克隆位点(multiple cloning site,MCS),用于目的基因片段的插入(图1B),并在本氏烟草中成功沉默了外源GFP及内源PDS基因。改造后的TRV载体不会诱发明显的病症,避免了对基因沉默表型的影响。此外,TRV会造成顶端分生细胞的基因沉默,更利于产生表型一致的基因沉默植株[9]。
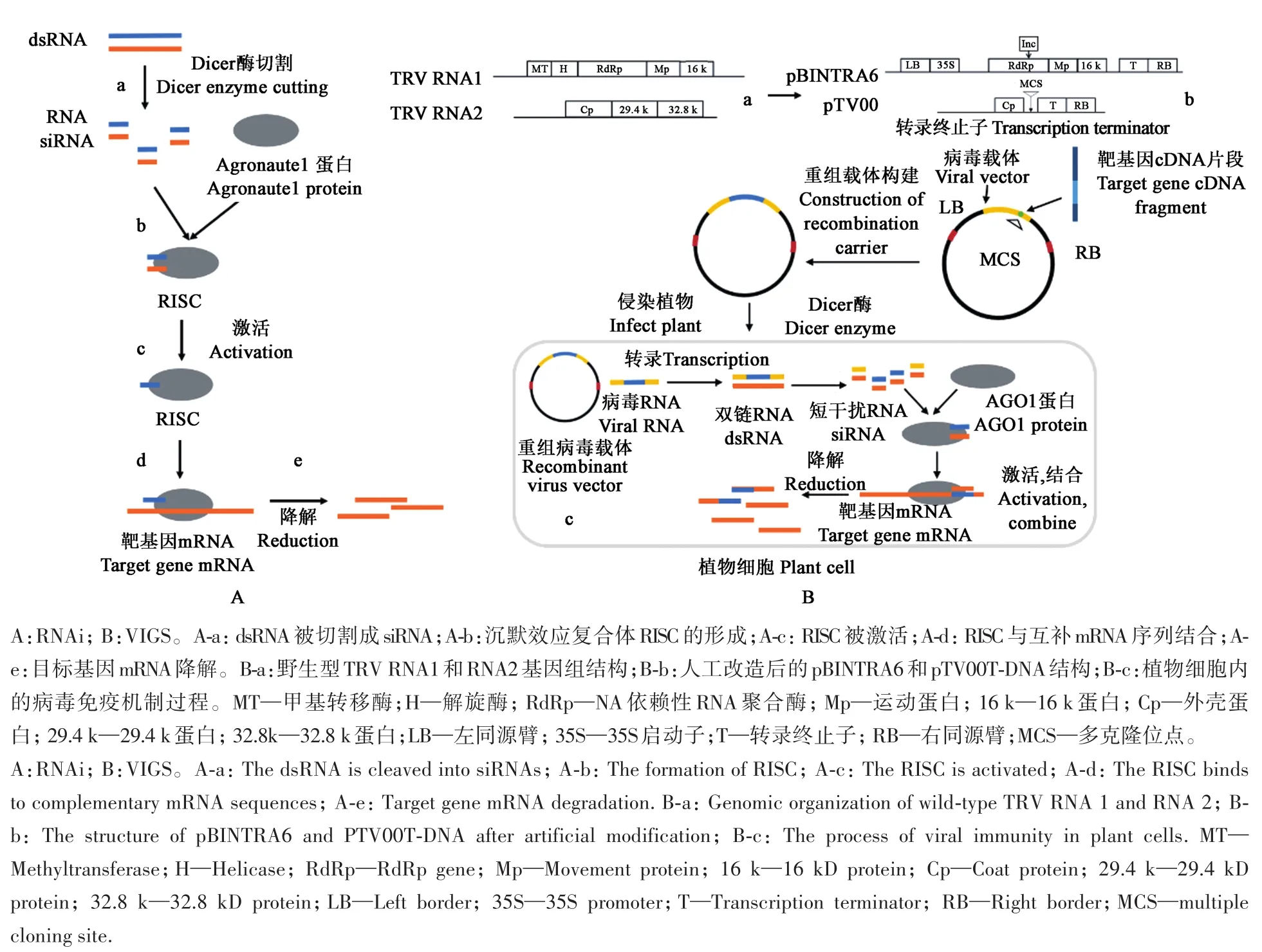
图1 RNAi与VIGS作用机制(以TRV为例)Fig.1 Mechanism of RNAi and VIGS(taking TRV as an example)
植物DNA病毒也可以被改造为基因沉默载体,最早被发现的可用于构建VIGS体系的DNA病毒是番茄金色花叶病毒(tomato goldenmosaic virus,TGMV)。Kjemtrup等[8]在 1998年首次以TGMV作为载体,在本氏烟草中分别沉默了镁螯合酶的硫等位基因(SU)和外源萤火虫萤光素酶基因(LUC)。在此之后,白菜曲叶病毒(cabbage leaf curl virus,CbLCV)[19]、非洲木薯花叶病毒(african cassava mosaic virus,ACMV)[20]等 DNA病毒均被用于VIGS体系的构建。基于DNA病毒构建的VIGS体系目前已经被用于研究本氏烟草、拟南芥、棉花和木薯等植物的基因功能[33]。
卫星病毒诱导的沉默系统(satellite virusinduced silencing system,SVISS)以卫星病毒为载体。卫星病毒是一类亚病毒,其基因组中往往仅含有编码外壳蛋白的遗传信息,需要依赖辅助病毒才能进行核酸的复制与表达。2002年,Gosselé等[18]开发了一种全新的两组分VIGS系统,并以卫星烟草花叶病毒(STMV)为载体将抑制性RNA传递到烟草中,用烟草花叶病毒株U2(TMV-U2)作为辅助病毒帮助STMV复制与表达,在SR1型烟草中分别对PDS、chsA等基因进行了沉默。此后又有多种卫星病毒被用于构建VIGS体系,在烟草、番茄和矮牵牛等植物中实现了目的基因沉默,如中国番茄黄化曲叶病毒(tomato yellow leaf curl China virus,TYLCCNV)的 β 卫星病毒[21]、木尔坦棉花曲叶病毒β卫星病毒(cotton leaf curl Multan virus,CLCuMV)[36]等。卫星病毒和辅助病毒的二元体系将基因沉默诱导组分与病毒复制的辅助组分相互分离,提升了VIGS体系的稳定性,为进一步改良植物VIGS系统提供了参考。
2.2 VIGS技术的拓展
2.2.1 小RNA介导的VIGS 病毒诱导的小RNA介导的基因沉默(microRNA-mediated virusinduced gene silencing,MIR-VIGS)是结合 MIGS(microRNA-induced gene silencing)和 VIGS为一体的基因沉默技术。植物编码的miRNA能够被DCL1与RNAseⅢ酶切割,形成大约22 bp的成熟双链miRNA,与AGO2蛋白结合后可识别内源靶基因mRNA,造成mRNA降解或翻译抑制[37]。Schwab等[38]利用内源microRNA的结构特点和加工过程,设计出了可以特异靶向目标基因的人工合成microRNA(artificial microRNAs,amirRNAs)。随后,Tang等[39]将MIGS和VIGS技术结合发展出了MIR-VIGS,成功沉默了烟草中的SGT1基因,导致烟草丧失了对烟草花叶病毒的抗性(图2A)。传统的VIGS通过切割200~600 bp插入片段产生一系列21~24 nt的siRNA靶向降解目的基因mRNA,这可能会造成非特异性基因沉默。在MIR-VIGS中,病毒载体被用来传递靶向特异性更高的amirRNAs,降低了VIGS的非靶向沉默概率。

图2 MIR-VIGS与HIGS技术机理Fig.2 Mechamism of MIGS-VIGS and HIGS
2.2.2 寄主诱导的基因沉默 寄主诱导的基因沉默(host-induced gene silencing,HIGS)是对传统VIGS应用的另一个重要拓展。Nowara等[40]研究发现,将病原体基因片段载入病毒载体并感染寄主植物后,寄主细胞中会产生dsRNA,这些dsRNA在病原体感染寄主时会进入病原体中,从而引起病原体发生PTGS(post-transcriptional gene silencing),下调病原体目标基因的表达或导致其丧失功能(图2B),这是HIGS概念首次被提出。HIGS将VIGS沉默对象从植物内源基因拓展到病原体基因,根据病原体表型的变化可以对病原体目标基因的功能进行研究。
HIGS已成功应用于作物的病虫害防治研究中[9,41]。2007 年,Valentine等[42]将线虫基因片段装载入TRV载体后侵染拟南芥,成功抑制了拟南芥根部寄生线虫体内目标基因的表达。通过HIGS沉默线虫基因,如酪氨酸磷酸酶基因、钙网蛋白基因Mi-CRT、寄生基因8D05等,可以提高植物对线虫的抵抗力[43]。2010年,Nowara等[40]通过BSMV介导的基因沉默成功抑制了小麦白粉菌表达效应基因,使得小麦对白粉病的抗性提高。2013年,Panwar等[44]通过BSMV介导的HIGS成功抑制了小麦条锈病菌致病基因在宿主中的表达,提高了小麦的抗条锈病能力。
2.3 VIGS接种方式的发展
影响VIGS应用的另一个关键因素是,如何将病毒载体投送至植物细胞诱发基因沉默。VIGS技术发展早期通常以体外转录的方式生产感染性病毒RNA,然后混合石英砂,使用摩擦接种法造成叶片表面微伤来感染植物叶片细胞[5]。这种方法操作复杂、效率较低、对植物叶片损伤较大且不易高通量侵染,目前仅在单子叶植物中应用。
对于有肥厚叶片的双子叶植物而言,叶片注射接种法更加简便。叶片注射法使用不带针头的注射器将配好的侵染液打入植物叶片背面以侵染细胞[45]。此外,Ryu等[46]利用TRV-VIGS系统通过根吸收法成功沉默了烟草的PDS基因。Yan等[47]使用TRV-VIGS系统利用真空浸透法侵染发芽后的种子,成功沉默了番茄中的PDS基因。根吸收法、真空浸透法在操作上更加简单、更利于VIGS的高通量应用,但其沉默效率,尤其是对植物地上部基因的沉默效率相比于叶片注射法仍有不足,其应用很少。目前,多数双子叶植物的VIGS研究仍广泛采用叶片注射法。
将病毒载体装入Ti质粒,利用Ti侵染植物细胞后投送表达病毒载体,避免体外转录病毒的繁琐过程,可以极大地简化VIGS的病毒接种。此外,烟草是多种植物病毒的宿主,因此可以先用农杆菌接种烟草叶片,大量生产病毒粗提液用于后续VIGS[48]。利用烟草生产病毒,不仅省去体外转录病毒的繁琐过程,而且这些病毒以烟草叶片或粗提液的形式可长期保存,进一步方便了VIGS的应用。
3 VIGS在作物中的应用
VIGS具有不需要遗传转化、简单高效、无品种依赖性等优点,使其非常适合于遗传转化困难作物的基因功能研究。随着适用于不同粮食、果蔬和经济作物的VIGS系统被陆续构建(表1),VIGS已在重要农艺性状基因的功能解析研究中展示了其应用价值。
3.1 VIGS在单子叶作物中的应用
在水稻、小麦、玉米等重要单子叶作物中,应用较多的VIGS系统主要有BSMV、BMV、CMV以及TRV等。2002年,Holzberg等[15]使用BSMV成功沉默了大麦的PDS基因,这是VIGS技术在单子叶植物中的首次应用。随后,Scofield等[16]验证了BSMV-VIGS体系在六倍体小麦中的可行性,拓展了BSMV载体的应用范围。2011年,Yuan等[17]使用烟草生产BSMV病毒粗提匀浆,并使用BSMV匀浆在本氏烟草、小麦以及大麦中简单、高效地沉默了PDS、ChlH等基因。Yuan等[17]沉默了小麦中与拟南芥PMR5基因同源的TaPMR5基因后,小麦对于白粉病的抗性明显减弱,从而验证了其基因家族在单子叶植物和双子叶植物中具有相似的功能。王蓉[29]利用CMV建立了可以高效沉默玉米基因的CMV-VIGS系统,并沉默了玉米的ZmIspH基因,被沉默植株叶片中叶绿素和类胡萝卜素含量显著降低,且接种60 d后该基因表达仍被抑制。CMV-VIGS系统为研究玉米基因功能提供了高效便捷的工具。
3.2 VIGS在棉花中的应用
棉花是重要的天然纤维作物,利用VIGS技术已经鉴定多个棉花抗病相关基因。Gao等[10]利用TRV载体沉默GhNDR1基因和GhMKK2基因后,发现超过80%和65%的棉花严重地感染黄萎病,说明GhNDR1和GhMKK2基因在棉花抗黄萎病过程中发挥了关键作用。Tuttle等[26]开发了基于棉花叶皱缩病毒(cotton leaf crumple virus,CLCrV)的棉花沉默载体,利用基因枪技术接种CLCrV沉默ChlI基因后,棉花叶片出现黄化表型。2012年,Tuttle等[27]进一步开发出了可用农杆菌叶片注射接种的CLCrV基因沉默系统,产生了与基因枪法等效的基因沉默,简化了CLCrV-VIGS体系在棉花中的应用。
在对棉花品质相关基因的研究中,Qu等[11]使用TRV系统对棉花的真叶和根进行侵染,对KATANIN和WRINKLED1基因在棉花发育过程中的功能进行了研究,首次证明了TRV-VIGS体系在棉花生殖器官中的有效性。结果显示,沉默KATANIN基因后,棉花纤维长度变短而种子的含油量增加,而WRINKLED1基因被沉默后,棉花纤维长度增加,但种子的含油量降低。该研究验证了通过重新分配碳流量增加棉花纤维长度的可行性,为研究棉花纤维发育机制和改良棉花纤维品质拓展了全新的思路。
3.3 VIGS在蔬菜中的应用
VIGS技术已经被应用于多种蔬菜作物的功能基因研究。马红珍[49]建立了番茄TRV-VIGS体系,对DL-II-C1基因功能进行验证,用携带目标基因的重组病毒载体感染具有白粉病抗性的番茄植株,使其失去了抗病性,证实了DL-II-C1是番茄白粉病抗性的相关基因。2019年,Chen等[50]使用TRV-VIGS系统成功沉默了番茄中的MYB80基因,通过评估植物在4℃条件下的冷害指数,证实MYB80基因与番茄植物的耐寒性有关,而MYB80基因的沉默降低了其耐寒性。辣椒是一种较难进行基因转化的物种,Choi等[31]于2019年,开发了基于蚕豆萎蔫病毒(broad bean wilt virus,BBWV)的VIGS载体,并在各种辣椒品种中成功地沉默了PDS基因,为辣椒基因功能研究提供了新的VIGS工具。2012年,Liu等[12]以TRV为载体感染茄子,抑制了茄子PDS基因的表达,首次证实TRV-VIGS系统可用于茄子的基因沉默。
3.4 VIGS在果树中的应用
果树生长周期较长,应用遗传转化研究果树基因功能的时效性较差,因此,非转基因的VIGS技术是研究果树基因功能的重要工具。目前,在果树研究中使用的VIGS载体种类仍比较有限,主要有苹果潜隐球型病毒(apple latent spherical virus,ALSV)、TRV和柑橘叶斑驳病毒(citrus leaf blotch virus,CLBV)载体[51]。
ALSV可用于侵染苹果、梨等蔷薇科果树,且引起的症状较轻。2011年,Sasaki等[25]从苹果中提取rbcS基因后构建ALSV-rbc201重组载体,使用微粒轰击法侵染苹果和梨树刚发芽的子叶,2至3周后,实验组植株均出现了与敲除rbcS基因后相同的表征。Sasaki等[25]利用ALSV沉默了控制苹果开花时间的基因TFL1,约有10%的植株在侵染后2个月内开花并结出果实,而使用空载体侵染的对照组则没有花蕾形成。该研究表明,ALSV-VIGS系统可以在苹果、梨等蔷薇科果树中沉默靶基因,但ALSV载体只能用于感染植物韧皮部,仍存在一定的局限性。
TRV-VIGS系统可以高效地感染多种果树,并引发持续时间较长的基因沉默,在果树基因功能研究中应用较为广泛。Li等[13]在苹果果实中首次成功应用TRV-VIGS体系沉默了苹果乙烯合成基因MdACS6,在MdACS6基因被沉默的果实中几乎没有乙烯存在。Li等[14]利用TRV系统沉默了荔枝的果色控制基因LcUFTG1,沉默植株果皮着色延迟,果实中花青素积累受阻。Jia等[52]利用TRV-VIGS系统成功沉默了草莓中的FaABI1(abelson interactor 1)基因,发现该基因沉默后果实提前成熟。
VIGS技术可被用于研究幼年期较长的柑桔类植物的基因功能。2012年,Agüero等[30]开发了基于柑桔叶斑驳病毒(citrus leaf blotch virus,CLBV)的VIGS载体,并成功沉默了柑桔的PDS基因,这是VIGS技术在柑桔植物中的首次应用。CLBV在大多数柑桔类植物中的感染是无症状的,且能够在非韧皮部组织中诱导基因沉默,可以作为研究柑桔类植物基因功能的良好工具。
3.5 VIGS在药用植物中的应用
药用植物是一类具有药物属性的特殊作物,但目前其功能基因研究方法十分有限。2018年,Zhou等[53]利用TRV作为病毒载体,沉默了加利福尼亚罂粟中的PDS、ZDS、βOH和ZEP基因,使总色素浓度降低了75%~90%,并成功改变了花瓣的颜色,研究了花瓣类胡萝卜素代谢物的分布。2019年,Schachtsiek等[54]通过 CLCrV-VIGS系统成功沉默了大麻中的ChlI和PDS基因,形成光漂白表型,并且分别伴随着叶绿素a和类胡萝卜素含量的降低。可以想象,VIGS系统也将被广泛应用于中草药的药理研究。
4 影响VIGS效率的因素
4.1 环境因素
环境对于病毒在植物中的复制和扩散有着重要的影响,因此也会影响病毒诱导的基因沉默效率。Fu等[55]研究发现,接种了TRV-PDS的番茄植株及其花朵和果实在低温(15℃)和低湿度(30%)条件下沉默效率更高。Burch-Smith等[56]研究认为,在温度为21℃或更低时,利用TRV沉默番茄基因可以形成较好的沉默表型。使用TRV为载体侵染本氏烟草时,理想的温度约为25℃。Tuttle等[26]研究发现,其在棉花中构建的CLCrVVIGS体系在较低温度下可产生更广泛和持久的基因沉默。针对不同的作物和载体,应当选择合适的温度以使基因沉默更加高效。
4.2 病毒载体
为了防止病毒载体引起作物病毒的大规模传播以及本地植物的大量感染,在选择VIGS病毒载体时最好选用当地已经存在的、不能被昆虫传播的、毒性较弱的毒株,同时还要避免因病毒载体毒性过强而导致宿主死亡,或因病毒载体自身引起的病症而导致基因沉默性状无法被观测。当选取致病性较强的病毒作为载体时,可以通过基因敲除或突变等方式对病毒进行改造后再应用于VIGS体系中[1]。
4.3 插入基因片段
插入片段与靶基因的同源性对提升VIGS的效率十分重要,同源性越高,基因沉默效果越好。若VIGS产生的siRNA和目标mRNA的序列一致性少于11 bp,基因沉默的效率会显著降低[32]。如果选取了不合适的基因片段,可能会造成基因沉默的“脱靶”,无法得到期望的沉默表型[44]。为了降低脱靶的风险,Xu等[57]基于Web开发了一种名为siRNA Scan的计算工具,用于识别潜在的脱靶目标,以便构建更合适的VIGS载体,减少“脱靶”率。对于植物中大量存在的基因家族,应选择该基因家族的保守区以沉默一个基因家族中的多个基因,防止基因之间功能互补导致沉默效果不佳。如果目标基因是某一基因家族中的单个基因,插入片段应该是该基因的特异序列,避免有超过23个核苷酸序列与其他家族成员相同[35]。
插入片段的长度和结构也对VIGS的效率有着关键影响。病毒在细胞之间的移动性受限于其序列的大小,因此插入序列的长度不能过长。目前通常认为,插入片段长度的极限为1.5 kb,若超过这一上限,病毒的复制和转移可能会受到阻碍,病毒可能不会传播或丢失插入片段的可能性增加。Thomas等[58]研究认为,插入片段长度的下限是23 nt,但是23 nt的长度一般情况下不能成功使靶基因沉默[15],实际操作中应选择较长的序列。目前认为,使用300~500 nt作为插入片段的长度较为合适[56]。Lacomme等[59]等将40~60 bp的反向重复序列插入病毒载体中,形成发卡结构(hairpin),相比由cDNA片段构建的载体,产生了更强的 VIGS表型,根据 RT-PCR(reverse transcription-polymerase chain reaction)检测结果,通过添加反向重复序列构建的载体使植物组织中靶基因mRNA的积累减少了3倍,表明在植物病毒载体中插入小的反向重复序列可以显著地改善VIGS的沉默效率,dsRNA的形成可能有助于提高VIGS强度。
4.4 侵染方式
不同的侵染方式会在一定程度上影响基因沉默的效率,应根据宿主和病毒载体之间的选择性、宿主本身的特性以及目的基因的表达特性选择合适的接种方法。目前常用的侵染方法有叶片注射法、摩擦接种法、微粒轰击法、根吸收法、真空渗透法等。不同的接种方法对不同部位、不同时期的基因沉默有不同效应,如叶片注射法和摩擦接种法多用于沉默幼苗期的基因,根吸收法以及真空渗透法则可以用于更早期的基因沉默。需进一步开发不同时期的不同侵染方法以进一步拓展VIGS的应用。
5 VIGS的检测
病毒被接种到植物中后,会随着植物的生长逐渐分布于整个植株中并诱发系统性的基因沉默。通常通过提取新生叶片的RNA[35],使用定量或半定量RT-PCR的方法检测靶基因的沉默情况。通过检测试验组与对照组样本中靶基因mRNA的含量来判断基因沉默的效率。需要注意的是,设计引物时应避免在病毒携带的靶基因序列片段内扩增,否则会同时检测到复制后的病毒载体RNA,进而影响RT-PCR检测结果。
6 VIGS存在的问题及解决方法
尽管VIGS不依赖遗传转化、接种方便且沉默效率高,但VIGS技术仍有一定的局限性,不能完全沉默基因,某些基因只需少量mRNA即可表达自身的功能,因此无法通过VIGS进行功能鉴定。但从另一方面看,这也是VIGS的优势,VIGS的不完全沉默非常适合一些突变致死基因的功能研究。非特异性基因沉默也是VIGS试验必需考虑的问题,300~500 bp的插入片段会产生一系列21~24 nt的siRNA,这可能会造成非靶向沉默,因此,开展试验前需要认真分析靶向基因的序列特征,选择特性强的片段以降低“脱靶”率,或者选择特异性更强的MIR-VIGS系统。同样的,VIGS易于非靶向沉默的特征使其可以同时沉默序列相似、功能冗余的多个基因,也是其优势之一。
另外,VIGS造成的基因沉默效果不够均一,同一植株不同组织的沉默效率可能不同,同批植物不同植株间的沉默水平也可能存在差异。VIGS效果不均一的不足可以通过增加试验重复以及优化侵染方法来改善。2017年,Cheuk等[60]利用含BSMV颗粒的病毒匀浆侵染不同植物种子时发现,与病毒匀浆介导的叶片摩擦法相比,病毒匀浆介导的种子吸涨法接种的VIGS的病毒扩散程度更加均一,可获得较好的沉默表型,并可传递到下一代。
病毒的宿主范围是限制VIGS应用的重要因素之一,目前应用最广泛的TRV-VIGS系统,在某些非宿主植物中无法诱导基因沉默。为解决这一问题,研究人员需要根据研究的植物选择合适的病毒载体,当前已经开发出了多种适用于不同作物的VIGS病毒载体,随着更多的植物病毒被鉴定,未来也将会有更多的病毒载体被开发用于VIGS。
此外,VIGS引起的沉默效果往往不能长时间持续,如TRV诱导的基因沉默表型会存在1~2个月,此后沉默强度逐渐减少甚至消失,因此不能用于研究植物生长后期的基因功能。针对这个问题,首先可以根据目标基因的研究窗口选择合适的病毒载体。目前研究发现,CLCrV、CMV以及CLBV的沉默持续时间较长[26,28,30]。同时,研究人员也可以选择合适的接种方式来延长沉默时间。Senthil-kumar等[61]利用TRV-VIGS系统,同时使用叶片注射法和根吸收法感染植株,使目的基因沉默时间达到了2年以上,并且被感染植株的后代中也有部分植株出现基因沉默表型,证明VIGS在一定条件下是可被遗传的,这一发现提升了VIGS的可用性,证明其具有用于研究植物发育不同阶段基因功能的潜力。
7 展望
VIGS是一种简便、高效的转录后基因沉默技术,相比转基因、处理诱变等传统基因沉默方法,使用VIGS可以快速、低成本地获取靶向目标基因沉默植株,极大地方便了植物基因功能的反向遗传学研究。此外,VIGS载体可以装载目标病原体的相关基因,开发为植物的抗病“疫苗”,通过HIGS沉默病毒、细菌、真菌以及昆虫等病原体的相关基因对植物进行保护[6],为植物病虫害的预防提供了一种全新的途径。目前,VIGS已成功用于多种作物重要农艺性状功能基因的挖掘,随着对VIGS原理的深入了解、新病毒载体的开发以及分子生物学的不断进步,VIGS技术的局限性将逐步被克服。VIGS系统将会在更多的植物物种,尤其是在那些难以通过转基因方法分析的作物中得以应用,成为后基因组时代作物基因功能研究的重要技术手段。
