衬砌对河道底泥细菌群落同质化的影响
2022-02-25赵隽莹郭逍宇苏振华邸琰茗
赵隽莹,张 伟,郭逍宇,苏振华,邸琰茗,董 志
衬砌对河道底泥细菌群落同质化的影响
赵隽莹1,张 伟1,郭逍宇1,苏振华2,邸琰茗3,董 志4*
(1.首都师范大学资源环境与旅游学院,北京 100048;2.中国制浆造纸研究院,北京 100022;3.北京市北运河管理处,北京 101100;4.北京大学生命科学学院,北京 100871)
以高度人工化的再生水补给河道—北运河京津冀流域为研究区,对具有不同河道生境类型的上游与中下游底泥中的细菌群落多样性、组成及环境选择模式进行对比分析.结果表明:中下游河道衬砌工程促进底泥生境特征同质化,进而导致中下游底泥细菌群落同质化.上游细菌群落空间周转率(0.0002)相比较,中下游群落具有较低的空间周转率(0.00002),并在排序图上呈现更紧凑的分布特点.与上游自然生境条件下的群落组成相比较,由于衬砌条件下非优势组分的片段类型多样性较高,优势组分的片段类型多样性及相对丰度较低,最终使得同质化群落表现为较低的丰富度.RDA模型(=0.002)分析表明,衬砌和TP是影响细菌群落空间变化的主导环境因素,而大环内酯类和四环素类抗生素则对群落结构类内变异起作用.纤维杆菌门(Fibrobacteres)、纤细菌门(Gracilibacteria)、酸杆菌门(Acidobacteria)、Acetothermia的片段类型多样性和费希尔菌门(Fischerbacteria)、Kiritimatiellaeota、放线菌门(Actinobacteria)、蓝细菌门(Cyanobacteria)的相对丰度均与衬砌高度相关.
北运河;底泥;细菌群落;衬砌;多样性;空间变化
河道细菌是河道底部长期积累沉淀形成的产物,也是河道水生态系统的重要组成部分[1].作为底泥中有生命的部分,河道细菌虽仅占有机质组分的1%~4%[2],但却在河湖系统中承担重要的分解者角色.河道细菌不仅通过物质循环和能量流动调节、净化和改善水环境[3],而且在缓解重金属和其他新型难降解有机污染物累积效应方面发挥重要作用[4-9].同时,水环境质量又可反作用于底泥细菌群落结构和多样性[10].
再生水作为新型非常规补给水源,普遍富含不同形态的氮素和污水再生处理系统不能有效去除的新型污染物[11].这种非常规补给水源所携带的污染物通过低剂量和长期暴露方式影响河流生态系统生物通过低剂量和长期暴露方式影响河流生态系统生物多样性,导致作为分解者的细菌群落高度发达[12-14].这种特殊水质的再生水通过入渗方式形成区域性地下水补给源,在缓解城市地下水位下降和控制地面沉降方面发挥重要作用.为防止再生水中丰富的氮素和持久性新型污染物质通过垂向渗漏进入地下水[15],大规模的河岸带侧砌和河底衬砌已经成为再生水城市河道补给前普遍采用的工程措施之一[16].有文献证明衬砌工程在有效缓解河湖水质下渗的过程中,也不可避免地改变了再生水补给河道地表水与地下水包气带之间的水文水质循环过程[17].但关于衬砌河道底泥与自然河道底泥间细菌群落结构和多样性差异少有研究.
北运河承载着北京90%的排水任务,是北京市四大排污河之一.北运河93%的水源均来自于经过处理的城市废水,4%来自于未经处理的废水[18].位于京津之间的河段通过河岸带湿地植被修复工程净化水质,中游北京通州城区段和下游天津市区采用底砌和侧砌的工程补给再生水,下游同时接受来自天津经处理和未处理的废水[19].由于研究区地处平原地区,水流流速缓慢致使水流中裹挟的浊物逐步沉淀,最终导致河道淤积严重[20],是研究河道衬砌对底泥细菌群落结构影响的理想场所.基于此,本文探讨高度人工化的再生水补给河道浮游细菌在河道衬砌影响下的群落多样性、结构和组成的变化,研究成果可为城市河道水生态修复和治理提供科学依据.
1 材料与方法
1.1 研究区概况
北运河源于北京市昌平区及海淀区一带,后向南流入通州区,流经河北,在天津市汇入海河,全长260km.流域总面积为6166km2,其中,山区面积952km2,占16%,平原面积5214km2,占84%.研究区多年平均降雨量643mm,降雨主要集中在6月~9月,约占全年的84%[21].作为京杭大运河的重要组成部分,北运河主要流经城市化水平高的北京、天津,其人口、产业密集,是海河流域骨干行洪排涝河道之一[21].同时北运河是以再生水补给为水源的多闸坝高度人工化河流,既承担北京市防洪排涝的任务,也发挥了城市生态景观、休闲娱乐的功能[22].
1.2 采样点布设与样品采集

表1 底泥质量指标的统计特征(mg/kg)
2019年9月在研究区按照均匀布点并兼顾考虑流域尺度点源与非点源污染类型分布原则设置并采集河道新鲜底泥(图1).同时采用全球定位系统(GPS, Garmin Legend, Garmin USA)记录采样点位置.将采集的新鲜底泥放入预先灭菌的铝盒中,冰袋保存立即带回室内.带回室内的底泥样品,冷冻干燥后,剔除植物、昆虫和石块杂质,混合均匀后研磨,过60目筛,装入自封袋中,-20℃避光保存备用.
底泥中氨氮(NH4+-N)和亚硝酸盐氮(NO2--N)采用氯化钾溶液提取分光光度法测定;硝酸盐氮(NO3--N)采用紫外分光光度法测定;总氮(TN)采用过硫酸钾消解紫外分光光度法测定;总磷(TP)采用钼酸盐分光光度法测定;总有机碳(TOC)采用重铬酸钾氧化分光光度法测定;阴阳离子(Na+、NH4+、K+、Mg2+、Ca2+、Cl-、NO3--N、SO42-)采用离子色谱仪测定;金属总量(Al、B、Be、Cd、Co、Cr、Cu、Ga、Mg、Mn、Ni、Ti、V)使用电感耦合等离子体发射光谱仪(ICP-OES)进行浓度检测.抗生素采用超高效液相色谱串联三重四级杆质谱仪进行分析.各采样点底泥质量指标的描述统计见表1.
1.3 细菌高通量测序
将采集好的新鲜未经处理的沉积物样品取适量于1.5mL离心管中,送至诺禾致源科技有限公司进行微生物PCR扩增和16S rDNA高通量测序分析.扩增引物采用(CCTAYGGGRBGCASCAG,GGACTACNNGGGT- ATCTAAT),扩增16S rRNA基因V3-V4区.
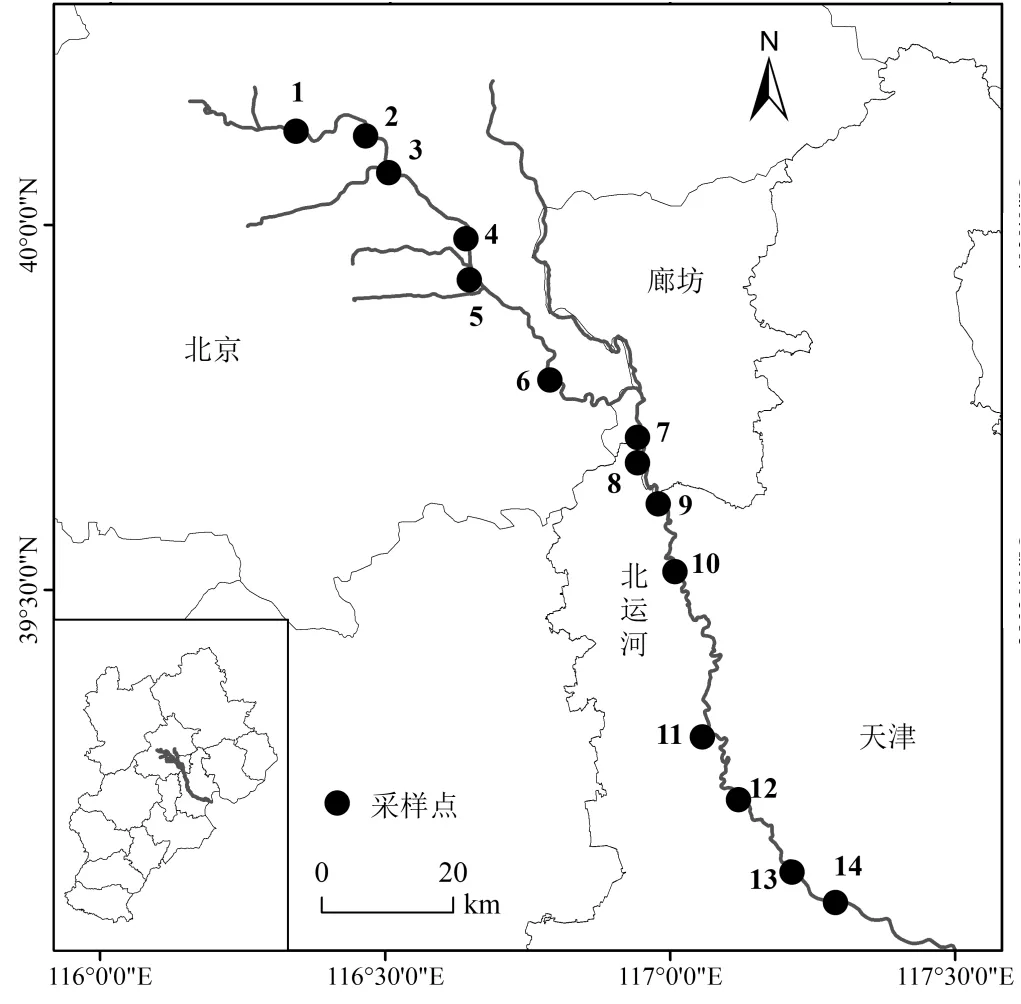
图1 北运河样点分布
1.4 数据预处理与分析
将测序得到的分类操作单元(OTU)序列按 97%的序列相似度对有效序列进行比对,同时去除仅出现一次的OTU以消除假阳性影响.在此基础上,定义所有样点均出现的OTU为核心OTUs (806OTUs),各样点出现频率<40%的OTU为特有OTUs(1127OTUs),其余OTUs定义为非核心OTUs (6705OTUs).另外再按照OTUs的相对丰度等级对其进行分类,定义平均相对丰度>0.01的OTUs为优势OTUs(150OTUs),<0.001的为偶见OTUs (3535OTUs),0.001~0.1的定义为非优势OTUs (4953OTUs).利用Primer 5非度量多维尺度分析(NMDS)、Global检验和组内相似性百分比(SIMPER)进行空间和群落结构分析,利用Origin 2020绘制散点图.基于Galaxy数据分析平台计算多样性指数(Chao 1指数、Simpson指数),利用Origin 2020绘制箱图.利用Canoco 5.0进行典范对应分析(RDA分析),其中环境因子及河流宽度使用定量数据(表1).采样点具有河道衬砌记为1,无衬砌记为0.空间向量根据样点的GPS坐标,通过R语言进行PCNM分析得到.利用SPSS 24进行方差检验(单因素ANOVA).
2 结果与分析
2.1 河道衬砌对底泥细菌群落空间分布的影响
为分析北运河底泥细菌群落空间变化规律,将高通量测序的数据经过预处理后,绘制基于OTUs水平的NMDS排序图(图2)和群落距离衰减图(图3).根据NMDS排序图的压力系数可知排序图的配合度适宜(Stress=0.09),结合河道生境类型分类结果,底泥细菌划分为包含了样点1~5样点的上游类群(UR)和包含了样点6~14中下游类群(MLR).进一步采用Global t-test检验对UR类群和MLR类群间差异显著性进行检验,表明2个类群间差异性显著(Global=0.772,=0.001).

图2 基于NMDS的上游和中下游局域群落排序
细菌群落 Bray-Curtis 相似性与地理距离的Spearman相关性表明,UR与MLR类群的细菌群落相似性都与样点地理距离显著相关(<0.05)(图3),而UR类群具有更高的空间周转率(=0.0002),这表明UR类群细菌群落的空间异质性相较MLR类群更大[23].同时在NMDS排序中,MLR类群的分布格局更为相似,其分布范围也较为集中,而UR类群则在排序图上具有较广的分布范围和格局(图2).进一步采用SIMPER分析表征不同群落的组内相似性(图2),MLR类群的组内相似性系数为55.6%,相对UR类群(52.25%)具有更高的组内相似性,这一结果与NMDS排序图和群落地理距离衰减图的分析一致.

图3 细菌群落 Bray-Curtis 相似性与地理距离的Spearman相关性
2.2 河道衬砌对底泥细菌群落多样性的影响
从图4可以看出,UR类群的物种丰富度指数显著高于MLR类群(<0.05),但其均匀度指数则显著低于MLR类群(<0.05).与UR类群相比较,MLR类群的物种丰富度和群落均匀度较低.
在此基础上,计算OTUs水平的不同丰度等级和不同频率等级的片段类型多样性及其在不同类群间的ANOVA检验(表2).MLR类群的片段类型多样性显著高于UR类群(<0.05),具体表现为中低丰度水平的非优势组分(<0.05)和低出现频率的非核心组分(<0.05)片段类型多样性显著高于UR类群.UR类群中高丰度的优势组分片段类型多样性极显著高于MLR类群(<0.01)且丰度也显著高于MLR类群(<0.05)则进一步证明衬砌生境下具有更为均匀的细菌分布格局.基于不同丰度等级和不同频率等级的相对丰度及其在不同类群间的ANOVA检验(表2)显示UR类群中的优势组分的丰度较MLR类群显著升高(<0.05).与相对丰度变化相比较,片段类型多样性对河道衬砌生境条件的改变更为敏感.

*:<0.05

表2 基于OTU水平下不同空间类群浮游细菌群落多样性变化分析
注:<0.05相关性显著;<0.01相关性极显著.
2.3 河道衬砌对底泥细菌群落组成模式的影响
通过测序得到的8638个OTUs片段共隶属于57个门类.首先筛选群落中OTU丰度在前1%的优势门类物种分别进行统计(图5).总体来看,UR类群与MLR类群共同具有11个优势门,其中放线菌门(Actinobacteria)和蓝细菌门(Cyanobacteria)在UR类群和MLR类群中具有显著差异,分别占据UR类群总体相对丰度的12%和7%,MLR类群总体相对丰度的7%和5%(图5).值得注意的是,相对丰度<1%的非优势及偶见门类物种的相对丰度在MLR类群中(6%)显著高于UR类群(4%)(图5).
为进一步探究UR类群与MLR类群间物种的具体差异及河道衬砌对底泥细菌群落组成的影响,将所有门类进行片段类型多样性统计和相对丰度计算,并对UR类群和MLR类群间进行显著性检验.结果表明,基于片段类型多样性得到的57组数据矩阵中共有14个组分具有显著差异(<0.05)(表3),其中,优势门类中的绿弯菌门(Chloroflexi)和酸杆菌门(Acidobacteria),非优势门类中的硝化螺旋菌门(Nitrospirae)和疣微菌门(Verrucomicrobia),偶见门类中的Calditrichaeota、亚硝酸盐氧化细菌门(Nitrospinae)、Acetothermia、装甲菌门(Armatimonadetes)、迷踪菌门(Elusimicrobia)、纤维杆菌门(Fibrobacteres)、纤细菌门(Gracilibacteria)、Kiritimatiellaeota、费希尔菌门(Fischerbacteria)均表现出在MLR类群中不同程度的显著高于UR类群(<0.01).与此相反,优势门类的蓝细菌门(Cyanobacteria)在UR类群中片段类型多样性较MLR类群更高(<0.01).基于相对丰度的数据矩阵共有7个门类具有显著差异,具体包括了亚硝酸盐氧化细菌门(Nitrospinae) 、Kiritimatiellaeota、伯克利菌门(Berkelbacteria)、费希尔菌门(Fischerbacteria)4个偶见门类在MLR类群中丰度显著高于UR类群(<0.01),而优势门类的放线菌门(Actinobacteria)和蓝细菌门(Cyanobacteria)则均在UR类群中更为丰富(<0.01).总的来看,基于门水平的河道衬砌对底泥细菌群落组成影响同样表明片段类型多样性较相对丰度对河道衬砌生境条件的改变更为敏感.
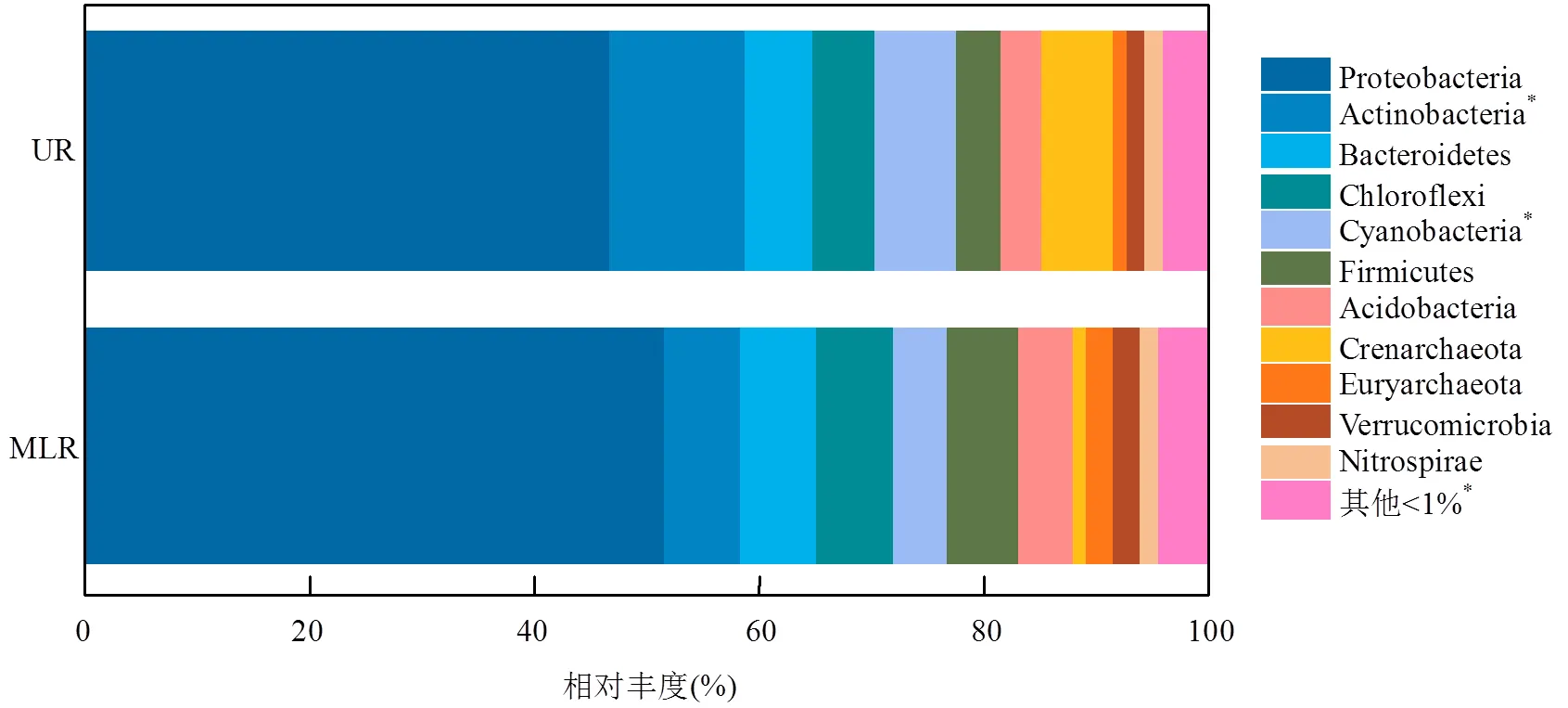
图5 基于门分类水平下相对丰度的百分比
*<0.05
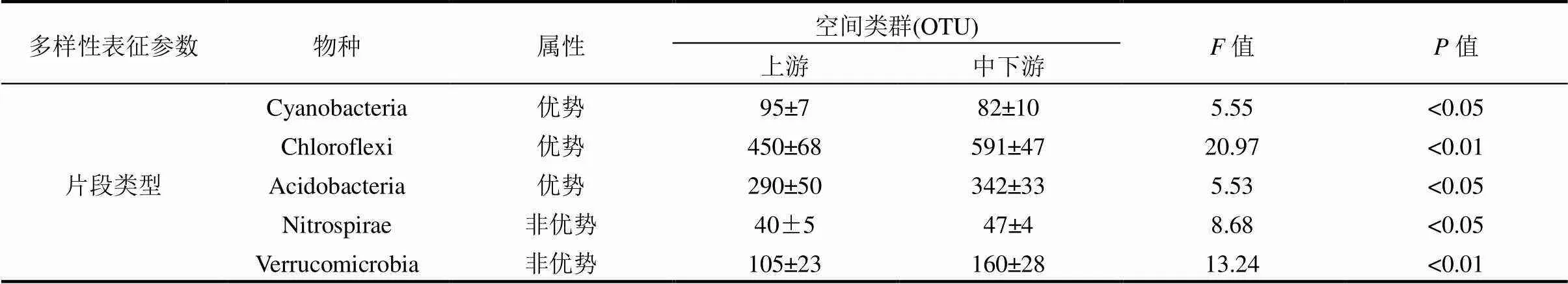
表3 基于门分类水平下不同空间类群浮游细菌群落多样性变化分析

续表3
注:<0.05相关性显著;<0.01相关性极显著.
2.4 河道衬砌对底泥细菌群落环境选择模式的影响
基于门水平OTUs片段类型多样性和片段相对丰度数据矩阵,结合包括衬砌在内的34个环境因子和7个空间向量,建立了RDA模型(图6).从结果可以看出,基于OTUs片段类型多样性数据矩阵的RDA模型(=2.1,=0.002)通过向前选择将组合筛选出3个环境因子(衬砌、TP、大环内酯类)和2个空间向量(12).UR类群和MLR类群的样点呈现沿对角线从右下到左上的变化趋势.与群落分布相关程度最高的是环境因子中的衬砌(=0.008)和空间因子中的1变量(=0.002),说明这种变化趋势与北运河水系地理空间距离的变化趋势一致,同时也能够很好地表征衬砌对底泥细菌空间差异性的影响.分别与轴负方向和轴正方向夹角较小的TP和大环内酯类则对类群内群落的片段类型多样性结构变异起决定性作用.基于门水平的OTUs片段相对丰度数据矩阵的RDA模型(=3.5,=0.003)筛选出4个环境因子(TP、四环素类、硫酸根离子、衬砌).UR类群和MLR类群的样点同样呈现沿对角线从右下到左上的变化趋势,但较片段类型多样性数据矩阵空间变异小.与群落分布相关程度最高的是环境因子中的TP(=0.022)和衬砌(=0.006),而四环素类抗生素及SO42-则分别对UR类群和MLR类群类内差异起决定性作用.
从组成特性看,基于OTUs片段类型多样性数据矩阵筛选出的纤维杆菌门(Fibrobacteres)、纤细菌门(Gracilibacteria)、酸杆菌门(Acidobacteria)、Acetothermia等和基于OTUs相对丰度数据矩阵筛选出的费希尔菌门(Fischerbacteria)、Kiritimatiellaeota、放线菌门(Actinobacteria)、蓝细菌门(Cyanobacteria)均与衬砌高度相关,进一步印证了河道的衬砌对细菌群落片段多样性和片段丰度的影响主要是由这些门类贡献的.另外,与NMDS排序图(图2)相类似的是,上游河段样点在地理尺度上的幅度和范围大于中下游河段,且这一特点在物种丰度RDA模型中更为显著.

3 讨论
北运河京津冀流域上游(样点1、2、3、4、5)主要以河岸带人工湿地修复为主,人工化程度较低,河道底质主要为淤泥,河岸植被分布较为丰富.流域中下游(样点6、7、8、9、10、11、12、13、14)为流经市区高度人工化城市景观河道,河床底部及驳岸都修有石砌.北运河这种具有不同基底类型的高度人工化的城市河道为研究人工化衬砌作用对河道细菌群落结构影响提供了一个良好的模型系统.
白晓慧等[24]对泥岸和石砌驳岸的河床上覆水中细菌群落的影响分析表明泥岸为细菌群落提供更有利的生存环境,最终泥岸河床上覆水体中细菌群落多样性更高.本研究区上游近自然的河岸带植被生态修复湿地中植物根系和湿地碎石基质具有较高生境异质性,为底泥细菌群落提供丰富的生境类型,最终表现为上游底泥环境拥有更高的微生物群落多样性[25].与上游相比较,中下游衬砌和侧砌基底生境类型单一,这种同质化生境类型显著促进中下游河段底泥中细菌群落同质化.具体表现为:上游较高异质性环境条件使其具有占有较宽的生态幅度[26-29],从而上游样点在NMDS排序图和RDA模型中呈现出更广的分布幅度和格局.与上游相比较,中下游样点受同质化生境条件的影响,微生物群落结构趋于同质化,从而在NMDS排序图和RDA模型中分布更为集中.中游上覆水面频繁的再生水补给过程形成的物理扰动进一步促进环境化学因子源汇同质化效应[30],进而使得频繁补给和衬砌叠加作用下的水生境条件同质化效应更为明显.本研究结果显示上游43.86km空间范围内的微生物群落较中下游120.72km空间范围的微生物群落结构具有更为宽广的生态位幅度和更高的群落空间异质性是衬砌促进河道底泥细菌群落同质化的有力证据.
同质化生境类型导致一些对同质化生境类型较为敏感的物种消失,最终群落丰富度chao1指数和优势组分片段类型多样性显著降低[31-32].其次,以再生水补给为主的河流中,痕量持久性有机污染物抑制河道底泥中微生物活性,进而影响微生物群落结构和功能特征[33].与人工化衬砌条件相比较,近自然生境条件有利于河床基底和包气带的饱和、非饱和渗流条件下发生频繁的水文水质交换,有利于痕量持久性有机污染物的自然净化过程,河岸带植被生态修复带植物根际活跃的微生物群落进一步促进有机物的生物地化循环过程[34-36].本研究近自然生境条件下微生物群落结构具有较高的多样性和丰度进一步佐证微生物群落在生物地化循环过程中的作用[37].而同质化的衬砌条件阻隔了地表水和地下水的水力交换,减缓了地表水渗流过程,进而导致痕量持久性有机污染物在河道底泥中沉积[38].本研究RDA模型中大环内酯类和四环素类抗生素作为再生水补水河流中典型的污染物,显著影响了样点空间分布特征,且表现为随水流方向污染物浓度呈现升高的变化趋势.痕量持久性有机污染物的存在导致底泥中耐受性较高的优势组分丰度和片段类型多样性显著下降,敏感的非优势和非核心组分片段类型多样性增加[39-40].
4 结论
4.1 河道衬砌决定了底泥细菌群落的空间分布.在河道衬砌的影响下,研究区样点被显著分为上游与中下游两大类.上游的5个样点在有限的空间范围内样点分布范围较为广泛,表明微生物群落占有更广泛的生态位幅度.中下游较长的空间范围内9个样点分布较为紧凑,细菌群落具有更高的组内相似性,是生境特征同质化促进生物同质化的结果.
4.2 基于群落多样性和结构分析结果表明:片段类型多样性较丰度对河道衬砌生境条件的改变更为敏感.非优势组分在中下游具有更高的片段类型多样性,优势组分在上游呈现较高的片段类型多样性及相对丰度,最终导致中下游河段细菌群落丰富度指数显著低于上游河段.
4.3 河道衬砌与TP对底泥细菌群落空间分布起到了决定性作用,而大环内酯类与四环素类作为再生水补水河流中的典型污染物显著影响不同类群的内部差异.纤维杆菌门(Fibrobacteres)、纤细菌门(Gracilibacteria)、酸杆菌门(Acidobacteria)、Acetothermia的类型多样性和费希尔菌门(Fischerbacteria)、Kiritimatiellaeota、放线菌门(Actinobacteria)、蓝细菌门(Cyanobacteria)的相对丰度均与衬砌高度相关,进一步证明了衬砌通过影响中下游河段的非优势和非核心物种多样性进而改变其群落结构.
[1] 赵宝刚,张夏彬,昝逢宇,等.洪泽湖表层沉积物氮形态分布及影响因素[J]. 环境科学与技术, 2020,43(6):30-38.
Zhao B, Zhang X, Zan F Y, et al. Distribution and influence factors of nitrogen form in surface sediment of Lake Hongze [J]. Environmental Science & Technology, 202043(6):30-38.
[2] 朱子先.氧化塘底泥中重金属浓度空间分布及其对微生物多样性和底泥环境质量的影响[D]. 哈尔滨:哈尔滨师范大学, 2020.
Zhu Z X. Migration and distribution of heavy metals in oxidation pond sediment and the effects of heavy metals on microbial diversity and sediment quality [D]. Harbin: Harbin Normal University, 2020.
[3] 崔 鹤.基于河流生态修复理论的城市河道景观生态化设计研究[D]. 北京:北京林业大学, 2020.
Cui H. Ecological design of urban channel landscape based on river ecological remediation theory [D]. Beijing: Beijing Forestry University, 2020.
[4] 江和龙,王昌辉,白雷雷,等.湖泊环境科学与工程技术研究进展探讨[J]. 湖泊科学, 2020,32(5):1278-1296.
Jiang H L, Wang C H, Bai L L,et al. Discussion on research progress of lake environmental science and engineering technology [J]. Journal of Lake Sciences, 2020,32(5):1278-1296.
[5] 赵玉龙,刘志飞.古新世—始新世最热事件对地球表层循环的影响及其触发机制 [J]. 地球科学进展, 2007,22(4):341-349.
Zhao Y L, Liu Z F.The impacts of the paleocene-Eocene thermal maximum (PETM) event on earth surface cycles and its trigger mechanism [J].Advances in Earth Science, 2007,22(4):341-349.
[6] 龚 骏,宋延静,张晓黎.海岸带沉积物中氮循环功能微生物多样性 [J]. 生物多样性, 2013,21(4):433-444.
Gong J, Song Y J, Zhang X L. Nitrogen cycling function and microbial diversity in coastal sediments [J]. Biodiversity Science, 2013,21(4): 433-444.
[7] 幸 颖,刘常宏,安树青.海岸盐沼湿地土壤硫循环中的微生物及其作用 [J]. 生态学杂志, 2007,26(4):577-581.
Xin Y, Liu C H, An S Q. Microorganisms and their role in soil sulfur cycle in coastal salt marsh wetland [J]. Chinese Journal of Ecology, 2007,26(4):577-581.
[8] 魏 伟.安徽铜陵地区河流重金属污染、生物多样性研究与评价 [D]. 合肥:安徽大学, 2012.
Wei W. Study and evaluation on heavy metal pollution and biodiversity of rivers in Tongling area, Anhui Province [D]. Hefei: Anhui University, 2012.
[9] Anna S K, Ingemar R. Heavy mental pollution and lake acidity changes caused by one thousand years of coppermining at Faluncentral Sweden [J]. Journal of Paleolimnology, 2001,26(1):89-107.
[10] 陈洪森,魏伟伟,叶 春,等.大型水生植物混合腐解对入湖河口水质的影响及适宜生物量研究[J]. 环境科学研究, 2021,34(3):589-598.
Chen H S, Wei W W, Ye C, et al. Impact of mixed decay of large aquatic plants on water quality in Lake estuaries and suitable biomass study [J]. Research of Environmental Sciences, 2021,34(3):589-598.
[11] 王 蕊.北京地区典型再生水补水型河道水质评价及改善措施研究[D]. 邯郸:河北工程大学, 2020.
Wang L. Evaluation and improvement measures of river quality for typical regenerated water rehydrated systems in Beijing [D]. Handan: Hebei University of Engineering, 2020.
[12] 钦 佩,安树青,颜京松.生态工程学[M]. 南京:南京大学出版社, 2019.
Qing P, An S Q, Yan J S. Ecological engineering [M]. Nanjing: Nanjing University Press, 2019.
[13] 邸琰茗,王广煊,黄兴如,等.再生水补水对河道底泥细菌群落组成与功能的影响 [J]. 环境科学, 2017,38(2):743-751.
DI Y M, Wang G X, Huang X R, et al. Effects of reclaimed water replenishment on the composition and function of bacterial community in river sediment [J]. Environmental Science, 2017,38(2):743-751.
[14] 马栋山,郭羿宏,张琼琼,等.再生水补水对河道底泥细菌群落结构的影响 [J]. 生态学报, 2015,35(20):6742-6749.
Ma D S, Guo Y H, Zhang Q Q, et al. Effect of reclaimed water replenishment on bacterial community structure in river sediment [J]. Acta Ecologica Sinica, 2015,35(20):6742-6749.
[15] 陆彦玮.黄土高原包气带典型水文特征与潜在地下水补给的时空演变研究[D]. 杨凌:西北农林科技大学, 2020.
Lu Y W. Temporal and spatial evolution of typical hydrological characteristics and potential groundwater recharge in the vadose zone of the Loess Plateau [D]. Yang Ling: Northwest University of agriculture and forestry science and technology, 2020.
[16] 杨 峰.健康水循环与新的水策略[D]. 杨凌:西北农林科技大学, 2007.
Yang F. Healthy water cycle and new water strategy [D]. Yang Ling: Northwest University of Agriculture and Forestry Science and Technology, 2007.
[17] 黄婉彬,鄢春华,张晓楠,等.城市化对地下水水量、水质与水热变化的影响及其对策分析[J].地球科学进展, 2020,35(5):497-512.
Huang W B, Yan C H, Zhang X N, et al. Influence of urbanization on groundwater quantity, quality and hydrothermal change and Its Countermeasures [J]. Advances in Earth Science, 2020,35(5):497-512.
[18] 李彦东,李红有.对北运河治理规划的思考 [J]. 海河水利, 2006, (1):24-27.
Li Y D, Li H Y. Thoughts on the management planning of the North Canal [J]. Haihe Water Resources, 2006,(1):24-27.
[19] 董 洁,唐廷贵.天津物种多样性现状及丧失原因分析 [C]//生物多样性与人类未来——第二届全国生物多样性保护与持续利用研讨会论文集.北京:中国林业出版社, 1996:383-387.
Dong J, Tang Y G. Analysis on the current situation and loss of species diversity in Tianjin [C]//Biodiversity and human future -- Proceedings of the second national symposium on biodiversity conservation and sustainable utilization. Beijing: China Forestry Press, 1996:383-387.
[20] Lindstrom E S, Eiler A, Langenheder S,et al. Does ecosystem size determine aquatic bacterial richness? Comment [J]. Ecology, 2007, 1(88):252-253.
[21] 莫 晶,杨青瑞,彭文启,等.生态补水后永定河北京山区段河流生境质量评价[J]. 中国农村水利水电, 2021,(2):30-36.
Mo J, Yang Q R, Peng W Q et al. Evaluation of river habitat quality in Beijing mountainous area of Yongding River after ecological water replenishment [J]. China Rural Water and Hydropower, 2021,(2):30- 36.
[22] 梁灵君.北运河运河核心区地表水资源状况分析[J]. 北京水务, 2021,(1):22-26.
Liang L J. Analysis of surface water resources in the core area of the North Canal [J]. Beijing Water, 2021,(1):22-26.
[23] Du X F, Deng Y, Li S Z, et al. Steeper spatial scaling patterns of subsoil microbiota are shaped by deterministic assembly process [J]. Molecular Ecology, 2020,30(4):1072-1085.
[24] 白晓慧,张晓红,丁路生.城市景观河道不同类型驳岸界面细菌生态研究[J]. 生态与农村环境学报, 2007,0(3):90-92.
Bai X H, Zhang X H, Ding L S. Study on bacterial ecology of different types of revetment interface in urban landscape river [J]. Journal of Ecology and Rural Environment, 2007,(3):90-92.
[25] Beisel J N, Usseglio-Polatera P, Moreteau J C. The spatial heterogeneity of a river bottom: a key factor determining macroinverteb rat communities [J]. Hydrobiologia, 2000,422-423: 163-171.
[26] 林学钰,廖资生,苏小四,等.黄河流域地下水资源及其开发利用对策 [J]. 吉林大学学报(地球科学版),2006,36(5):677-684.
Lin X Y, Liao Z S, Su X S, et al. Groundwater re-sources and their countermeasures of development and utilization in Yellow River Basin [J]. Journal of Jilin University (Earth Science Edition), 2006,36(5): 677-684.
[27] Louw P G B D, Essink G H P O, Stuyfzand P J, et al. Upward groundwater flow in boils as the dominant mechanism of salinization in deep polders, the Netherlands [J]. Journal of Hydrology, 2010,394 (3/4):494-506.
[28] Holman I P, Allen D M, Cuthbert M O, et al. Towards best practice for assessing the impacts of climate change on groundwater [J] Hydrogeology Journal, 2012,20(1):1-4.
[29] Wada M. Genealogy of gas cells for low-energy RI-beam production [J]. Nuclear Instruments & Methods in Physics Research, 2013,317 (12):450-456.
[30] 靳 燕,邱 莹,董 志,等.北运河浮游细菌集合群落空间变化的环境解释[J]. 中国环境科学, 2021,41(3):1378-1386.
Jin Y, Qiu Y, Dong Z, et al. Environmental interpretation of spatial variation of planktonic bacterial community in North Canal [J]. China Environmental Science, 2021,41(3):1378-1386.
[31] 刘 瑜.藻苲淀近自然湿地冷暖季水生植物水质净化作用研究[D]. 北京:北京林业大学, 2019.
Liu Y. Research on the effect of warm season and cold season aquatic plants on purification of zaozhadian near-natural wetland [D]. Beijing: Beijing Forestry University, 2019.
[32] Vinson M R, Hawkins C P. Biodiversity of stream insects: variation at local, basin, and regional scales [J]. Annual Review of Entomology, 1998,43(1):271-293.
[33] 王培京.再生水入渗地下水过程中典型内分泌干扰物的迁移转化研究[D]. 北京:北京林业大学, 2019.
Wang P J. Migration and transformation of typical endocrine disruptors during infiltration of reclaimed water into groundwater [D]. Beijing: Beijing Forestry University, 2019.
[34] 王 静.漓江河岸带土壤微生物群落结构及理化性质的空间分布特征[D]. 北京:北京林业大学, 2019.
Wang J. Spatial distribution characteristics of soil microbial community structure and physical and chemical properties in the riparian zone of Lijiang River [D]. Beijing: Beijing Forestry University, 2019.
[35] Pandit S N, Kolasa J, Cottenie K. Contrasts between Habitat generalists and specialists: An empirical extension to the basic metacommunity framework [J]. Ecology, 2009,90(8):2253-2262.
[36] Barberan A, Bates S T, Casamayor E O, et al. Using network analysis to explore co-occurrence patterns in soil microbial communities [J]. The ISME Journal, 2012,6(2):343-351.
[37] 魏 璇.自然过程主导下的河道修复设计研究[D]. 北京:北京林业大学, 2020.
Wei X. Study on river rehabilitation design under the guidance of natural process [D]. Beijing: Beijing Forestry University, 2020.
[38] 田伟君.河流微污染水体的直接生物强化净化机理与试验研究[D]. 南京:河海大学, 2005.
Tian W J. Mechanism and experimental study on direct bio enhanced purification of slightly polluted river water [D]. Nanjing: Hohai University, 2005.
[39] 刘 蓓,李艳霞,张雪莲,等.兽药抗生素对土壤微生物群落的影响[J]. 生态毒理学报, 2013,8(6):839-846.
Liu B, Li Y X, Zhang X L, et al. Effects of veterinary antibiotics on soil microbial community [J]. Asian Journal of Ecotoxicology, 2013, 8(6):839-846.
[40] Kolasa J, Li B. Removing the confounding effect of habitat specialization reveals the stabilizing contribution of diversity to species variability [J]. Proceedings of the Royal Society of London. Series B: Biological Sciences, 2003,270(suppl_2):S198-S201.
Lining promotes the homogenization of bacterial communities in sediments.
ZHAO Jun-ying1, ZHANG Wei1,GUO Xiao-yu1, SU Zhen-hua2, DI Yan-ming3, DONG Zhi4*
(1.College of Resources Environment and Tourism, Capital Normal University, Beijing 100048, China;2.China National Pulp and Paper Research Institute, Beijing 100022, China;3.Beijing North Canal Manage Office, Beijing 101100, China;4.School of Life Sciences, Peking University, Beijing 100871, China)., 2022,42(2):854~862
Taking the North Canal in Beijing-Tianjin-Hebei Basin as research area., a comparative analysis of bacterial community diversity, composition and pattern of environmental factors between the upstream and the mid-down stream samples was carried out. The results showed that engineering projects of bottom and bank in the mid-down stream of the North Canal of Beijing-Tianjin-Hebei Basin promoted the homogeneity of the bacterial community. Comparing to the spatial scaling patterns of upstream samples (0.0002), the value of bacterial communities in the mid-down stream (0.00002) was significantly lower and the distribution pattern of samples in the NMDS plot was more intensive. The homogenized community in the mid-down stream showed the lower richness due to the higher fragment type of the non-abundant species, lower fragment type and lower relative abundance of the abundant species. The analysis of RDA model (=0.002) showed that the engineering projects, the total phosphorus and the antibiotics of macrolide and tetracycline were the key environmental factors. Engineering projects of bottom and bank was closely related to the diversity of Fibrobacteres, Gracilibacteria, Acidobacteria, Acidothermia and the relative abundance of Fischerbacteria, Kiritimatiellaeota, Actinobacteria, Cyanobacteria.
the North Canal River;sediment;the bacterial community;lining;diversity;spatial change
X172
A
1000-6923(2022)02-0854-09
赵隽莹(1995-),女,北京人,首都师范大学硕士研究生,主要从事环境工程方面的研究.
2021-06-29
北京市自然科学基金-北京市教委联合重点项目(KZ20190028042)联合资助
* 责任作者, 工程师,dongzhi@pku.edu.cn
