电化学氧化法去除兰炭废水中COD和NH3-N
2022-02-25李金城宋永辉汤洁莉
李金城,宋永辉,汤洁莉
电化学氧化法去除兰炭废水中COD和NH3-N
李金城,宋永辉*,汤洁莉
(西安建筑科技大学,陕西省黄金与资源重点实验室,陕西 西安 710055)
采用电氯化氧化法处理高浓度含有机污染物和氨氮的兰炭废水,考查了NaCl添加量、外加电压、初始pH值等对废水中化学需氧量(COD)和氨氮(NH3-N)去除效果的影响,并对电化学氧化过程及污染物氧化机理进行深入分析.研究表明,随着NaCl添加量、外加电压及电解时间的增加,废水中COD与NH3-N去除率逐渐增大.在NaCl添加量为60g/L、电压6V、极板间距10mm、废水初始pH值不变、电解时间3h的条件下,兰炭废水中COD和NH3-N去除率分别为84.31%和95.77%,远高于不添加NaCl时的41.18%和34.10%.废水中COD和氨氮的降解主要归因于间接氧化,阳极反应产生的Cl2水解生成具有强氧化性的ClO-.电解过程中大部分NH3-N在ClO-的作用下转化为N2,而小部分以含氮化合物的形式存在.兰炭废水中有机污染物主要以酚类物质为主,电化学处理后其含量大幅降低,部分会转化为醚类或者烷烃类物质.
电化学氧化;兰炭废水;COD;NH3-N
兰炭是以低变质煤为原料,采用中低温干馏技术生产的固体焦产品,兰炭的生产及原料煤的输送过程中会产生大量的废水,主要包括兰炭熄焦水、煤气净化水和除尘洗涤水[1].除尘洗涤水中含有高浓度悬浮固体煤屑、兰炭颗粒物等,一般经过澄清后可重复使用,而煤气净化水与熄焦水的组成极其复杂,含有大量难降解的有毒污染物,如挥发酚、单环芳烃、多环芳烃、含氮氧杂环芳香化合物、氰化物、硫氰化物和氨氮等[2],此类废水若未经处理直接排放会污染自然水体,导致水体富营养化,对人类健康带来严重隐患[3].
目前,兰炭废水的处理主要是借鉴焦化废水先物化后生化的工艺[4],但是,兰炭废水可生化性差,生化处理过程中容易受到废水中有毒化学物质抑制作用的影响,存在处理难度大、处理不彻底等缺点.为了弥补物化-生化工艺的不足,近些年来研究者不断研究开发新工艺,包括臭氧氧化法[5]、催化湿式氧化法[6]、超临界水氧化法[7]、Fenton试剂氧化法[8]、吸附法[9]等,这些方法在实验室研究中大多取得了较好的效果,但是由于运行成本高、反应条件苛刻等原因,目前均难以实现工业化应用.因此,探索一条经济、高效的处理工艺对我国兰炭产业可持续发展至关重要.
电化学氧化法具有操作简单、环境友好、无二次污染的特点,被认为是一种具有良好发展前景的水处理技术[10],已被用于纺织[11]、炼焦[12]、铅冶炼[13]等行业的废水处理.一般情况下,有机废水的电化学氧化主要通过直接氧化与间接氧化2种方式实现污染物的氧化降解[14].直接氧化是在外电场作用下,有机污染物在电极表面直接发生氧化还原反应,而间接氧化则主要是利用电解过程中产生强氧化性的中间介导(如羟基自由基[15]、活性氯等)氧化降解污染物.研究表明,以氯离子作为电解质,电化学氧化产生的活性氯组分(Cl2、HClO、ClO-)可处理典型的有机污染物.王栗等[16]采用电化学氧化法处理模拟酸性大红3R染料废水,在初始浓度500mg/L,自制催化剂投加量50g,pH值为4,槽电压22V,曝气量0.08m3/h,极板间距为3.0cm,90min后脱色率达到75.3%,COD和TOC去除率分别达到65.4%和46.0%,而加入0.05mol/LNaCl后,脱色率为95.3%,促进染料废水的降解. Singha等[17]对孔雀石绿模拟的印染废水(MG)进行处理,在初始浓度150mg/L,电流密度168.9A/ m2,NaCl浓度为0.6g/L,pH值为4.5,140min后MG中色度完全去除,COD去除率为98%.Zhu等[18]以Ti/RuO2-IrO2为阳极处理苯胺废水,浓度为50mg/L,电流密度40mA/cm2,NaCl添加量为0.1mol/L,TOC的去除率为63.1%.综上所述,加氯电化学氧化法常用于处理低浓度工业废水或模拟废水,处理高浓度、成分复杂的工业兰炭废水的研究却鲜有报道.因此,以氯离子为电解质,研究电化学氧化参数对兰炭废水中污染物处理效果的影响及过程机理,对处理含有无机盐类兰炭废水的治理具有重要的理论和实践意义.
本文采用电化学氧化法处理兰炭废水中COD和NH3-N,重点考查NaCl添加量、电压等对污染物降解过程的影响及其反应机制,以期为兰炭废水的高效去除提供技术支持,进一步推动兰炭产业的节能减排与技术进步.
1 材料与方法
1.1 实验原料
实验所用废水来源于陕西榆林某兰炭生产企业,兰炭废水外观呈棕黑色,主要含有油类物质、挥发酚、氨氮等有机物质,水质参数测试结果如表1所示.

表1 兰炭废水主要成分
1.2 实验方法
采用石墨为阳极,尺寸为50mm×30mm×2mm,阴极采用相同大小的钛合金.阴阳极分别通过导线与直流电源连接,调节极板间距,平行放置且浸入水中的高度保持一致.废水体积为100mL,磁力搅拌速率控制在120r/min,电解氧化一定时间后进行液固分离,测定废水中COD与NH3-N含量,计算去除率.电解氧化处理兰炭废水的装置连接如图1所示.
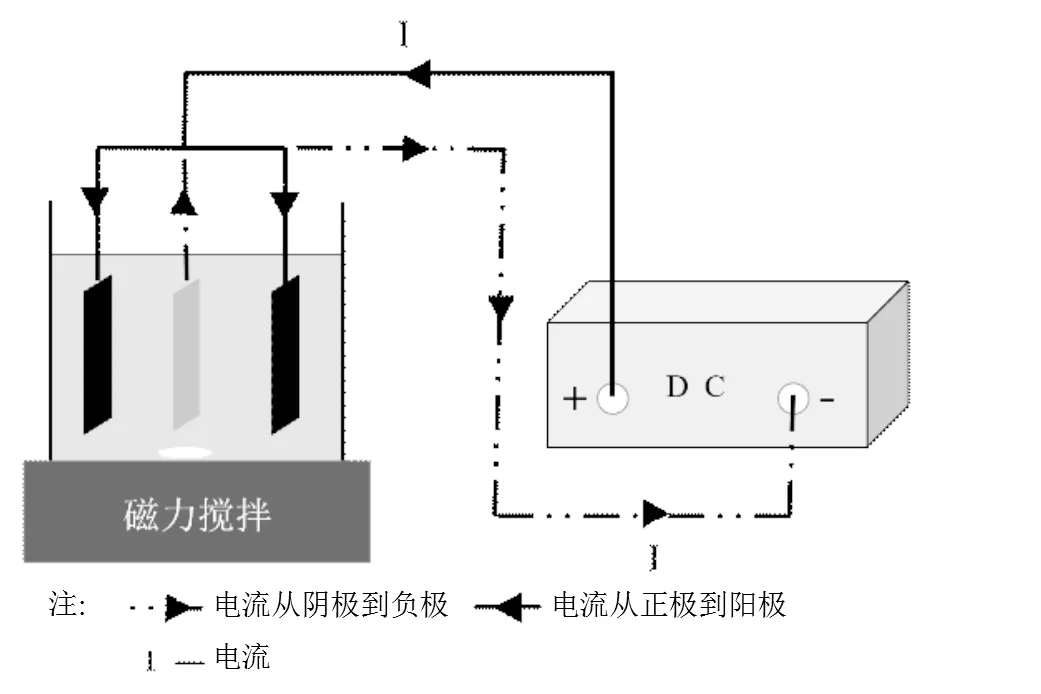
图1 电化学氧化处理兰炭废水装置示意
1.3 分析方法
水样中COD和NH3-N含量分别采用国标重铬酸钾法、蒸馏-中和滴定法进行测定,按照式(1)和式(2)计算去除率;采用国标GB11896-89硝酸银滴定法测定溶液中氯离子含量[19],电解过程中产生的ClO-和Cl2含量按照文献[20]采用硫代硫酸钠滴定法进行测定.采用Elementar Varion EL cube测定水样中总氮(TN)的含量.循环伏安曲线采用电化学工作站进行测试,以石墨板作为工作电极,石墨棒作为对电极,饱和甘汞电极作为参比电极,电压扫描范围±3V,扫描速率为100mV/s.


式中:[COD]0、[NH3-N]0分别指废水中COD与NH3-N的含量,mg/L;[COD]、[NH3-N]分别为处理后COD与NH3-N的含量,mg/L.
采用气相色谱-质谱(Agilent 7890A-5975C)对废水中有机成分进行测试,样品预处理和测试方法按照文献[7]进行.
2 结果与讨论
2.1 NaCl添加量的影响
在不改变废水pH值,外加电压为6V、极板间距为20mm的条件下,改变NaCl添加量进行实验,结果如图2所示.随着NaCl添加量的增加,兰炭废水中COD与NH3-N的去除率逐渐增加,50g/L时废水中COD去除率达到最大值76.47%,随后继续增加, COD去除率不再发生大的变化,而NH3-N去除率则继续增加,NaCl添加量60g/L时达到最大值78%.NaCl添加量增加,废水中Cl-浓度增加,与此同时电解产生Cl2的量也增加,导致电解过程中产生的ClO-浓度增加[21],有机污染物与氨氮与其发生间接氧化反应,生成小分子物质从而被降解.当NaCl添加量大于60g/L时,由于ClO-的阴极消耗和阳极氧化等反应的存在[22-23](式(3)~(4)),使得溶液体系中ClO-的生成量减小,COD与NH3-N的去除率反而有所降低.
6ClO-+3H2O→2ClO3-+4Cl-+6H++1.5O2+6e-(3)
ClO-+H2O→Cl-+2OH--2e-(4)

图2 NaCl添加量对COD和NH3-N去除率的影响
2.2 外加电压的影响
NaCl添加量为60g/L时,改变外加电压进行实验,结果如图3所示.随着外加电压的升高,兰炭废水中COD和NH3-N的去除率增加,6V时废水中COD的去除率达到最大,随后保持不变,而NH3-N去除率则继续增加,7V时达到最大值81.63%.外加电压升高,体系中的电流密度增加,反应速率加快,促进了电子在电极表面的转移,使得溶液中的Cl-快速转化为较多的活性组分,间接氧化降解污染物的作用增强[24],最终导致COD与NH3-N去除率增大.但是外加电压过高,会促使阳极的析氧副反应更容易发生[25],析氯和析氧标准电势电位分别为1.385 和1.229V,析氧电位要低于析氯电位.从动力学角度来看,析氯反应是快速的双电子转移过程,析氧反应则是四电子转移过程,相比之下析氯反应更容易发生[26].另外,析氧反应的存在会导致阳极电流效率的降低,电极表面附着大量微气泡阻碍有机物的氧化,而且高电压会导致能耗增加.

图3 电压对COD和NH3-N去除率的影响
2.3 废水初始pH值的影响
外加电压为6V,调节废水初始pH值进行实验,结果如图4所示.随着pH值的增加,兰炭废水中COD和NH3-N的去除率逐渐增加,pH=9时NH3-N去除率达到最大;随后继续增加pH值,NH3-N去除率反而减小,COD去除率随初始pH值增加则一直保持增加趋势.酸性条件下(pH<7),电解产生的氯气来不及转化为ClO-参与氧化反应,容易从废水表面逸出[27],造成有效氯的浪费,不利于间接氧化反应的发生,导致COD和氨氮去除率较低.当7
ClO3-+H2O→ClO4-+2H++2e-(5)
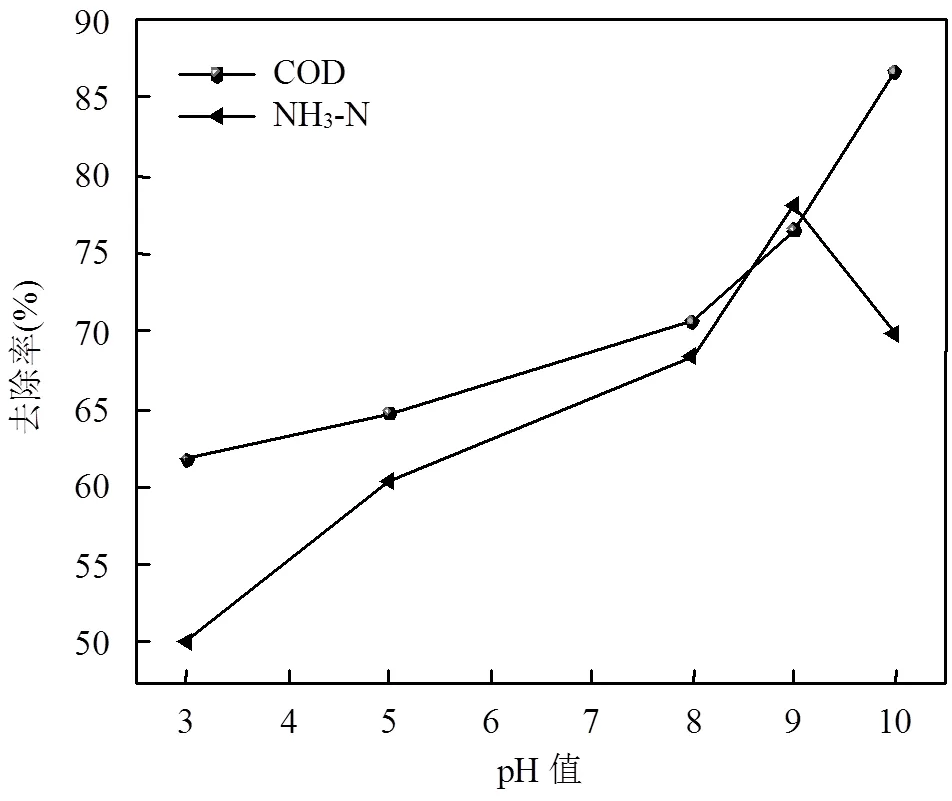
图4 初始pH值对COD和NH3-N去除率的影响
2.4 极板间距的影响

图5 极板间距对COD和NH3-N去除率的影响
不改变废水的初始pH值,改变极板间距进行实验,结果如图5所示.随着极板间距的增加,兰炭废水中COD和NH3-N去除率逐渐减小.极板间距增加,电子传质距离增加,电解过程中产生的强氧化性物质的扩散距离增加,电荷快速传递的阻力加大,电解反应速率就会逐步减慢.
2.5 电解时间的影响

图6 电解时间对COD和NH3-N去除率的影响及过程温度变化
极板间距为10mm,改变电解时间进行实验,结果如图6所示.随着电解时间的增加,兰炭废水中COD和NH3-N去除率逐渐增加,废水颜色由棕红色逐步转变为浅红色,直至无色,3h后COD和NH3-N去除率分别为85.88%和97.80%.随着电解时间的继续增加,COD和NH3-N去除率虽然仍在增大,但变化幅度不是很明显.兰炭废水中易生色和助色基团主要包括不饱和键官能团、未共用电子对以及含有共用电子对的氧原子、氮原子或卤原子,其中不饱和键官能团包括C=O、-COOH以及N=O等,含有共用电子对的原子基团包括-OH、-NH2等.随着电解时间延长,易生色基团与助色基团逐渐降解生成其他小分子物质,导致废水的色度逐渐减小,COD去除率增加.对电解过程体系温度变化进行监测,结果如图6所示.电解体系温度先急剧升高,2h以后趋于平稳,维持在39℃左右.电解开始时电解液中的阴阳离子快速向电极表面定向移动,一方面剧烈的电极反应可能会导致温度升高;另一方面部分电能转化为热能损失也会促使温度的升高.因此,综合考虑选择最佳电解时间为3h.
2.6 电解过程中溶液中氯离子浓度的变化
在电压6V、NaCl添加量60g/L、极板间距10mm、初始pH值为9的条件下,考查电解过程中废水中Cl-浓度随时间的变化,如图7所示.随着时间的延长溶液中氯离子浓度逐渐降低,电解过程中Cl-向阳极移动并发生氧化反应,生成Cl2等活性组分.3h时溶液中残余氯离子浓度为33.3g/L,随后基本保持不变.值得注意的是,由于废水中有机污染物和氨氮含量较高,氯化钠的加入量较大,会引起处理后水中的氯离子浓度超标造成二次污染,进一步的研究应关注如何降低NaCl添加量或者将残留的氯离子循环利用.

图7 氯离子浓度随时间的变化曲线
2.7 验证性实验
在不改变兰炭废水初始pH值,极板间距为10mm,NaCl添加量为60g/L,外加电压6V,电解时间3h的条件下进行平行实验,同时在不添加NaCl的条件下进行空白实验,结果如表2所示.添加NaCl时,3组实验所测得的COD和氨氮的去除率变化不大,平均去除率分别为84.31%和95.77%,而空白组中COD和NH3-N的去除率分别为41.18%和34.10%,不添加NaCl时电解过程中有机物和氨氮在阳极发生直接氧化[12-13,31],但其直接降解难度很大,添加NaCl可利用溶液中产生的强氧化性的Cl2、HClO或ClO-将污染物去除,故去除率显著增强,说明采用加氯电化学氧化处理高浓度兰炭废水是有效可行的.

表2 验证性实验结果
2.8 污染物降解过程分析
分别以60g/L NaCl溶液与NaCl+兰炭废水(NaCl+W)作为电解液进行循环伏安曲线的测定,结果如图8所示.2种体系中都出现了明显的还原峰,而且纯NaCl溶液中峰值较大.电场作用下Cl-定向迁移至阳极表面被氧化为氯气,失去的电子附着于阳极表面.氯具有很高的电子亲和力(349kJ/mol),随着阳极电势逐渐降低,氯气水解产生的活性氯很容易得到电子又返回形成Cl-.当电解质溶液中的自由电子被活性氯完全消耗时,活性氯只能从阳极表面重新捕获电子,这会使阳极产生的电流瞬时转化为还原电流,形成还原峰,还原峰积分的大小可以表示阳极表面活性氯的数量[32-34].NaCl溶液中还原峰强度较大,表明阳极材料上吸附有较多的活性氯组分,而有兰炭废水的溶液中还原峰值较小,主要是因为活性氯与废水中有机污染物和氨氮发生氧化反应,导致阳极吸附活性氯的数量减少,还原峰值减弱.此外,CV曲线未出现明显的氧化峰,这说明体系中的污染物在阳极表面的直接氧化作用小或者基本不发生直接氧化.因此,以石墨极板为阳极时,兰炭废水中有机污染物和氨氮等污染物的氧化降解主要归因于体系中产生的活性氯组分的间接氧化,而不是在阳极表面的直接氧化.
在间接氧化过程中,兰炭废水中氨氮和有机污染物的降解主要是由于电解产生具有强氧化性的活性氯组分(Cl2、HClO及ClO-),HClO较不稳定易发生分解转化为ClO-,如式(6).为了说明电解过程中Cl2和ClO-的氧化作用,在极板间距10mm、外加电压6V、初始pH值为9的条件下进行实验,分别以60g/L NaCl和NaCl+W溶液作为电解液,Cl2与ClO-的含量随时间的变化如图9所示.NaCl+W体系中ClO-与Cl2含量明显低于NaCl溶液,随着时间的延长ClO-含量逐渐升高.电解过程中Cl-在阳极发生氧化反应析出Cl2,Cl2和OH-反应生成ClO-(式(7))[34], ClO-与污染物快速反应导致其大量消耗.随着污染物含量逐渐减少,用于氧化反应的ClO-逐渐减少,溶液中残留的ClO-与Cl2含量开始逐渐增加.此外,还考查了在最佳电解条件下溶液pH值随时间的变化,如图9所示.可以看出,随着电解时间的延长,体系pH值逐渐降低.原因主要是在碱性条件下除水解反应(式(8))外,Cl2还会和溶液中的OH-反应,这些反应都会导致体系内的OH-被消耗,H+浓度增加,pH值逐渐降低,而2h后溶液pH值显酸性,说明体系中活性氯组分主要以ClO-为主[36].

图8 阳极材料的循环伏安特性曲线
HClO→H++ClO-(6)
Cl2+2OH-→ClO-+H2O+Cl-(7)
Cl2+H2O→HClO+Cl-+H+(8)
在最佳电解条件下对处理前后废水中TN (NH4+-N,NO3-N及含氮有机物)含量进行测定.经过电解处理后出水的总氮含量由进水的1299mg/ L降低至344mg/L.TN含量大幅下降主要原因是电解过程中产生的ClO-与氨氮反应生成N2,如式(9)~(15)[37],但是此时溶液中仍然有少量含氮化合物的存在,表明电解过程中产生的无机氮/有机氮的中间含氮化合物,如NO3-、NO2-,如式(16)~(18).由此可以看出,大部分NH3-N在ClO-的作用下转化为N2,小部分主要发生不完全转化以含氮形式的副产物存在于溶液中很难通过电化学氧化法去除[13],此结果与目前其他研究者的研究结果基本一致.

图9 电解过程中活性氯含量、溶液pH值随时间的变化
NH4++ClO-→NH2Cl+H2O (9)
NH2Cl+ClO-→NHCl2+OH-(10)
2NH2Cl+NH2Cl→N2+2H++3Cl-+H2O (11)
NHCl2+ClO-→NCl3+OH-(12)
NHCl2+H2O→NOH+2H++2Cl-(13)
NH2Cl+NOH→N2+H++Cl-+H2O (14)
NHCl2+NOH→N2+2H++2Cl-(15)
NH+ 4+4HClO→NO- 3+H2O+6H++4Cl-(16)
4NH2Cl+3H2O→NO- 3+3NH3+5H++4Cl-(17)
NO3-+2H++2e-→NO- 2+H2O (18)
2.9 污染物降解过程分析
采用气相色谱-质谱(GC-MS)确定电解前后废水中有机物质的组成及其相对含量,如表3所示.可以看出,原废水中有机污染物主要以酚类和烷烃类为主,其中苯酚、4-乙基苯酚等占比在90%以上;电化学氧化处理后的废水酚类物质的吸收峰基本消失,含有少量的烷烃类和醚类物质,说明在电化学氧化过程中酚类物质可能会转化为醚类或者烷烃类物质,最终在ClO-的氧化作用降解为H2O、CO2及其他小分子物质[38-41].
综上所述,在外加电压6V条件下采用电解氧化法处理兰炭废水,阳极实际电压理论上要高于析氧与析氯反应的标准电位,此时溶液中Cl-和OH-均有可能在阳极发生反应,如式(19)、式(20),Cl-的两电子转移反应更容易发生且在较高Cl-浓度下,析氧反应的作用极小可忽略[42-43].阴极主要以析氢反应为主,如式(21)所示.电化学氧化处理兰炭废水中COD和NH3-N过程如图10所示.加入电解质NaCl,在电场力的作用下Cl-定向迁移至阳极附近,在阳极表面失电子发生阳极氧化反应生成Cl2,碱性条件下Cl2进一步发生水解等反应转化为ClO-,溶液中活性氯组分主要以ClO-为主,废水中有机污染物及氨氮在ClO-的作用下发生间接氧化反应被降解为H2O、CO2、N2等其他小分子物质.
阳极反应:
2Cl-→Cl2+2e-=1.385V (19)
2H2O→O2+4H++4e-=1.229V (20)
阴极反应:
2H2O→2OH-+H2-2e-=0.83V (21)

表3 处理前后水样的有机成分组成

图10 兰炭废水中污染物的降解机理示意
3 结论
3.1 以石墨为阳极,钛合金为阴极采用电氯化氧化法可有效处理高浓度的兰炭生产废水,当NaCl添加量60g/L、电压6V、极板间距10mm、电解时间3h、不改变废水初始pH值的条件下,废水中COD和NH3-N的去除率分别为84.31%和95.77%.电解过程中温度逐渐上升,pH值逐渐下降.
3.2 兰炭废水中有机污染物和氨氮等污染物的氧化降解主要归因于体系中活性氯组分的间接氧化,而不是在阳极表面的直接氧化.NaCl+W体系中ClO-和Cl2含量明显低于NaCl溶液中含量,电解过程中ClO-作为主要的氧化剂降解废水中的污染物.
3.3 氨氮在ClO-的作用下被降解为N2,极少部分被降解为含氮化合物,GC-MS分析表明有机污染物主要是在ClO-的作用下被氧化分解为H2O、CO2等小分子物质,部分酚类物质可能会转化为醚类或者烷烃类物质.
[1] Chen B, Yang S, Wu Y, et al. Intensified phenols extraction and oil removal for industrial semi-coking wastewater: A novel economic pretreatment process design [J]. Journal of Cleaner Production, 2020,242:118453.
[2] 罗金华,盛 凯.兰炭废水处理工艺技术评述[J]. 工业水处理, 2017,37(8):15-19.
Luo J H, Sheng K. Comments on the treatment technology of semi-coking wastewater [J]. Industrial Water Treatment, 2017,37(8): 15-19.
[3] Ma X Y, Wang X C, Liu J, et al. Variations in toxicity of semi-coking wastewater treatment processes and their toxicity prediction [J]. Ecotoxicology and Environmental Safety, 2017,138:163-169.
[4] Liu Y, Liu J, Zhang A, et al. Treatment effects and genotoxicity relevance of the toxic organic pollutants in semi-coking wastewater by combined treatment process [J]. Environmental Pollution, 2017,220: 13-19.
[5] Liu Z Y, Teng Y, Xu Y H, et al. Ozone catalytic oxidation of biologically pretreated semi-coking wastewater (BPSCW) by spinel-type MnFe2O4magnetic nanoparticles [J]. Separation and Purification Technology, 2020,278:118277.
[6] 姚 珏.催化湿式过氧化氢氧化法处理兰炭废水的研究[D]. 西安:西北大学, 2013.
Yao J. Study on the treatment of blue charcoal wastewater by catalytic wet hydrogen peroxide oxidation [D]. Xi'an: Northwest University, 2013.
[7] Li J N, Wang S Z, Li Y H, et al. Supercritical water oxidation of semi-coke wastewater: Effects of operating parameters, reaction mechanism and process enhancement [J]. Science of the Total Environment, 2020,710:134396.
[8] 高雯雯,张智芳,陈 碧,等.Fenton技术处理兰炭废水实验研究[J]. 当代化工, 2017,46(6):1072-1074.
Gao W W, Zhang Z F, Chen B, el at. Study on treatment of semi- coking wastewater by fenton progress [J]. Contemporary Chemical Industry, 2017,46(6):1072-1074.
[9] 高雯雯,弓 莹,高艳宁,等.负载铈-锰活性炭对兰炭废水的吸附研究[J]. 硅酸盐通报, 2017,36(1):197-204.
Gao W W, Gong Y, Gao Y N, et al. Adsorption of semi-coking wastewater on activated carbon loaded cerium and manganese [J]. Bulletin of the Chinese Ceramic Society, 2017,36(1):197-204.
[10] 张 瑞,赵 霞,李庆维,等.电化学水处理技术的研究及应用进展[J]. 水处理技术, 2019,45(4):11-16.
Zhang R, Zhao X, Li Q W, et al. Research and Application Progress of Electrochemical Water Treatment Technology [J]. Technology of Water Treatment, 2019,45(4):11-16.
[11] Orts F,Río A, Molina J, et al. Electrochemical treatment of real textile wastewater: Trichromy Procion HEXL [J]. Journal of Electroanalytical Chemistry, 2018,808(4):387-394.
[12] Iskurt C, Keyikoglu R, Kobya M, et al. Treatment of coking wastewater by aeration assisted electrochemical oxidation process at controlled and uncontrolled initial pH conditions [J]. Separation and Purification Technology, 2020,248:117043.
[13] Meng X S, Khoso S A, Jiang F, et al. Removal of chemical oxygen demand and ammonia nitrogen from lead smelting wastewater with high salts content using electrochemical oxidation combined with coagulation–flocculation treatment [J]. Separation and Purification Technology, 2020,235:116223.
[14] Martinez-Huitle C A, Ferro S. Electrochemical oxidation of organic pollutants for the wastewater treatment: direct and indirect processes [J]. Chemical Society Reviews, 2006,35(12):1324-1340.
[15] 毕 强,薛娟琴,郭莹娟,等.电芬顿法去除兰炭废水COD [J]. 环境工程学报, 2012,6(12):4310-4314.
Bi Q, Xue J Q, Guo Y J, et al. COD removal from real semi-coke wastewater by electro-Fenton technology [J]. Chinese Journal of Environmental Engineering, 2012,6(12):4310-4314.
[16] 王 栗,岳 琳,郭建博,等.FePMo12催化电化学反应降解染料废水的研究[J]. 环境科学, 2014,35(5):1843-1849.
Wang L, Yue L, Guo J B, et al. Study on FePMo12catalyzed electrochemical degradation of dye wastewater [J]. Environmental Science, 2014,35(5):1843-1849.
[17] Singha S, Lo S L, Srivastav V C, et al. Comparative study of electrochemical oxidation for dye degradation: Parametric optimization and mechanism identification [J]. Journal of Environmental Chemical Engineering, 2016,4(3):2911-2921.
[18] Zhu X, Hu W, Feng C, et al. Electrochemical oxidation of aniline using Ti/RuO2-SnO2and Ti/RuO2-IrO2as anode [J]. Chemosphere, 2021,269:128734.
[19] GB 11896-89 水质氯化物的测定 [S].
GB 11896-89 Water quality determination of chloride [S].
[20] 陈世澄.氯碱工业分析 [M]. 北京:石油化学工业出版社, 1976: 29-35.
Chen S C. Analysis of chlor-alkali industry [M]. Beijing: Petrochemical Industry Press, 1976:29-35.
[21] Comninellis C, Nerini A. Anodic oxidation of phenol in the presence of NaCl for wastewater treatment [J]. Journal of Applied Electrochemistry, 1995,25(1):23-28.
[22] 张月锋,金一中,徐 灏.电解阳极间接氧化法处理制药废水的研究[J]. 工业水处理, 2002,22(11):22-24.
Zhang Y F, Jin Y Z, Xu H. Study on the treatment of pharmaceutical wastewater by electrolytic anode indirect oxidation method [J]. Industrial Water Treatment, 2002,22(11):22-24.
[23] Pillai I, Gupta A K. Anodic oxidation of coke oven wastewater: Multiparameter optimization for simultaneous removal of cyanide, COD and phenol [J]. Journal of Environmental Management, 2016, 176(1):45-53.
[24] Ghimire U, Jang M, Jung S, et al. Electrochemical removal of ammonium nitrogen and COD of domestic wastewater using platinum coated titanium as an anode electrode [J]. Energies, 2019,12(5):2-13.
[25] 武世煊,张 峰,杨 帆,等.高铁酸钾辅助PAC混凝沉淀+电化学氧化处理乳化液废水研究[J]. 现代化工, 2021,41(2):193-197,202.
Wu S X, Zhang F, Yang F, et al. Study on joint of emulsion wastewater by potassium ferrate-assisted PAC coagulation precipitation and electrochemical oxidation [J].Modern Chemical Industry, 2021,41(2):193-197,202.
[26] Exner K S. Controlling stability and selectivity in the competing chlorine and oxygen evolution reaction over transition metal oxide electrodes [J]. Chemelectrochem, 2019,6(13):3401-3409.
[27] Zhu X, Ni J, Peng L. Advanced treatment of biologically pretreated coking wastewater by electrochemical oxidation using boron-doped diamond electrodes [J]. Water Research, 2009,43(17):4347-4355.
[28] Mohan N, Balasubramanian N, Basha C A. Electrochemical oxidation of textile wastewater and its reuse [J]. Journal of Hazardous Materials, 2007,147(1):644-651.
[29] Vijayaraghavan K, Ahmad D, Lesa R. Electrolytic treatment of beer brewery wastewater [J]. Industrial & Engineering Chemistry Research, 2006,45(20):6854-6859.
[30] 缪 佳,陈开榜,朱 佳,等.氯酸盐对电镀废水COD检测的掩蔽机理初步分析[J]. 中国给水排水, 2018,34(23):80-84.
Miao J, Chen K B, Zhu J, et al. Preliminary analysis on masking mechanism of chlorate on COD detection of electroplating wastewater [J]. China Water & Wastewate, 2018,34(23):80-84.
[31] Kapałka A, Joss L, Anglada Á, et al. Direct and mediated electrochemical oxidation of ammonia on boron-doped diamond electrode [J]. Electrochemistry Communications, 2010,12:1714–1717.
[32] Kao C L, Chang C W, Hu P Y, Electrochemical study of the oxidation on ammonia and cyanide by cyclic voltammetry [J]. International Journal of Materials Engineering, 2016,6(4):126-133.
[33] KapaKa A, Katsaounis A, Michels N L, et al. Ammonia oxidation to nitrogen mediated by electrogenerated active chlorine on Ti/PtOx-IrO2[J]. Electrochemistry Communications, 2010,12(9):1203-1205.
[34] Reyter D, Bélanger D, Roué L. Nitrate removal by a paired electrolysis on copper and Ti/IrO2coupled electrodes - Influence of the anode/cathode surface area ratio [J]. Water Research, 2010,44(6): 1918-1926.
[35] Ozturk D, Yilmaz E. Treatment of slaughterhouse wastewater with the electrochemical oxidation process: Role of operating parameters on treatment efficiency and energy consumption [J]. Journal of Water Process Engineering, 2019,31:100834.
[36] Hao J W, Zhao S, Mao R, et al. Activation of peroxymonosulfate by cobalt doped graphitic carbon nitride for ammonia removal in chloride-containing wastewater [J]. Separation and Purification Technology, 2021,271:118858.
[37] Zheng W X, Zhu L Y, Liang S, et al. Discovering the importance of ClO• in a coupled electrochemical system for the simultaneous removal of carbon and nitrogen from secondary coking wastewater effluent [J]. Environmental Science & Technology, 2020,54(14):9015- 9024.
[38] 周明华,吴祖成,汪大翚.难生化降解芳香化合物废水的电催化处理 [J]. 环境科学, 2003,24(2):121-124.
Zhou M H, Wu Z C, Wang D H. Electrocatalytic treatment of wastewater difficult to biodegrade aromatic compounds [J]. Environmental Science, 2003,24(2):121-124.
[39] Rajkumar D, Palanivelu K. Electrochemical treatment of industrial wastewater [J]. Journal of Hazardous Materials, 2004,113(3):123-129.
[40] Raghu S, Chang W L, Chellammal S, et al. Evaluation of electrochemical oxidation techniques for degradation of dye effluents- a comparative approach. [J]. Journal of Hazardous Materials, 2009, 171(1):748-754.
[41] 王 璇,黄卫民,刘小波,等.氯离子对苯酚电化学氧化降解过程的影响[J]. 高等学校化学学报, 2011,32(2):361-365.
Wang X, Huang W M, Liu X B, et al. Effect of chloride ion on the electrochemical degradation process of phenol [J]. Chemical Journal of Chinese Universities, 2011,32(2):361-365.
[42] Vos J, Koper M. Measurement of competition between oxygen evolution and chlorine evolution using rotating ring-disk electrode voltammetry [J]. Journal of Electroanalytical Chemistry, 2018,819: 260-268.
[43] Zambrano J, Min B. Comparison on efficiency of electrochemicalphenol oxidation in two different supporting electrolytes (NaCl and Na2SO4) using Pt/Ti electrode [J]. Environmental Technology & Innovation, 2019,15:100382.
Removing of COD and NH3-N from blue-coke wastewater by electrochemical oxidation.
LI Jin-cheng, SONG Yong-hui*, TANG Jie-li
(Shaanxi Key Laboratory of Gold and Resource, Xi'an University of Architecture and Technology, Xi’an 710055, China)., 2022,42(2):697~705
Electro-chlorination and oxidation method was applied to treat the high concentration harmful components in blue-coke wastewater. The influence of dosage of sodium chloride bearing, external voltage, and initial pH on removal efficiency of chemical oxygen demand (COD) and ammonia nitrogen (NH3-N) were investigated, the processing and pollutant oxidation mechanism of electrochemical oxidation were systematical analyzed. The results indicated that the removal efficiency of COD and NH3-N both increased with the increasing of the addition of dosage of sodium chloride, applied voltage, and electrolysis time. Under the processing condition of sodium chloride 60g/L, voltage 6V, electrode distance 10mm, initial pH 9, and 3h electrolysis time, the COD and NH3-N removal efficiency reached 84.31% and 95.77% respectively, which extremely exceeded the removal efficiency 41.18% and 34.10% without NaCl as the electrolyte. The degradation of COD and NH3-N mainly depended on indirect oxidation of anode, the chlorine gas produced on the anode would occur hydrolysis reaction to produce active chlorine such as ClO-in the solution. During electrolysis, most of ammonia nitrogen were converted to N2at the action of ClO-, and a small part existed in form of the compounds of containing nitrogen in the bulk solution. The major organic pollutants, phenolic substances in blue-coke wastewater decreased greatly after treatment, part of them could be converted into ethers or alkanes.
electrochemical oxidation;blue-coke wastewater;chemical oxygen demand (COD);ammonia nitrogen (NH3-N)
X703
A
1000-6923(2022)02-0697-09
李金城(1996-),男,陕西商洛人,西安建筑科技大学硕士研究生,主要研究方向为资源回收与综合利用.
2021-05-18
陕西省自然科学联合基金项目(2019JLM-44)
* 责任作者, 教授, syh1231@126.com
