鹿血晶对顺铂诱导小鼠急性肾损伤的保护作用
2022-02-25金佳琦梁秀睿张誉馨傅继华
张 怡, 徐 凡, 金佳琦, 梁秀睿, 张誉馨, 关 晶, 傅继华
(中国药科大学基础医学与临床药学学院,江苏 南京 210009)
鹿血是鹿科动物梅花鹿或马鹿的血,含有丰富的营养物质,其中主要是蛋白质,还含有多种有益微量元素[1]。临床观察证明鹿血在升高放、化疗病人白细胞有显著的作用,尤其适用于肿瘤放、化疗后白细胞减少、血小板下降、补充营养、改善恶病质。具有延缓衰老,增强免疫,补血,抗疲劳和补肾益精等作用[2]。鹿血及鹿茸血临床多用于促进新陈代谢功能, 增强体质[1]。目前已经制成茸血精、复方茸血胶囊等制剂,本实验用的鹿血晶为鹿血的冷冻干燥制剂。
急性肾损伤(Acute kidney injury,AKI)具有高致病率和致死率,发生时肾脏出现明显的氧化应激[3]、炎症[4]与细胞凋亡[5],从而导致肾功能下降,临床上表现为血尿素氮(Blood urea nitrogen,BUN)、血清肌酐(Serum creatinine,Scr)水平的升高、蛋白尿的出现等[6-7]。肿瘤化疗药物的毒副作用常发生AKI,如顺铂是临床上常用的肿瘤化疗药物之一,其毒副作用以肾毒性最为严重,可诱发AKI[8]。由于缺乏有效的药物治疗,肾脏替代治疗是目前西医治疗AKI的主要措施[9]。传统中医认为,AKI的产生主要是“毒为先导、因毒致瘀,毒瘀互结”,治疗上以祛邪扶正,清热解毒、通腑化浊、活血化瘀、补益脾肾、益气养阴、回阳救逆等为原则[10]。现代药理研究显示,鹿血类制品具有补精益气的功效[11],故可能对肾脏疾病有疗效。本实验通过建立顺铂诱导的小鼠AKI模型,来观察鹿血晶预防性给药对AKI的抑制效应及对肾脏的保护作用,以期为鹿血晶的临床应用提供现代药理学依据。
1 材料
1.1 动物 清洁级ICR雄性小鼠,6~8周龄,体质量18~22 g,购自扬州大学比较医学中心,动物生产许可证号SCXK(苏)2017-0007,饲养于中国药科大学药学动物实验中心(玄武校区)[动物使用许可证号SYXK(苏)2016-0011],于正常实验条件下喂养,环境温度恒温26 ℃,相对湿度50%~55%,光照/黑暗12 h/12 h,定期更换垫料及饮用水。所有实验条件及方案均符合中国药科大学药学动物实验中心伦理审查标准。
1.2 试剂与药物 鹿血晶冻干粉末(苏州红冠庄国药股份有限公司,批号L190504)。顺铂(CAS号15663-27-1),购自上海阿拉丁生化科技股份有限公司;Scr(货号C011-2-1)、BUN(货号C013-2-1)、白蛋白(Albumin,ALB,货号A028-2-1)、还原型谷胱甘肽(Glutathione,GSH,货号A006-2-1)、丙二醛(Malondialdehyde,MDA,货号A003-1-2)、超氧化物歧化酶(Superoxide dismutase,SOD,货号A001-3-2)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px,货号A005-1-2)检测试剂盒,均购自南京建成生物工程研究所;活性氧簇(Reactive oxygen species,ROS,货号ml009876)、肿瘤坏死因子α(Tumor necrosis factor-α,TNF-α,货号ml209807)、白细胞介素1β(Interleukin-1β,IL-1β,货号ml063132)酶联免疫分析试剂盒,均购自上海酶联生物科技有限公司;Hoechst 33342活细胞染色液(货号C1028),购自上海碧云天生物科技有限公司;NF-κB p65抗体(货号WL01273b)、磷酸化NF-κB p65抗体(p-NF-κB p65,货号WL02169)、IκBα抗体(货号WL01936)、磷酸化IκBα抗体(p-IκBα,货号WL02495)、p38抗体(货号WL00764)、磷酸化p38抗体(p-p38,货号WL03428)、JNK抗体(货号WL01295)、磷酸化JNK抗体(p-JNK,货号WL01813)、促凋亡蛋白Bax抗体(货号WL01637)、抑凋亡蛋白Bcl-2抗体(货号WL01556),购自沈阳万类生物科技有限公司;凋亡相关蛋白酶caspase3抗体(货号16977-1-AP)、GAPDH抗体(货号60004-1-Ig),购自武汉三鹰生物技术有限公司;凋亡相关蛋白酶caspase9抗体(货号sc-56076),购自美国Santa Cruz Biotechnology公司;高敏ECL化学发光检测试剂盒(货号E412-01),购自南京诺唯赞生物科技有限公司。
1.3 仪器 Infinite M2000 Pro全波长酶标仪(德国Tecan公司);IX51型荧光倒置显微镜(日本Olympus公司);Nikon TS2-S-SM倒置荧光显微镜(日本Nikon公司);Tanon 5200 Multi全自动化学发光系统(上海天能科技有限公司)。
2 方法
2.1 药液配制 鹿血晶人临床用量为2.0 g/d,按体表面积换算[12]为小鼠每天用量为0.26 g/kg。分别取等效用量的1.5、3、6倍作为低、中、高剂量组,每天灌胃给药2次,则3组剂量分别为每次0.20、0.39、0.78 g/kg。给药体积为0.2 mL/10 g体质量,将鹿血晶溶于0.5%羧甲基纤维素钠(CMC-Na)中,质量浓度分别为9.75、19.5、39 mg/mL。
2.2 分组及给药 雄性ICR小鼠随机分为对照组(0.5% CMC-Na),模型组(0.5% CMC-Na),AKI模型鹿血晶低(0.20 g/kg)、中(0.39 g/kg)、高剂量组(0.78 g/kg),灌胃给予相应药物。预给药7 d (每天2次)后,小鼠禁食不禁水12 h,除对照组外各组一次性腹腔注射顺铂(25 mg/kg) (对照组腹腔注射相同体积生理盐水)造模,继续给药72 h后眼框取血,脱臼处死,取两侧肾脏称质量,计算肾指数,公式为肾指数=(肾脏湿重/体质量)×100%,全血室温静置后离心分离获得血清,4 ℃保存。肾组织-80 ℃保存,另取部分固定在10%甲醛中,用于组织病理学分析。
2.3 小鼠血清及肾组织生化指标检测 小鼠血清BUN、Scr、ALB水平,肾脏组织内MDA、GSH水平和SOD、GSH-Px活性按相关试剂盒说明书测定;肾脏组织内ROS、TNF-α及IL-1β水平均采用ELISA法测定,按照相关说明书进行检测。
2.4 小鼠肾组织苏木精-伊红(HE)染色 小鼠肾脏制成常规石蜡切片,HE染色,由南京烁朴生物科技有限公司完成,在显微镜下观察拍照。
2.5 Hoechst 33342染色 将小鼠肾脏制成常规石蜡切片,Hoechst 33342染色液稀释100倍成工作液后染色,由南京烁朴生物科技有限公司完成,在倒置荧光显微镜下观察,于DAPI通道下记录各组肾脏形态及细胞凋亡损伤情况并拍照。
2.6 蛋白表达检测 采用Western blot法检测小鼠肾脏组织NF-κB p65、IκBα、p38、JNK总蛋白表达及其磷酸化(p-)蛋白表达,以及Bax、Bcl-2、caspase3、caspase9表达,通过Image-Pro Plus 6.0图像处理软件进行定量分析。

3 结果
3.1 造模成功判断标准 AKI成模后,小鼠肾脏颜色由正常的紫红色变成苍白色,两者颜色差异非常明显,并且成模小鼠血清肌酐、尿素氮水平明显升高,而血清ALB水平明显降低。顺铂注射后,未成模小鼠肾脏颜色与正常肾没有明显区别,上述3个血清指标的变化也较小,尤其是肌酐水平。成模小鼠经药物治疗后小鼠肾脏颜色会明显改善,但未达到正常小鼠水平。
本实验中对照组有15只小鼠;模型组有19只小鼠,死亡1只,未成模1只,最终17只;AKI模型鹿血晶低剂量组有16只小鼠,死亡0只,未成模1只,最终15只;AKI模型鹿血晶中剂量组有16只小鼠,死亡0只,未成模1只,最终15只;AKI模型鹿血晶高剂量组有17只小鼠,死亡0只,未成模1只,最终16只。
3.2 鹿血晶对AKI小鼠肾脏颜色、体质量、脏器指数及肾功能的影响 对照组小鼠肾脏颜色呈紫红色;模型组小鼠则呈苍白色(图1A)。与对照组比较,模型组小鼠肾指数(图1B)升高(P<0.01),顺铂造模后3 d内体质量(图1C)不断减轻(P<0.01),进食量(图1D)不断减少直至不再进食;与模型组比较,鹿血晶各给药组均明显改善肾脏颜色(尤其是高剂量组),降低肾指数(P<0.01),减小顺铂引起的体质量减轻(P<0.05,P<0.01),并呈剂量依赖性,但各给药组对顺铂引起的进食量减少无明显影响(P>0.05)。图1E~1G显示,与对照组比较,模型组小鼠血清Scr、BUN水平升高(P<0.05,P<0.01),ALB水平降低(P<0.05,P<0.01);而与模型组比较,鹿血晶各剂量组均可明显改善肾功能指标(P<0.05,P<0.01),并呈现出剂量依赖性。

注:与对照组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01;与鹿血晶低剂量组比较,△P<0.05,△△P<0.01;与鹿血晶中剂量组比较,▲▲P<0.01。图2 鹿血晶对AKI小鼠肾组织ROS、MDA水平,SOD、GSH-Px活性及GSH水平的影响Fig.2 Effects of deer blood crystal on the levels of ROS and MDA, activities of SOD and GSH-Px, and level of GSH in renal tissues of AKI
3.3 鹿血晶对AKI小鼠肾组织氧化应激的影响 图2A~2E显示,与对照组比较,AKI小鼠肾组织ROS、MDA水平升高(P<0.01),SOD、GSH-Px活性及GSH水平降低(P<0.01);与模型组比较,鹿血晶治疗可明显改善顺铂诱导的肾脏氧化应激(P<0.05,P<0.01),并呈剂量依赖性。
3.4 鹿血晶对AKI小鼠肾组织炎症、组织损伤的影响 与对照组比较,模型组小鼠肾组织出现明显炎症,IκBα、NF-κB p65磷酸化表达(p-IκBα,p-NF-κB p65)升高、IκBα的总表达降低(图3A,左),p-IκBα/IκBα及p-NF-κB p65/NF-κB p65蛋白相对表达升高(P<0.01)(图3A,右),模型组TNF-α、IL-1β水平升高(P<0.01)(图3B~3D),提示炎症信号通路激活、炎症因子产生增多;与模型组比较,给予鹿血晶后,可明显抑制AKI小鼠肾脏炎症信号通路激活、炎症因子产生(P<0.05,P<0.01),并且作用呈剂量依赖性。
与对照组比较,AKI小鼠肾组织p38、JNK的磷酸化表达(p-p38、p-JNK)升高(图3C,左),p-p38/p38及p-JNK/JNK蛋白相对表达升高(P<0.01)(图3C,右);而与模型组比较,鹿血晶可剂量依赖性下调AKI小鼠肾组织p38、JNK磷酸化表达增加(P<0.05,P<0.01)。图3E显示,AKI小鼠肾小管明显损伤,肾小管上皮细胞坏死脱落、管腔变形空泡化;鹿血晶可使肾小管损伤明显减轻,以高剂量组更明显。

注:与对照组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01;与鹿血晶低剂量组比较,△P<0.05,△△P<0.01;与鹿血晶中剂量组比较,▲P<0.05,▲▲P<0.01。图3 鹿血晶对AKI小鼠肾组织IκBα、NF-κB p65、p38、JNK磷酸化表达,TNF-α、IL-1β水平及肾组织损伤的影响(HE染色,Fig.3 Effects of deer blood crystal on the phosphorylation expressions of IκBα, NF-κB p65, p38 and JNK, levels of TNF-α and IL-1β, and injury in renal tissues of AKI mice(HE
3.5 鹿血晶对AKI小鼠肾组织细胞凋亡的影响 与对照组比较,模型组小鼠肾组织促凋亡蛋白Bax、凋亡相关蛋白酶caspase3、caspase9表达均上调(图4A,左),相对表达量升高(P<0.01)(图4 A,右),抑凋亡蛋白Bcl-2表达下调(图4A,左),相对表达量降低(P<0.01)(图4A,右)。Hoechst 33342染色(图4B)显示,对照组小鼠肾组织细胞核只出现弱荧光;而模型组小鼠肾小球、肾小管上皮细胞核内荧光强度增大,出现明亮的蓝色荧光,尤以肾小球内细胞特别明显,提示出现明显的细胞凋亡;与模型组比较,鹿血晶可下调Bax、caspase3、caspase9蛋白表达(P<0.05,P<0.01),上调Bcl-2蛋白表达(P<0.05,P<0.01),肾小球及肾小管上皮细胞核内Hoechst 33342染色荧光强度减轻,并呈剂量依赖性。
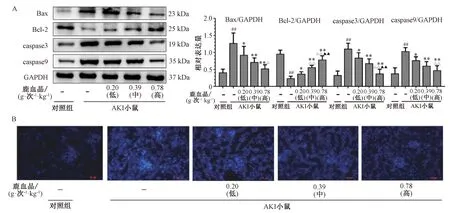
注:与对照组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01;与鹿血晶低剂量组比较,△P<0.05,△△P<0.01;与鹿血晶中剂量组比较,▲▲P<0.01。图4 鹿血晶对AKI小鼠肾组织Bax、Bcl-2、caspase3、caspase9表达及细胞凋亡的影响 (Hoechst 33342染色,Fig.4 Effects of deer blood crystal on the expressions of Bax, Bcl-2, caspase3 and caspase9, and apoptosis in renal tissues of AKI mice (Hoechst 33342
4 讨论
AKI是一种危急重症,表现为在短期内肾功能急剧恶化,造成新陈代谢失调、电解质紊乱及液体失衡[13],且病因复杂,临床表现多样,病情变化快[14]。AKI的发病机制复杂,现有研究认为氧化应激损伤是AKI机制中尤为重要的作用环节[15]。AKI发生时肾组织的抗氧化-氧化系统平衡被破坏,降低肾组织的抗氧化能力,造成肾脏氧化应激损伤[16]。AKI发生时可导致NF-κB信号通路激活,从而导致以TNF-α、IL-1β为代表的多种促炎因子及趋化因子水平升高[17]。p38 MAPK信号通路的激活被视为是AKI的潜在作用机制[18],该通路激活后可介导其下游促/抗凋亡蛋白的表达,如Bax、Bcl-2等[19]。当激活促凋亡蛋白并抑制抗凋亡蛋白时,其下游以蛋白酶caspase3、caspase9等为终末因子的细胞凋亡应答反应被彻底激活[20]。肾脏是人体重要的解毒和排泄器官,非常容易受到药物损害而诱发AKI。其中,顺铂作为一种临床上常用的化疗药物,常用于治疗多种恶性肿瘤。顺铂大量蓄积于肾脏所致的AKI是治疗过程中常见且致命的副作用,其临床发生率约为30%,致死率高达65%[21-22],且呈逐年上升趋势。本研究采用单次腹腔注射顺铂诱导AKI小鼠模型,该模型能较好地模拟临床上顺铂诱导AKI发生的病理表现及变化[23]。
鹿血晶作为一种中药饮片,为鹿血经炮制加工冻干后制得的产品,常用于肿瘤放、化疗后病人升高白细胞及血小板,增强免疫力等。现有研究发现,鹿血晶还有补肾益精,补血补气,增强性功能的作用[24]。近来有文章报道,鹿血晶能够增强巨噬细胞吞噬大肠杆菌的能力,并且在不影响细胞活性的同时作用于NF-κB信号通路,抑制炎症状态下巨噬细胞炎症因子的表达与释放[25],鹿血晶还能够活化巨噬细胞mTOR信号通路,促进巨噬细胞产生促炎因子,提升巨噬细胞对肿瘤细胞的吞噬、杀伤能力[26]。本研究表明,鹿血晶对肾脏也具有明确的保护作用。鹿血晶预防性给药,可以明显改善顺铂诱导的AKI小鼠肾功能损伤,降低Scr、BUN水平,并升高血清ALB水平;并且,可有效地降低AKI发生时肾脏的氧化应激水平(抑制肾组织ROS、MDA水平升高,SOD、GSH-Px活性降低及GSH水平降低)、抑制炎症信号通路NF-κB激活及炎症因子TNF-α、IL-1β分泌,还抑制凋亡相关蛋白Bax、caspase3、caspase9表达的上调及抑凋亡蛋白Bcl-2表达的下调、明显降低细胞凋亡的程度。实验显示,鹿血晶对AKI肾脏的这种保护作用呈现剂量依赖性。经由检测MAPKs信号分子p38、JNK磷酸化表达的改变,推测鹿血晶对顺铂诱导AKI的抑制作用,与其抑制p38、JNK磷酸化表达上调、抑制NF-κB激活,从而抑制p38、JNK、NF-κB信号通路激活相关。鹿血晶的活性成分、作用机制有待进一步研究。
综上所述,鹿血晶具有多方面的临床作用,不仅能“升高白细胞及血小板,增强免疫力”,还对肾脏具有明显的保护作用。这为鹿血晶具备的“补肾益精、补血补气”的功效提供了明确的现代药理学证据,也为其作为一种保健类中药的临床应用提供了科学依据。
