芪归益肾方对缺血再灌注致急性肾损伤小鼠的保护作用
2022-02-25姜玉勤孙晓怡汪继涛唐余燕刘何晶魏明刚
姜玉勤, 孙晓怡, 汪继涛, 唐余燕, 刘何晶, 陆 迅, 魏明刚*
(1.苏州大学附属第一医院,江苏 苏州 215006;2.苏州市立医院北区,江苏 苏州 215000)
急性肾损伤主要指以肾小球滤过率迅速下降,同时患者血清肌酐(Scr)及尿素氮(BUN)水平升高为特点的临床综合征[1]。2015年世界肾脏病协会报道表明,全球范围内每年受到急性肾损伤影响的人约有1 300万,而每年因缺血再灌注肾损伤导致的死亡人数约170万人[2]。缺血再灌注损伤是引起急性肾损伤的主要原因之一,但目前仍欠缺预防缺血再灌注导致的急性肾损伤针对性的药物[3],因此积极探究缺血再灌注引起的急性肾损伤的机制,寻找和发现有效预防和治疗的药物至关重要。
缺血再灌注引起的急性肾损伤可使氧自由基大量产生,氧化应激状态被激活,是目前公认影响急性肾损伤的主要因素[4],因此氧自由基的清除成为治疗急性肾损伤的关键手段。血红素氧合酶-1(heme oxygenase-1,HO-1)是血红素分解的限速酶,催化血红素生成等摩尔的一氧化碳(CO)、胆红素和亚铁离子,这些分解产物在氧化应激中起着保护组织细胞的作用[5-6]。过量氧自由基导致抗氧化状态失衡,引起核转录因子NF-E2相关因子2(Nrf2)的表达增加,从而增加HO-1的表达增强抗氧化,发挥细胞保护作用[7]。在课题组前期实验中证实芪归益肾方对顺铂导致的急性肾损伤具有确切的保护作用,本研究旨在探讨芪归益肾方对缺血再灌注引起的急性肾损伤小鼠肾功能的保护作用及相关机制,为临床患者的肾功能保护治疗提供理论支持。
1 材料
1.1 动物 SPF级雄性ICR小鼠32只,体质量(20±3)g,由苏州大学药学院实验动物中心提供,动物生产许可证号SCXK(沪)20170005。
1.2 试剂 黄芪(批号170828015)、当归(批号170803015)、川芎(批号170702015)、怀牛膝(批号170718015)饮片由苏州市天灵中药饮片有限公司提供,按3∶1∶1∶1的比例煎至质量浓度为2.5 g/mL,均符合2015年版《中国药典》相关要求,剂量根据课题组前期研究结果确定[8]。硫酸锌注射液(批号2001081)。SOD试剂盒(批号20101103)、MDA试剂盒(批号20201107)、Scr试剂盒(批号20201012)、BUN试剂盒(批号20201009)、HO-1抗体(批号GB12104)、Nrf2抗体(批号KF742)、蛋白磷酸酶抑制剂(批号W061-1-1)、HRP标记的山羊抗小鼠IgG(批号GB23301)均购自南京建成生物工程研究所。
1.3 仪器 电泳仪、电泳槽、电转槽、全自动凝胶成像系统,购自美国Bio-Rad公司;台式低速离心机,购自上海精密科学仪器有限公司;高速微量台式冷冻离心机,购自美国Thermo公司;全自动酶标仪,购自美国Bio-Tek公司;Axio Imager M1m显微镜,购自德国Zeiss公司。
2 方法
2.1 分组与造模 将32只ICR小鼠按随机数字法分成假手术组、模型组、芪归益肾方组和硫辛酸组,每组8只,芪归益肾方给药剂量为50 g/kg[8],按照人常规剂量与小鼠用药换算关系[9],确定硫辛酸组给药剂量为0.1 g/kg,每天给药1次,连续1周。1周后,除假手术组,其余各组利用右肾切除、左肾动脉夹闭45 min后再灌注的方法建立小鼠急性肾损伤模型。
小鼠禁食12 h,腹腔注射3%戊巴比妥钠(40 mg/kg)麻醉,仰卧固定,常规消毒,沿腹正中线做切口,逐层分离组织,进入腹腔,暴露出双侧肾脏,模型组、芪归益肾方和硫辛酸组暴露右侧肾动脉及肾蒂,结扎右肾动脉后将肾切除,再分离左肾动脉并用丝线结扎,可见左肾颜色由粉红变为暗红,表明肾缺血模型成功,25 min后松开丝线恢复供血,肾脏颜色由暗紫变为鲜红,颜色有所恢复。假手术组用同样方法切除右肾后,游离左侧肾蒂只穿线不结扎。造模24 h后打开小鼠胸腔,心脏采血,全血静置30 min,3 500 r/min离心10 min,取上清,血清于-20 ℃冰箱中保存。采血后迅速剖取左肾,纵行剖开,一部分用10%甲醛固定,另一部分预冷并用PBS清洗,液氮处理后于-80 ℃冰箱中保存,进行病理及分子生物学检测。
2.2 血清Scr、BUN水平检测 取小鼠血清,参照相关试剂盒说明书操作检测Scr、BUN水平。
2.3 氧化应激分子水平检测 取小鼠血清,根据相关试剂盒说明书检测SOD活性及MDA水平。
2.4 肾组织HE染色 将甲醛固定的小鼠肾组织石蜡包埋后,制备2 μm厚的切片,HE染色,显微镜下观察肾组织病理改变,每张切片随机选取8个视野观察肾小管-间质病理变化,进行肾小管-间质病变半定量评分[10]。
2.5 免疫组织化学法检测HO-1、Nrf2表达 小鼠肾组织石蜡切片,PBS磷酸缓冲盐溶液冲洗,滴加一抗4 ℃孵育过夜,PBS冲洗后加入二抗,37 ℃孵育1 h,PBS冲洗后DAB显色,梯度乙醇脱水,二甲苯透明,树胶封片,光镜下观察,以棕黄色颗粒区域为阳性表达,每张切片随机观察6个非重叠视野,应用病理图文分析软件进行半定量表达程度的分析。
2.6 Western blot检测HO-1、Nrf2蛋白表达 取适量小鼠肾组织,加入裂解液和蛋白酶、磷酸酶抑制剂,充分研磨裂解,离心取上清,BCA法检测样本蛋白浓度。每个样本取20 μg上样,10% SDS-PAGE凝胶电泳分离,电泳后转至硝酸纤维素膜,加入5%脱脂奶粉溶液,在摇床上封闭1 h,加入一抗(1∶1 000)4 ℃孵育过夜,TBST漂洗3次后加入二抗(1∶5 000)室温孵育2 h,采用ECL化学发光试剂盒显色曝光。

3 结果
3.1 芪归益肾方对小鼠肾功能指标变化的影响 与假手术组比较,模型组小鼠血清Scr、BUN水平均升高(P<0.05);与模型组比较,芪归益肾方组和硫辛酸组小鼠血清Scr、BUN水平均降低(P<0.05),见图1。

注:与对照组比较,▲P<0.05;与模型组比较,△P<0.05。图1 各组小鼠血清Scr、BUN水平Fig.1 Serum levels of Scr and BUN of mice in each
3.2 芪归益肾方对小鼠血清氧化应激的影响 与假手术组比较,模型组小鼠血清SOD活性降低(P<0.05),MDA水平升高(P<0.05);与模型组比较,芪归益肾方组和硫辛酸组小鼠血清SOD活性升高(P<0.05),MDA水平降低(P<0.05);与硫辛酸组比较,芪归益肾方组小鼠血清SOD活性升高(P<0.05),MDA水平降低(P<0.05),见图2。

注:与假手术组比较,★P<0.05;与模型组比较,▲P<0.05;与硫辛酸组比较,△P<0.05。图2 各组小鼠血清SOD活性及MDA水平Fig.2 Serum SOD activity and MDA level of mice in each
3.3 芪归益肾方对小鼠肾组织病理学评分的影响 假手术组小鼠肾小球和肾小管结构清晰,小管上皮细胞排列整齐,无明显炎性细胞浸润;模型组小鼠肾小管结构破坏,上皮细胞有不同程度的肿胀、变性、坏死,刷状缘脱落,肾小管扩张,间质充血、水肿并伴有炎性细胞浸润;与模型组比较,芪归益肾方组和硫辛酸组小鼠肾组织损伤均减轻(P<0.05),见图3~4。

图3 各组小鼠肾组织病理变化(HE,×200)Fig.3 Renal pathological changes of mice in each group(HE, ×200)

注:与假手术组比较, ▲P<0.05;与模型组比较,△P<0.05。图4 各组小鼠肾小管损伤评分Fig.4 Renal tubular injury scores of mice in each group
3.4 芪归益肾方对小鼠HO-1、Nrf2蛋白表达的影响 与假手术组比较,模型组小鼠肾脏组织中HO-1、Nrf2 表达均降低(P<0.05);与模型组比较,芪归益肾方组和硫辛酸组小鼠肾脏组织中HO-1、Nrf2表达均升高(P<0.05);与硫辛酸组比较,芪归益肾方组小鼠肾脏组织中HO-1、Nrf2表达升高(P<0.05),见图5~6。

图5 各组小鼠肾组织中HO-1、Nrf2表达(免疫组化,×200)Fig.5 Expressions of HO-1 and Nrf2 in renal tissue of mice in each group(immunohistochemistry, ×200)
4 讨论
急性肾损伤是住院患者最常见的并发症之一,严重危及患者生命[11]。缺血再灌注是临床导致急性肾损伤的最主要原因。肾脏缺血时引起肾脏微血管改变和线粒体代谢障碍,导致ROS增加;再灌注则诱导ROS过量产生,ROS的累积进一步加重肾损伤,导致氧化应激。抗氧化系统的清除能力下降表现抗氧化酶SOD、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)等水平的降低。氧化应激产生的氧化损伤使急性肾损伤进一步加重[12-13]。MDA是ROS介导的肾脏过氧化的终产物,因此可以反映氧化应激水平,从而反应缺血再灌注急性肾损伤肾损伤程度[14-15]。
缺血再灌注引起氧化应激后,肾脏细胞通过氧化还原敏感的线粒体酶促反应进行自我保护,其中HO-1发挥重要作用。HO-1可将血红素催化降解成胆绿素、CO和自由铁[5-6]。其中胆绿素能有效地清除ROS并抑制过氧化,其还原产物胆红素可以抑制蛋白激酶C和NADPH氧化酶的活性,从而阻断氧化应激的产生;HO-1源性CO可以使有丝分裂原激活的蛋白激酶恬性增加,加强有丝分裂原激活的蛋白激酶对SOD和GSH-Px的刺激作用;自由铁诱导生成的铁蛋白可以与活性铁结合,使细胞从氧化损伤的超敏状态转为低敏状态,从而免受游离铁的不良作用[16-17]。Nrf2是激活抗氧反应元件(ARE)的关键转录因子,通过上调多种细胞内抗氧化酶的表达来预防肾功能障碍。研究表明Nrf2可通过调控HO-1的表达[18],促进抗氧化分子如SOD、GSH-Px的表达,同时抑制MDA的水平[19-20],从而抑制急性肾损伤中氧化应激损伤。
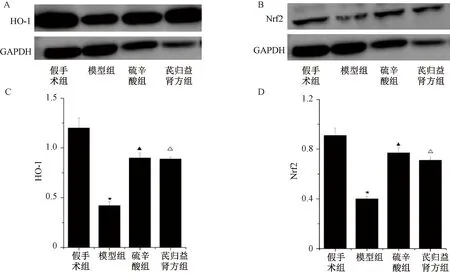
注:与对照组比较,★P<0.05;与模型组比较,▲P<0.05;与硫辛酸组比较,△P<0.05。图6 各组小鼠肾脏组织中Nrf2、HO-1蛋白表达Fig.6 Protein expressions of HO-1 and Nrf2 in renal tissue of mice in each
肾缺血再灌注损伤归属于中医的“关格”“水肿”范畴,病机为血脉瘀阻,肾元亏虚。芪归益肾方的设立原则为“补肾祛浊、活血化瘀”,主要成分包括黄芪、当归、怀牛膝、川芎等。其中黄芪补气行血、扶正祛邪;当归和川芎补血活血,通络化瘀;怀牛膝益肾活血且可引诸药归肾经,视为佐药[21]。以上药物相辅相成,顾元化瘀、通经活络,共同作用减轻肾缺血再灌注损伤。
本实验探究了芪归益肾方对缺血再灌注导致的急性肾损伤的保护作用。结果表明,芪归益肾方可显著改善模型小鼠的肾功能,药物干预组肾小管结构损伤减轻,变性、坏死、炎性细胞浸润等现象减少。与模型组比较,芪归益肾方组小鼠血清SOD活性和肾组织Nrf2、HO-1表达均增加,血清MDA水平降低,提示芪归益肾方对缺血再灌注肾损伤的保护机制是通过激活抗氧化系统,有效清除氧自由基,减少氧化应激损伤。
综上所述,芪归益肾方对缺血再灌注所致急性肾损伤模型小鼠肾功能有确切的保护作用,其机制与调控Nrf2/HO-1通路有关,且疗效优于硫辛酸。因此,中药复方芪归益肾方的干预对缺血再灌注引起的急性肾损伤的疗效值得进一步研究。
