外源性硫化氢通过Nrf2/ARE/HO-1通路对精神分裂症大鼠认知功能及肠道屏障功能的影响
2022-02-25陈力马亚丽李本亮
陈力,马亚丽,李本亮
精神分裂症是一种病因不明、危害性较大的慢性精神病,多在青壮年期缓慢、亚急性起病,临床上患者常有感知觉、思维、行为、情感等多方面的障碍,且对其工作、日常生活、社交等有不利影响[1-2]。随着病情的不断进展,部分患者会出现认知功能损害、肠道功能障碍等多种并发症,严重影响患者的生活质量及身体健康[3-4]。肠道屏障是机体复杂且重要的防御系统,主要通过抵御抗原进入、吸收营养物质等方式维持机体内环境的稳态,精神分裂症、糖尿病、脓毒症等非消化系统疾病均可造成肠道屏障功能失调,进而损害机体健康[4-5]。近年来硫化氢(H2S)在神经系统、消化系统中的病理生理作用引起广泛关注,如Sommer等[6]研究发现外源性H2S作为精神分裂症的抗氧化及抗炎介质,可用于抗精神病治疗;Cui等[7]研究发现外源性H2S可显著改善肠缺血再灌注大鼠肠黏膜损伤、肠黏膜细胞凋亡及氧化应激损伤,但其作用机制仍不清晰。核因子E2相关因子2(Nrf2)/抗氧化反应元件(ARE)/血红素氧化酶1(HO-1)通路是机体抵抗外界氧化应激的关键通路之一,在保护神经功能[8]、维持肠道屏障功能[9]等方面发挥重要作用。本研究以Nrf2/ARE/HO-1为切入点,探究外源性H2S对精神分裂症大鼠认知功能、肠道屏障功能的影响及其可能机制,旨在为临床治疗精神分裂症提供新思路。
1 材料与方法
1.1 实验动物 SPF级雄性SD大鼠40只,6~8周龄,体质量200~240 g,购自广东省医学实验动物中心,生产许可证号:SCXK(粤)2018-0002。大鼠于温度22~24℃,相对湿度40%~60%,12 h/12 h昼夜交替的条件下饲养,自由进食饮水。本研究经郑州大学第五附属医院动物伦理委员会批准同意,实验过程中按照动物使用的“3R”原则给予人道主义关怀。
1.2 主要试剂及仪器 N-甲基-D-天冬氨酸(NMDA)受体拮抗剂MK-801、GYY4137(H2S供体)、全反视黄酸(ATRA,Nrf2抑制剂)购自上海陶素生化科技有限公司;原位末端转移酶标记技术(TUNEL)细胞凋亡检测试剂盒、蛋白提取试剂盒、BCA试剂盒购自上海碧云天生物技术有限公司;HE染色试剂盒、H2S含量检测试剂盒购自北京索莱宝科技有限公司;超氧化物歧化酶(SOD)、丙二醛(MDA)、肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6酶联免疫吸附试验(ELISA)试剂盒购自上海酶联生物科技有限公司;D-乳酸ELISA试剂盒(JL209792)购自上海江莱生物科技有限公司;兔抗鼠Nrf2、HO-1、Caspase-3、Bax、Bcl-2、GAPDH一抗,IgG二抗购自Abcam。组织脱水机(型号:ASP6025)、手动轮转式切片机(型号:BIOCUT)购自德国Leica公司;光学显微镜(型号:BioScope Resolve)购自美国BRUKER;酶标仪(型号:SpectraMax i3x)购自奥地利Molecular Devices;蛋白电泳仪(型号:JY300)购自北京君意华鑫;半干转膜仪(型号:TE70X)购自美国Hoefer;凝胶成像仪(型号:Quantum CX5)购自法国Vilber。
1.3 方法
1.3.1 动物模型制备及分组 精神分裂症大鼠模型的制备参考文献[10],将SD大鼠按照随机数字表法分为对照组(8只)和造模组(32只),造模组大鼠通过腹腔注射0.2 mg/kg的MK-801构建精神分裂症大鼠模型,每天注射1次,连续注射2周;对照组大鼠腹腔注射生理盐水。第15天通过Morris水迷宫实验验证模型构建情况,(造模组大鼠潜伏期-对照组大鼠潜伏期)/对照组大鼠潜伏期×100%>20%表明精神分裂症大鼠模型构建成功[11]。造模过程中出现不符合条件或者死亡时(造模组出现2只)及时选取备用大鼠进行精神分裂症模型的复制。
将造模成功的大鼠按照随机数字表法分为模型组、H2S干预组、Nrf2抑制剂组、H2S+Nrf2抑制剂组,每组8只。H2S干预组腹腔注射10 mg/kg的GYY4137(H2S供体)[12],Nrf2抑制剂组腹腔注射10 mg/kg的ATRA(Nrf2抑制剂)[13],H2S+Nrf2抑制剂组腹腔注射10 mg/kg的GYY4137和10 mg/kg的ATRA,模型组和对照腹腔注射生理盐水,连续处理7 d。
1.3.2 各组大鼠认知功能测定 末次给药结束后24 h进行Morris水迷宫实验测定各组大鼠的认知功能。将水迷宫均分为1、2、3、4四个象限,在第1象限中央低于水平面1 cm处放置半径为5 cm的圆形透明平台。第1、2、3、4天进行定位巡航实验:每天上午8:00将大鼠从第2、3、4象限的同一位置放入水中,记录大鼠从入水至爬到圆形平台的时间,即逃避潜伏期;若大鼠在90 s内未找到圆形平台,则引导大鼠至圆形平台上并停留10 s,此时潜伏期为90 s。第5天进行空间探索实验:将圆形平台撤去,记录120 s内大鼠游过圆形平台的次数,即穿台次数。
1.3.3 各组大鼠相关标本采集 完成Morris水迷宫测试后取大鼠尾静脉血0.4 mL,置于肝素化离心管中,3 000 r/min离心15 min后取上层血浆。将大鼠麻醉后处死,取回盲部肠管组织5 cm,其中2.5 cm用于组织病理学观察及TUNEL测定,另2.5 cm用于肠道屏障功能相关指标及Nrf2/ARE/HO-1通路相关蛋白的测定,取大鼠海马组织CA1区用于HE染色观察神经元细胞形态。
1.3.4 各组大鼠肠组织、海马组织病理损伤及肠黏膜细胞凋亡检测 取各组大鼠肠管组织适量于4%多聚甲醛中固定72 h,用流水洗去多聚甲醛后于组织脱水机中脱水,将脱水后的肠组织用融化的石蜡进行包埋,待其凝固后切成厚度约为4μm的切片。在漂片机中展开后附着在载玻片上,按照HE染色试剂盒中的要求进行HE染色,中性树胶封固后在显微镜下观察、拍照并分析。海马组织HE染色方法同肠组织HE染色。采用TUNEL细胞凋亡检测试剂盒对各组大鼠肠组织中肠黏膜细胞凋亡情况进行测定,测定方法参考试剂盒说明书,TUNEL染色阳性的凋亡细胞呈棕色,凋亡率=(凋亡细胞数/细胞总数)×100%。
1.3.5 各组大鼠血浆H2S、D-乳酸,肠组织肠道屏障功能相关指标及应激指标的检测 取各组大鼠血浆,用H2S含量检测试剂盒测定大鼠血浆中H2S含量,D-乳酸ELISA试剂盒测定大鼠血浆中D-乳酸含量。取各组大鼠肠组织,在光镜下记录大鼠肠组织的小肠绒毛高度及隐窝深度。取适量肠组织,用生理盐水制成组织匀浆,取上清液,用相应ELISA试剂盒测定各组大鼠肠组织中SOD、MDA、TNF-α、IL-6水平。
1.3.6 Western blot检测各组大鼠肠组织Nrf2/ARE/HO-1通路蛋白、凋亡相关蛋白的表达 取适量肠组织,剪碎后置于研钵中,加入适量RIPA裂解液研磨以提取总蛋白。提取充分后置于EP管中,静置20 min后1 000 r/min、4℃离心10 min,吸取上清液为目的蛋白,用BCA法测定并计算其中蛋白质浓度。取适量待测蛋白样品,按照体积比为5∶1加入上样缓冲液,100℃加热5 min使蛋白变性,取20μL变性的蛋白溶液进行聚丙烯酰胺凝胶电泳以分离蛋白,电泳过程在冰上进行。将分离的蛋白质采用湿转法转移至PVDF膜上,将PVDF膜置于5%脱脂牛奶中封闭处理30 min,经TBST缓冲液冲洗3次后加入兔抗鼠Nrf2(1∶500)、HO-1(1∶1 000)、Caspase-3(1∶1 000)、Bax(1∶1 000)、Bcl-2(1∶1 000)、GAPDH(1∶1 000)一抗,4℃冰箱过夜。回收一抗,TBST缓冲液冲洗3次,加入羊抗兔IgG二抗(1∶5 000),室温下摇床中摇晃1 h,弃二抗,TBST缓冲液冲洗3次,显影、曝光后于凝胶成像仪中观察并分析。
1.4 统计学方法 采用SPSS 22.0软件进行数据分析,符合正态分布的计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析和重复测量方差分析,组间多重比较行LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠认知功能比较 时间与分组因素对潜伏期的影响存在交互效应(P<0.05);随着训练时间的增加,各组大鼠逃避潜伏期逐渐缩短;与对照组相比,模型组大鼠逃避潜伏期延长,穿台次数减少(均P<0.05);与模型组相比,H2S干预组大鼠逃避潜伏期缩短,穿台次数增多(均P<0.05),Nrf2抑制剂组与模型组差异无统计学意义(P>0.05);与H2S干预组相比,H2S+Nrf2抑制剂组大鼠逃避潜伏期延长(P<0.05),穿台次数减少(P<0.05),见表1。
2.2 各组大鼠海马组织HE染色结果 海马HE染色结果显示,对照组海马神经元形态规则、着色均匀、排列整齐;模型组神经元排列紊乱,大量神经元核深染、固缩,部分细胞被小胶质细胞代替;与模型组相比,H2S干预组神经元形态结构得到恢复;与H2S干预组相比,H2S+Nrf2抑制剂组大鼠海马神经元损伤加重,见图1。
Tab.1 Comparison of cognitive function of rats between the five groups表1 各组大鼠认知功能比较 (n=8,±s)

Tab.1 Comparison of cognitive function of rats between the five groups表1 各组大鼠认知功能比较 (n=8,±s)
*P<0.05,**P<0.01;a与对照组比较,b与模型组比较,c与H2S干预组比较,d与Nrf2抑制剂组比较,P<0.05;表2~5同。
组别对照组模型组H2S干预组Nrf2抑制剂组H2S+Nrf2抑制剂组第2天59.28±6.05 81.75±7.05a 66.39±7.11ab 82.28±8.31ac 74.06±7.04abcd第3天43.19±3.99 75.57±7.77a 56.62±5.23ab 76.15±6.85ac 67.49±6.63abcd第4天29.10±2.06 60.84±6.71a 35.30±2.18ab 66.93±6.46ac 49.08±3.91abcd F(组间/时间/交互)逃避潜伏期(s)第1天64.60±7.44 88.58±7.28a 72.70±7.05ab 89.26±8.34ac 80.70±7.30abcd 170.676**/120.340**/2.103*穿台次数(次)6.68±1.39 2.20±0.42a 3.59±0.43ab 2.06±0.35ac 2.61±0.17acd 59.924**
2.3 各组大鼠肠黏膜细胞凋亡情况 与对照组相比,模型组肠黏膜细胞凋亡率、Caspase-3、Bax蛋白表达显著升高,Bcl-2蛋白表达显著降低(P<0.05);与模型组相比,H2S干预组肠黏膜细胞凋亡率、Caspase-3、Bax蛋白表达显著降低,Bcl-2蛋白表达显著升高(P<0.05),Nrf2抑制剂组与模型组比较差异无统计学意义(P>0.05);与H2S干预组相比,H2S+Nrf2抑制剂组大鼠肠黏膜细胞凋亡率、Caspase-3、Bax蛋白表达显著升高(P<0.05),Bcl-2蛋白表达显著降低(P<0.05),见表2,图2、3。
2.4 各组大鼠肠组织形态学观察 对照组回盲部肠组织形态学正常,光泽度较好,绒毛排列整齐,形态呈指状,未见炎性细胞浸润;模型组肠组织损伤严重,可见绒毛生长稀疏,略有水肿,出现炎性细胞浸润等情况;与模型组相比,H2S干预组大鼠肠组织损伤得到一定缓解,Nrf2抑制剂组无明显差异;与H2S干预组相比,H2S+Nrf2抑制剂组大鼠肠组织损伤情况较重,见图4。

Fig.1 HE staining observation of hippocampal tissue of rats in each group(×400)图1 各组大鼠海马组织HE染色结果(×400)
2.5 各组大鼠血浆H2S、D-乳酸,肠组织肠道屏障功能相关指标及应激指标变化 与对照组相比,模型组血浆D-乳酸及肠组织中MDA、TNF-α、IL-6水平显著升高(P<0.05),小肠绒毛高度、小肠隐窝深度、血浆H2S水平、肠组织中SOD水平显著降低(P<0.05);与模型组相比,H2S干预组血浆D-乳酸及肠组织中MDA、TNF-α、IL-6水平显著降低(P<0.05),小肠绒毛高度、小肠隐窝深度、血浆H2S水平、肠组织中SOD水平显著升高(P<0.05),Nrf2抑制剂组与模型组相比差异无统计学意义(P>0.05);与H2S干预组相比,H2S+Nrf2抑制剂组血浆D-乳酸及肠组织中MDA、TNF-α、IL-6水平显著升高(P<0.05),小肠绒毛高度、小肠隐窝深度、血浆H2S水平、肠组织中SOD水平显著降低(P<0.05),见表3、4。
2.6 各组大鼠肠组织Nrf2/ARE/HO-1通路相关蛋白表达情况 与对照组相比,模型组肠组织中Nrf2、HO-1蛋白表达水平显著增加(P<0.05);与模型组相比,H2S干预组肠组织中Nrf2、HO-1蛋白表达水平显著增加(P<0.05),Nrf2抑制剂组与模型组差异无统计学意义(P>0.05);与H2S干预组相比,H2S+Nrf2抑制剂组大鼠肠组织中Nrf2、HO-1蛋白表达水平显著降低(P<0.05),见表5、图5。
Tab.2 Apoptosis of intestinal mucosa cells of rats in each group表2 各组大鼠肠黏膜细胞凋亡情况 (n=8,±s)

Tab.2 Apoptosis of intestinal mucosa cells of rats in each group表2 各组大鼠肠黏膜细胞凋亡情况 (n=8,±s)
组别对照组模型组H2S干预组Nrf2抑制剂组H2S+Nrf2抑制剂组F凋亡率(%)4.15±0.86 19.48±5.25a 6.60±1.80b 20.46±6.82ac 13.44±3.21acd 24.555**凋亡相关蛋白表达Caspase-3/GAPDH 0.49±0.10 1.25±0.27a 0.60±0.14b 1.27±0.31ac 0.93±0.18acd 22.428**Bax/GAPDH 0.41±0.08 1.22±0.26a 0.61±0.14b 1.26±0.30ac 0.92±0.17acd 26.133**Bcl-2/GAPDH 1.01±0.10 0.58±0.05a 0.93±0.09b 0.54±0.03ac 0.67±0.03acd 80.054**

Fig.2 TUNEL staining was used to detect the apoptosis of intestinal mucosal cells in each group(×200)图2 TUNEL染色检测各组大鼠肠黏膜细胞凋亡情况(×200)
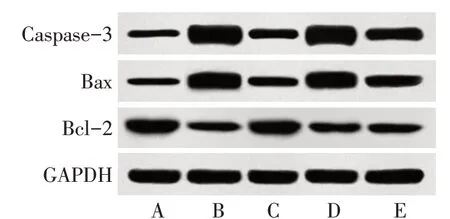
Fig.3 Expression of apoptosis related proteins in intestinal mucosa of rats in each group图3 各组大鼠肠黏膜细胞凋亡相关蛋白表达情况
3 讨论
精神分裂症是由一组症状群组成的临床综合征,为多因素慢性疾病,发病机制复杂且尚未明了,缺乏疗效确切的治疗药物及方法[14-15]。随着精神分裂症的不断进展,部分患者会出现认知功能退化[16]、肠道菌群失调[17]等多种不良表现,临床常通过药物和心理治疗等方法控制病情,但难以改善认知功能退化问题。据报道,MK-801可引起认知功能障碍,是其诱导精神分裂症形成的基础[10]。本研究通过腹腔注射0.2 mg/kg的MK-801构建精神分裂症大鼠模型,结果显示,模型组大鼠潜伏期延长,穿台次数减少,提示认知功能受到损害,精神分裂症大鼠模型构建成功。
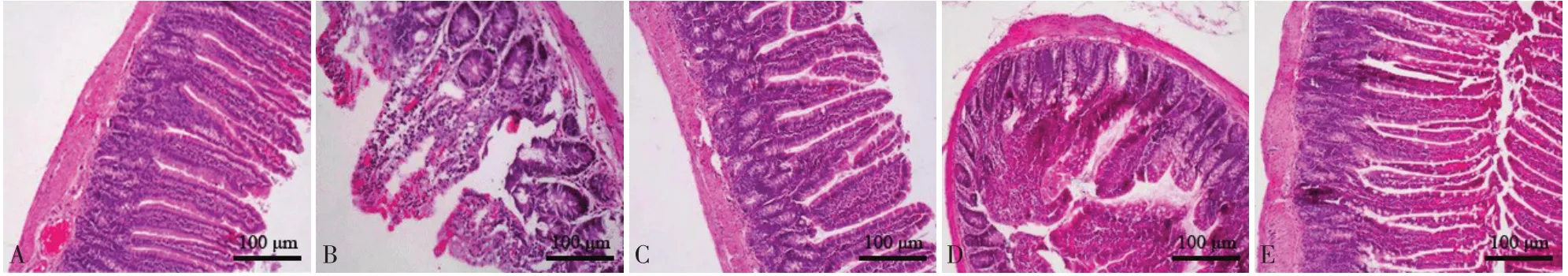
Fig.4 Observation of intestinal histomorphology of rats in each group(HE,×200)图4 各组大鼠肠组织形态学观察(HE,×200)
Tab.3 Comparison of the related indexes of intestinal barrier function and the plasma level of H 2S between the five groups of rats表3 各组大鼠肠道屏障功能相关指标、血浆H 2S水平比较 (n=8,±s)
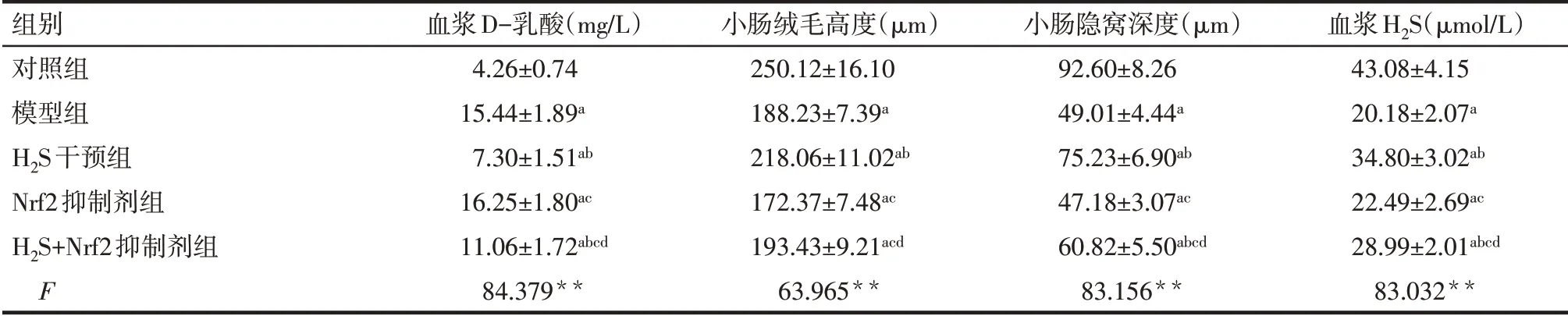
Tab.3 Comparison of the related indexes of intestinal barrier function and the plasma level of H 2S between the five groups of rats表3 各组大鼠肠道屏障功能相关指标、血浆H 2S水平比较 (n=8,±s)
组别对照组模型组H2S干预组Nrf2抑制剂组H2S+Nrf2抑制剂组F血浆D-乳酸(mg/L)4.26±0.74 15.44±1.89a 7.30±1.51ab 16.25±1.80ac 11.06±1.72abcd 84.379**小肠绒毛高度(μm)250.12±16.10 188.23±7.39a 218.06±11.02ab 172.37±7.48ac 193.43±9.21acd 63.965**小肠隐窝深度(μm)92.60±8.26 49.01±4.44a 75.23±6.90ab 47.18±3.07ac 60.82±5.50abcd 83.156**血浆H2S(μmol/L)43.08±4.15 20.18±2.07a 34.80±3.02ab 22.49±2.69ac 28.99±2.01abcd 83.032**
Tab.4 Comparison of oxidative stress and inflammatory factors between the five groups of rats表4 各组大鼠氧化应激、炎性因子水平比较 (n=8,±s)

Tab.4 Comparison of oxidative stress and inflammatory factors between the five groups of rats表4 各组大鼠氧化应激、炎性因子水平比较 (n=8,±s)
组别对照组模型组H2S干预组Nrf2抑制剂组H2S+Nrf2抑制剂组F SOD(U/mg)85.03±4.75 61.25±2.78a 77.48±3.28ab 60.43±2.25ac 70.46±2.83abcd 82.387**MDA(nmol/mg)2.46±0.51 8.53±1.11a 3.94±0.71ab 8.60±1.18ac 6.02±1.03abcd 67.188**TNF-α(ng/L)16.28±3.29 132.46±17.56a 50.06±4.36ab 134.03±16.41ac 85.82±11.37abcd 143.769**IL-6(ng/L)13.15±2.47 102.18±11.31a 48.26±4.83ab 105.73±11.24ac 75.44±6.89abcd 182.417**
Tab.5 Comparison of Nrf2/ARE/HO-1 pathway related protein expression in intestinal tissues between the five groups of rats表5 各组大鼠肠组织中Nrf2/ARE/HO-1通路相关蛋白表达比较 (n=8,±s)

Tab.5 Comparison of Nrf2/ARE/HO-1 pathway related protein expression in intestinal tissues between the five groups of rats表5 各组大鼠肠组织中Nrf2/ARE/HO-1通路相关蛋白表达比较 (n=8,±s)
组别对照组模型组H2S干预组Nrf2抑制剂组H2S+Nrf2抑制剂组F Nrf2/GAPDH 0.08±0.01 0.28±0.04a 1.25±0.21ab 0.16±0.03c 0.73±0.14abcd 144.163**HO-1/GAPDH 0.15±0.03 0.37±0.06a 1.38±0.18ab 0.29±0.06c 0.85±0.15abcd 162.235**
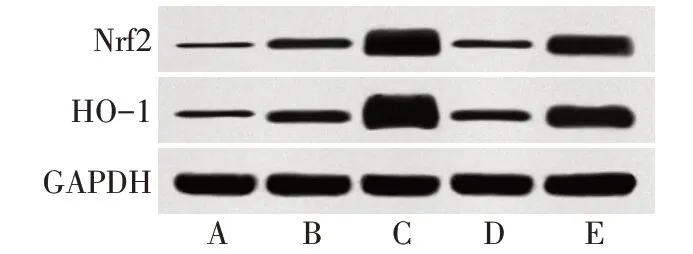
Fig.5 Expression levels of Nrf2/ARE/HO-1 pathway relatedproteins in intestinal tissues of rats in each group图5 各组大鼠肠组织中Nrf2/ARE/HO-1通路相关蛋白表达情况
肠道屏障中的肠黏膜是与内环境、外环境相互作用的主要媒介之一,可维持机体内环境稳态,而肠道屏障的显著改变会增加肠道的通透性,继而大量炎性因子及外界病原体侵入人体,引起机体各种病变[18]。近年来研究发现,中枢神经系统与胃肠道之间存在一定的联系,生理、心理压力等引起的大脑功能障碍性疾病(如精神分裂症、自闭症)会影响肠道功能,胃肠道微环境的改变也会引起行为及神经功能的变化,TNF-α、IL-6等促炎因子的增加可通过改变神经元神经酰胺的合成而导致患者认知功能损伤[19-20]。因此,探究具有保护肠道功能的治疗方法对于改善精神分裂症患者的认知功能具有重要意义。H2S是一种重要的气体信号分子,广泛存在于各个组织器官中,参与机体的各种生理病理过程,在神经系统、心血管系统相关疾病中发挥抗氧化、抗炎、抗凋亡等作用[21-22]。卢根林等[22]研究发现H2S能显著减少回肠上皮细胞凋亡,并改善肠缺血再灌注损伤大鼠肠上皮细胞功能。Berry等[23]研究发现精神分裂症患者血浆中H2S含量低于健康人群,增加机体内H2S含量可能具有抗精神疾病作用。本研究结果显示,模型组大鼠海马组织、肠组织损伤严重,肠绒毛生长稀疏,略有水肿,出现炎性细胞浸润等情况,肠黏膜细胞凋亡率、血浆D-乳酸以及肠组织中MDA、TNF-α、IL-6水平显著高于对照组,小肠绒毛高度、小肠隐窝深度、血浆H2S水平、肠组织中SOD水平显著低于对照组,提示精神分裂症可导致大鼠出现海马受损、肠道炎症反应及氧化应激反应,导致大鼠肠道屏障功能障碍。经过外源性H2S干预的大鼠炎症反应及氧化应激反应均得到抑制,大鼠海马功能、认知功能、肠道屏障功能均得到改善,提示给机体补充H2S,可显著改善精神分裂症引起的认知功能、肠道屏障功能障碍。
Nrf2/ARE通路是近年来发现的内源性抗氧化损伤通路,HO-1是Nrf2/ARE通路下游关键因子之一,激活的HO-1可将血红蛋白分解代谢成胆红素、胆绿素、铁离子等,进而减轻细胞膜脂质过氧化,发挥抗氧化作用[24-25]。Nrf2/ARE/HO-1通路在阿尔茨海默病中发挥神经保护作用,激活Nrf2/ARE/HO-1通路可显著改善东莨菪碱引起的小鼠记忆缺陷[26-27]。Liu等[28]研究发现激活Nrf2/ARE/HO-1通路可提高小鼠机体抗氧化能力,进而减轻小鼠肠缺血再灌注损伤。
本研究发现,与对照组相比,模型组肠组织中Nrf2、HO-1蛋白表达水平显著增加,提示Nrf2/ARE/HO-1通路与MK-801诱导的精神分裂症大鼠认知功能及肠道屏障功能障碍有关;与模型组相比,H2S干预组肠组织中Nrf2、HO-1蛋白表达水平显著增加,推测H2S可能通过激活Nrf2/ARE/HO-1通路改善精神分裂症大鼠的认知功能和肠道屏障功能,为了验证该推测,本研究利用Nrf2/ARE/HO-1通路抑制剂ATRA进行干预,结果发现,与H2S干预组相比,H2S+Nrf2抑制剂组大鼠肠组织中Nrf2/ARE/HO-1通路相关蛋白表达显著降低,大鼠认知功能及肠道屏障功能障碍严重,证明了H2S对认知功能和肠道屏障功能的保护作用是通过促进Nrf2/ARE/HO-1通路的激活实现的。
综上所述,外源性H2S可能通过激活Nrf2/ARE/HO-1通路显著改善精神分裂症大鼠的认知功能和肠道屏障功能,但H2S作用机制复杂,也可能通过其他途径发挥作用,仍需深入研究。
