LncRNA GAS5靶向miR-103减轻3T3L1脂肪细胞胰岛素抵抗的作用机制
2022-02-25敖文徐在革白杨刘惠双
敖文,徐在革,白杨,刘惠双
随着经济发展、人口老龄化加剧,2型糖尿病的患病率呈迅速升高趋势,已成为继肿瘤、心血管疾病之后的第3大死亡诱因[1]。2型糖尿病发病机制主要为胰岛素抵抗(insulin resistance,IR)和胰岛素分泌不足,其中IR贯穿疾病整个阶段[2-3]。控制和改善IR是预防和治疗糖尿病的根本。长链非编码RNA(long non-coding RNA,LncRNA)可以通过多条途径靶向调控胰岛素相关基因表达,从而影响IR的形成以及胰岛素的合成、分泌,这为治疗糖尿病提供了新思路[4]。生长抑制特异因子5(growth arrestspecific 5,GAS5)在2型糖尿病患者血清中呈低表达,GAS5可结合胰岛素受体启动子,其缺失可抑制葡萄糖摄取和胰岛素信号转导[5]。微小RNA(microRNA,miRNA)亦参与IR过程,miR-103作为2型糖尿病的潜在标志物,对预测2型糖尿病预后具有较高的价值[6]。另有研究发现,GAS5与miR-103之间存在靶向结合位点[7]。GAS5是否通过miR-103在IR中发挥作用尚不明确。本研究通过肿瘤坏死因子(tumor necrosis factor,TNF)-α诱导3T3L1脂肪细胞建立IR模型,探究GAS5对IR的影响,并初步探讨其可能作用机制。
1 材料与方法
1.1 主要试剂与仪器 3T3L1小鼠前脂肪细胞购自中国科学院典型培养物保藏委员会昆明细胞库(编号:KCB 92010YJ)。胰岛素、地塞米松、异丁基甲基黄嘌呤(IBMX)、TNF-α(美国sigma公司);pEGFP-C1-GAS5、引物均由上海生工生物有限公司合成;Lipofectamine™3000、mimic NC、miR-103 mimic由广州锐博生物有限公司合成;Krebs-Ringer缓冲液(北京Solarbio公司);一抗胰岛素受体底物-1(insulin receptor substrate-1,IRS-1)、p-IRS-1、过氧化物酶体增殖物激 活 受 体γ(peroxisome proliferator-activated receptorγ,PPARγ)、葡萄糖转运蛋白4(glucose transporter protein 4,GLUT4)、蛋白激酶B(protein kinase B,AKT)、p-AKT、βactin,羊抗兔二抗,双荧光素酶报告基因检测试剂盒(英国abcam公司);实时荧光定量PCR(real-time quantitative PCR,qPCR)仪(美国ABI公司,型号:QuantStudio 3);全自动凝胶成像分析系统(上海Tanon公司,型号:4100)。
1.2 研究方法
1.2.1 细胞培养及模型建立 3T3L1小鼠前脂肪细胞在10%胎牛血清DMEM培养液中置于37℃、5%CO2培养箱中培养、传代,待细胞密度达70%,参考文献[8]添加含10 mg/L胰岛素、1μmol/L地塞米松、0.5 mmol/L IBMX的10%胎牛血清DMEM培养液诱导分化48 h,含10 mg/L胰岛素的DMEM培养液继续培养48 h,10%胎牛血清DMEM培养液再继续培养4 d,油红O染色鉴定细胞分化情况。添加10 ng/L TNF-α继续培养24 h,建立3T3L1脂肪细胞IR模型。
1.2.2 细胞分组 实验分为对照组、模型组、空载体组、GAS5过表达组、GAS5过表达+mimic NC组、GAS5过表达+miR-103 mimic组。对照组为3T3L1脂肪细胞,其余各组细胞为IR模型细胞,空载体组、GAS5过表达组、GAS5过表达+mimic NC组、GAS5过表达+miR-103 mimic组参考Lipofectamine™3000说明书分别转染pEGFP-C1空载体、pEGFP-C1-GAS5、pEGFP-C1-GAS5+mimic NC、pEGFP-C1-GAS5+miR-103 mimic,转染6 h。
1.2.3 qPCR检测细胞中GAS5、miR-103mRNA水平 收集转染并培养后的各组细胞,每组各收集3孔,每孔1 mL,每孔各加1 mL Trizol试剂,Trizol法提取细胞总RNA,cDNA合成试剂盒合成cDNA,qPCR检测细胞中GAS5、miR-103mRNA水 平。GAS5引 物:上 游5′-AAGCCATTGGCACACAG⁃GCATTAG-3′,下游5′-AGAACCATTAAGCTGGTCCAGGCA-3′;β-actin引物:上游5′-CTACAATGAGCTGCGTGTGG-3′,下游5′-AAGGAAGGCTGGAACAGTGC-3′;miR-103引物:上游5′-AGCAGCATTGTACAGGGCTATGAA-3′,下 游5′-TG⁃GTGTCGTGGAGTCG-3′;U6引物:上游5′-CGCTTCGGCAG⁃CAGCACATATAC-3′,下游5′-AATTTGCGTGTCATCCTTGC-3′。反应体系(20μL):1μL cDNA(200μg/L)、10μL 2×SYBR qPCR Mix、上游引物/下游引物(均为10μmol/L)0.5 μL/0.5μL,8μL ddH2O;反应条件:94℃60 s;95℃30 s,60℃30 s,40个循环。2-ΔΔCt法计算GAS5、miR-103mRNA相对表达水平。
1.2.4 液体闪烁法检测葡萄糖摄取能力 实验前1 d各组置于24孔板中,均用含0.2%胎牛血清白蛋白的无血清DMEM培养液培养过夜,用含0.2%胎牛血清白蛋白的Krebs-Ringer缓冲液作用2 h,每孔添加50μL含有1.85×105Bq(约5μCi)2-脱氧3[H]葡萄糖的2-脱氧葡萄糖混合液孵育5 min,磷酸盐缓冲液清洗,干燥后室温添加500μL Triton X-100裂解细胞30 min,取400μL裂解液于液闪计数器下检测葡萄糖摄取量。
1.2.5 Western blot检测细胞中IRS-1、p-IRS-1、PPARγ、GLUT4、AKT、p-AKT蛋白相对表达水平 磷酸盐缓冲液清洗细胞,添加蛋白裂解酶冰上裂解细胞10 min,收集至1.5 mL的EP管中,4℃、12 000 r/min离心20 min,收集上清液至新的EP管中即为总蛋白。BCA试剂盒测定蛋白浓度,每孔上样20μg,聚丙烯酰胺凝胶分离蛋白、NC转膜、5%脱脂奶粉室温封闭NC膜2 h,对应一抗IRS-1、p-IRS-1、PPARγ、GLUT4、AKT、p-AKT(稀释比例均为1∶300)、β-actin(1∶500),4℃孵育过夜;加入羊抗兔二抗(1∶1 000)室温孵育1 h,显色液避光显色,全自动凝胶成像分析系统检测蛋白表达情况。
1.2.6 双荧光素酶鉴定miR-103与GAS5的靶向位点 生物信息学在线网站Targetscan(http://www.targetscan.org/)预测miR-103与GAS5存在互补的结合位点;将miR-103与GAS5结合位点及突变位点的序列克隆重组至pGL3-basic荧光素酶报告载体上构建GAS5野生型(GAS5 WT)及突变型(GAS5 MUT)荧光素酶报告载体,分别与miR-103 mimic或mimic NC共转染至3T3L1脂肪细胞中,双荧光素酶报告基因检测试剂盒检测荧光素酶相对活性。
1.3 统计学方法 采用GraphPad Prim 8.0软件进行数据分析。符合正态分布的计量资料以±s表示,多组间比较行单因素方差分析,组间多重比较行SNK-q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 3T3L1脂肪细胞分化情况 诱导前,脂肪细胞呈梭形,与成纤维细胞形态类似,突触伸展于细胞间隙形成网状,细胞质中未见红色脂滴;诱导后,脂肪细胞呈圆形、胞体变大,胞浆丰富,含有大量脂滴,油红染色明显,呈“指环样”结构,模型构建成功,见图1。
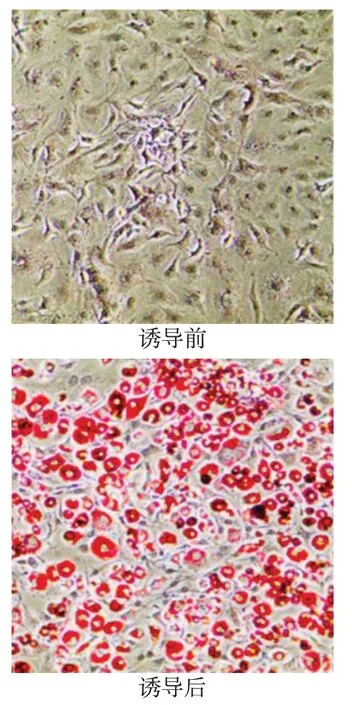
Fig.1 The establishment of 3T3L1 adipocyte models(Oil red O staining,×400)图1 3T3L1脂肪细胞模型制作(油红O染色,×400)
2.2 各组GAS 5、miR-103mRNA水平比较 与对照组比较,其他各组细胞中GAS 5mRNA水平降低,模型组、空载体组、GAS5过表达+miR-103 mimic组细胞中miR-103mRNA水平升高(P<0.05);与模型组、空载体组比较,GAS5过表达组、GAS5过表达+mimic NC组细胞中GAS5mRNA水平升高,而miR-103mRNA水平降低(P<0.05);与GAS5过表达组、GAS5过表达+mimic NC组比较,GAS5过表达+miR-103 mimic组细胞中GAS5mRNA水平降低,miR-103mRNA水平升高(P<0.05),见表1。
Tab.1 Comparison of GAS5,miR-103 mRNA levels and glucose uptake capacity between 6 groups of cells表1 6组细胞中GAS5、miR-103 mRNA水平和葡萄糖摄取能力比较 (n=6,±s)

Tab.1 Comparison of GAS5,miR-103 mRNA levels and glucose uptake capacity between 6 groups of cells表1 6组细胞中GAS5、miR-103 mRNA水平和葡萄糖摄取能力比较 (n=6,±s)
**P<0.01,a与对照组比较,b与模型组比较,c与空载体组比较,d与GAS5过表达组比较,e与GAS5过表达+mimic NC组比较,P<0.05;模型组、空载体组均不与GAS5过表达+miR-103 mimic组比较,未标注。
组别对照组模型组空载体组GAS5过表达组GAS5过表达+mimic NC组GAS5过表达+miR-103 mimic组F GAS5 mRNA 1.01±0.09 0.36±0.05a 0.35±0.06a 0.87±0.08abc 0.86±0.07abc miR-103 mRNA 0.99±0.08 3.47±0.32a 3.44±0.34a 1.39±0.15bc 1.40±0.15bc葡萄糖摄取(cpm)1 356.39±146.48 675.43±73.91a 684.79±76.36a 1 241.88±147.69bc 1 237.75±134.82bc 0.47±0.05ade 2.67±0.25ade 867.49±92.36ade 110.194**132.922**41.075**
2.3 各组葡萄糖摄取能力比较 与对照组比较,模型组、空载体组、GAS5过表达+miR-103 mimic组细胞葡萄糖摄取能力降低(P<0.05);与模型组、空载体组比较,GAS5过表达组、GAS5过表达+mimic NC组细胞葡萄糖摄取能力提高(P<0.05);与GAS5过表达组、GAS5过表达+mimic NC组比较,GAS5过表达+miR-103 mimic组细胞葡萄糖摄取能力降低(P<0.05),见表1。
2.4 各组IRS-1、p-IRS-1、PPARγ、GLUT4、AKT、p-AKT蛋白相对表达水平比较 与对照组比较,模型组、空载体组、GAS5过表达+miR-103 mimic组细胞中p-IRS-1/IRS-1、PPARγ、GLUT4、p-AKT/AKT蛋白水平降低,GAS5过表达组、GAS5过表达+mimic NC组细胞中PPARγ、GLUT4蛋白水平降低(P<0.05);与模型组、空载体组比较,GAS5过表达组、GAS5过表达+mimic NC组细胞中p-IRS-1/IRS-1、PPARγ、GLUT4、p-AKT/AKT蛋白水平升高(P<0.05);与GAS5过表达组、GAS5过表达+mimic NC组比较,GAS5过表达+miR-103 mimic组细胞中p-IRS-1/IRS-1、PPARγ、GLUT4、p-AKT/AKT蛋白水平降低(P<0.05)。见图2、表2。
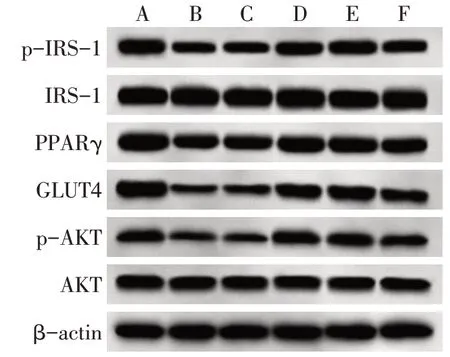
Fig.2 Protein levels of IRS-1,p-IRS-1,PPARγ,GLUT4,AKT,and p-AKT in 6 groups of cells图2 各组细胞中IRS-1、p-IRS-1、PPARγ、GLUT4、AKT、p-AKT蛋白相对表达水平
2.5 miR-103与GAS5的靶向位点验证 生物信息学分析miR-103与GAS5存在互补的结合位点,见图3。mimic NC+GAS5 WT组、miR-103 mimic+GAS5 WT、mimic NC+GAS5 MUT、miR-103 mimic+GAS5 MUT的荧光素酶相对活性分别为1.01±0.12、0.48±0.06、0.99±0.08、0.98±0.11,差异有统计学意义(n=6,F=43.419,P<0.05),其中与mimic NC+GAS5 WT比较,miR-103 mimic+GAS5 WT荧光素酶相对活性下降(P<0.05);mimic NC+GAS5 MUT与miR-103 mimic+GAS5 MUT荧光素酶相对活性差异无统计学意义(P>0.05)。

Fig.3 Targeting sites of miR-103 and GAS5图3 miR-103与GAS5的靶向位点
3 讨论
目前,临床主要通过胰岛素增敏剂噻唑烷二酮类药物改善IR,促进前脂肪向脂肪转化、增加细胞内游离脂肪酸的含量和细胞内三酰甘油的积聚,从而降低血浆游离脂肪酸水平,增加组织对胰岛素的敏感性[9-10];但会增加患者饥饿感,促进患者饮食,导致体质量和体脂比例增加,造成肥胖[11]。因此,寻找能调控IR的基因,避免药物影响,对IR相关疾病治疗可能更有意义。本研究结果显示,制备IR模型后,与对照组比较,模型组细胞中GAS5mRNA水平降低、miR-103mRNA水平升高,表明IR模型中GAS5、miR-103基因表达水平发生改变,提示在IR中基因表达水平变化可能影响疾病,改变基因表达水平可能作为新的治疗方法。
LncRNA已成为生物学研究热点之一,其参与IR发生、发展,成为代谢疾病发展过程中肝脏IR的精确指标,可用于IR相关疾病的早期诊断和治疗[12]。过表达H19可通过靶向调节异质性胞核核糖核蛋白A1,促进脂肪酸氧化,进而减少骨骼肌中异位脂质积累,改善IR[13]。GAS5位于1q25.1染色体上,在生长停滞成纤维细胞内首次被发现,靶向提高GAS5水平,可增加脂肪细胞中胰岛素受体的表达[14]。GAS5作为糖皮质激素受体拟似物,通过竞争性结合糖皮质激素,达到抑制糖皮质激素的生物学效应目的,而糖皮质激素对IR具有促进作用[15]。本研究结果显示,与模型组比较,GAS5过表达组细胞中GAS5mRNA表达水平、葡萄糖摄取能力、细胞中p-IRS-1/IRS-1、PPARγ、GLUT4、p-AKT/AKT蛋白水平升高,表明GAS5过表达可提高细胞的葡萄糖摄取能力,提示该作用可能与IRS-1相关蛋白表达水平有关。IRS-1作为胰岛素信号通路连接细胞外蛋白,其活化水平影响胰岛素的生理效应,IR发生时,受炎症、高胰岛素血症影响,IRS-1磷酸化减弱,胰岛素信号通路被抑制,进一步加重IR[16]。PPARγ是活化配体的核受体超家族的一个成员,在IR时水平降低,具有胰岛素增敏功能;PPARγ直接调控的下游靶蛋白GLUT4在IR时下调,可减少细胞对葡萄糖转运摄取,引发脂肪IR[17]。Feng等[18]研究显示,IRS-1/PI3K/AKT信号通路在糖原合成、葡萄糖转运中发挥重要作用,上调IRS-1、AKT的磷酸化水平,可促进胰岛素信号转导,减轻IR引起的肝损伤。本研究亦显示,GAS5能够促进p-IRS-1/IRS-1、PPARγ、GLUT4、p-AKT/AKT蛋白表达,恢复胰岛素信号转导,减轻IR。
Tab.2 Comparison of protein levels of IRS-1,p-IRS-1,PPARγ,GLUT4,AKT and p-AKT between 6 groups of cells表2 6组细胞中IRS-1、p-IRS-1、PPARγ、GLUT4、AKT、p-AKT蛋白水平比较 (n=6,±s)
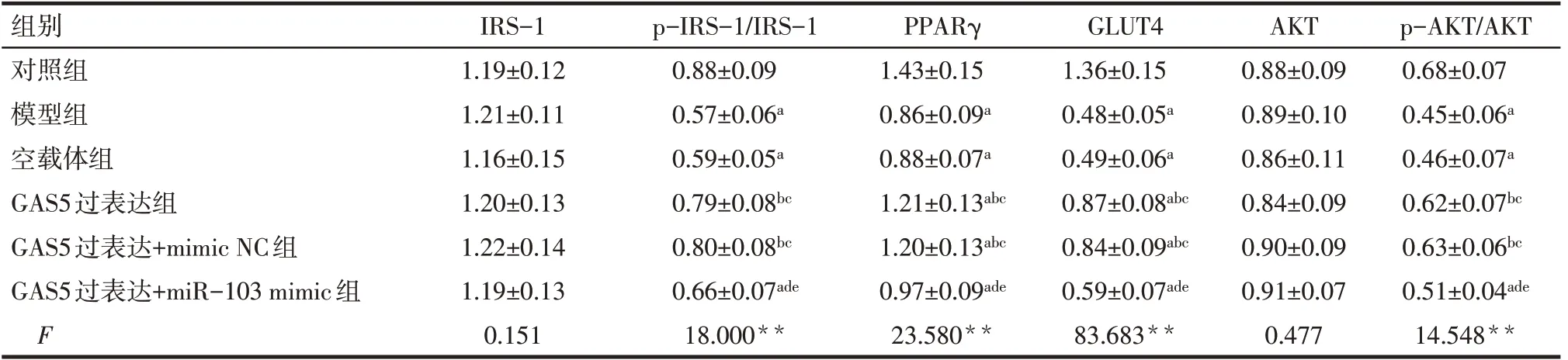
Tab.2 Comparison of protein levels of IRS-1,p-IRS-1,PPARγ,GLUT4,AKT and p-AKT between 6 groups of cells表2 6组细胞中IRS-1、p-IRS-1、PPARγ、GLUT4、AKT、p-AKT蛋白水平比较 (n=6,±s)
**P<0.01;a与对照组比较,b与模型组比较,c与空载体组比较,d与GAS5过表达组比较,e与GAS5过表达+mimic NC组比较,P<0.05;模型组、空载体组均不与GAS5过表达+miR-103 mimic组比较,未标注。
组别对照组模型组空载体组GAS5过表达组GAS5过表达+mimic NC组GAS5过表达+miR-103 mimic组F IRS-1 1.19±0.12 1.21±0.11 1.16±0.15 1.20±0.13 1.22±0.14 1.19±0.13 0.151 p-IRS-1/IRS-1 0.88±0.09 0.57±0.06a 0.59±0.05a 0.79±0.08bc 0.80±0.08bc 0.66±0.07ade 18.000**PPARγ 1.43±0.15 0.86±0.09a 0.88±0.07a 1.21±0.13abc 1.20±0.13abc 0.97±0.09ade 23.580**GLUT4 1.36±0.15 0.48±0.05a 0.49±0.06a 0.87±0.08abc 0.84±0.09abc 0.59±0.07ade 83.683**AKT 0.88±0.09 0.89±0.10 0.86±0.11 0.84±0.09 0.90±0.09 0.91±0.07 0.477 p-AKT/AKT 0.68±0.07 0.45±0.06a 0.46±0.07a 0.62±0.07bc 0.63±0.06bc 0.51±0.04ade 14.548**
miRNA在IR中发挥重要作用,miR-103为GAS5靶位点之一,可影响IR,并通过抑制PI3K/AKT通路的激活,引起多囊卵巢综合征、肥胖、胰岛素抵抗、雄激素过多、不孕等[19]。miR-103在抑郁症合并IR中与IR指数、抑郁严重程度呈正相关,且为IR指数的影响因素[20]。在本研究中,双荧光酶靶向关系结果证实,miR-103是GAS5的靶位点,升高GAS5的表达能够降低miR-103的表达,在升高GAS5的基础上过表达miR-103能够降低葡萄糖摄取,降低细胞中p-IRS-1/IRS-1、PPARγ、GLUT4、p-AKT/AKT蛋白表达水平,且miR-103在IR时高表达;miR-103能够逆转GAS5功能,提示在脂肪细胞IR中GAS5低表达,升高GAS5的表达能够靶向抑制miR-103的表达,从而缓解脂肪细胞IR。
综上所述,升高GAS5的表达能够抑制脂肪细胞IR,可能与靶向抑制miR-103有关,但miR-103的下游靶基因较多,其具体靶向蛋白尚需进一步研究。
