分泌型丛生蛋白通过抑制线粒体自噬缓解H2O2诱导的心肌细胞损伤
2022-02-25贺静孙晓慧杨莉乌宇亮
贺静,孙晓慧△,杨莉,乌宇亮
活性氧(reactive oxygen species,ROS)在氧化应激条件下可在心肌细胞内过量聚集而引起细胞毒性,造成心肌细胞的凋亡和功能失调[1]。丛生蛋白(clusterin,CLU)是一种多功能伴侣蛋白,可分为分泌型和核型。其与氧化还原反应关系密切,是氧化应激反应的感受器,可保护细胞抵抗应激反应。研究显示,CLU可以通过抑制线粒体片段化进而抑制缺血、缺氧条件下的视网膜血管内皮细胞凋亡,从而保护内皮细胞[2]。在心肌梗死患者血清中,分泌型CLU(secretory clusterin,sCLU)水平显著升高[3-4]。然而,sCLU对心肌细胞氧化应激损伤的作用尚不清楚。本研究拟探讨sCLU对氧化应激条件下心肌细胞损伤的作用及其可能的作用机制,以期为心肌氧化应激损伤的治疗提供新思路。
1 材料与方法
1.1 主要材料与试剂 大鼠心肌细胞H9C2购自中科院上海细胞库。DMEM培养基购自美国Gibco公司。胎牛血清购自浙江天杭生物科技股份有限公司。MTT试剂盒、磷酸盐缓冲溶液(phosphate buffered solution,PBS)购自武汉博士德生物工程有限公司。H2O2购自国药集团化学试剂有限公司。大鼠sCLU酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒购自上海酶联生物科技有限公司。丙二醛(malonaldehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒购自南京建成生物工程研究所有限公司。Trizol试剂盒、反转录试剂盒购自宝日医生物技术(北京)有限公司。实时荧光定量聚合酶链式反应(qPCR)引物由生工生物工程(上海)股份有限公司合成。SuperReal PreMix Plus(SYBR Green)购自天根生化科技(北京)有限公司。ECL化学发光试剂盒、RIPA裂解液、聚氰基丙烯酸正丁酯(bicinchoninic acid,BCA)蛋白浓度测定试剂盒、DCFH-DA荧光探针、原位末端转移酶标记(TUNEL)细胞凋亡检测试剂盒购自上海碧云天生物技术有限公司。脂质体LipofetamineTM2000购自美国Invitrogen公司。线粒体自噬抑制剂Mdivi-1购自美国Sigma公司。sCLU过表达载体pcDNA3.1-sCLU由广州锐博生物科技有限公司合成。兔抗大鼠CLU单克隆抗体、兔抗大鼠磷酸酶及张力蛋白同源物诱导的蛋白激酶1(PTEN induced putative kinase 1,PINK1)、小鼠抗大鼠Parkin单克隆抗体、兔抗大鼠微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)单克隆抗体、兔抗大鼠甘油醛-3-磷酸脱氢酶(GAPDH)单克隆抗体、辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔免疫球蛋白G(IgG)、HRP标记的山羊抗小鼠IgG购自英国Abcam公司。
1.2 研究方法
1.2.1 H9C2细胞的培养及分组 采用快速融化法[5]复苏H9C2细胞,用含10%胎牛血清、1×105U/L青霉素、100 g/L链霉素的DMEM培养基,置于37℃、5%CO2培养箱中常规培养。每2~3 d传代1次,选取对数生长期的心肌细胞备用。实验分3个部分。(1)实验1。对数生长期的心肌细胞分为Control组(仅更换培养基)和H2O2组(100μmol/L H2O2处理)。(2)实验2。对数生长期的心肌细胞分为Control组(仅更换培养基)、pcDNA3.1组(转染pcDNA3.1对照空质粒)、pcDNA3.1-sCLU组(转染pcDNA3.1-sCLU过表达质粒)、H2O2组(100μmol/L H2O2处理)、H2O2+pcDNA3.1组(pcDNA3.1对照空质粒转染48 h后加入100μmol/L H2O2处理)、H2O2+pcDNA3.1-sCLU组(pcDNA3.1-sCLU过表达质粒转染48 h后加入100μmol/L H2O2处理)。(3)实验3。对数生长期的心肌细胞分为DMSO组(加入1%体积分数的DMSO)、Mdivi-1组(10μmol/L的Mdivi-1处理)、H2O2+DMSO组(加入1%体积分数的DMSO处理30 min后加入100μmol/L的H2O2处理)、H2O2+Mdivi-1组(10μmol/L的Mdivi-1处理30 min后加入100μmol/L的H2O2处 理)、H2O2+pcDNA3.1-sCLU组(pcDNA3.1-sCLU过表达质粒转染48 h后加入100μmol/L H2O2处理)、H2O2+pcDNA3.1-sCLU+Mdivi-1组(pcDNA3.1-sCLU过表达质粒转染48 h后加入10μmol/L的Mdivi-1处理30 min,再加入100μmol/L H2O2处理)。
1.2.2 qPCR检测细胞中sCLUmRNA表达水平 收集1.2.1分组中实验1各组细胞,采用Trizol试剂提取各组细胞总RNA,检测RNA纯度和浓度。采用反转录反应试剂盒合成cDNA。反应总体积20μL:SuperReal PreMix Plus 10μL,上、下游引物各0.8μL,cDNA模板2μL,ROX Reference Dye 0.4μL,无RNA酶双蒸水6μL。反应条件:95℃15 min;95℃10 s,60℃30 s,40个循环。sCLU引物:上游5′-TGCCTCTCTCCCACTACGG-3′,下 游5′-CTCCTTGCACACT⁃GTCGGG-3′;GAPDH引物:上游5′-GGAGAGTGTTTCCTC⁃GTCCC-3′,下游5′-ACTGTGCCGTTGAATTTGCC-3′。采用2-ΔΔCt法计算目的基因的相对表达量。
1.2.3 ELISA检测培养液上清液中sCLU蛋白含量 收集1.2.1分组中实验1各组细胞培养液上清液,采用ELISA试剂盒检测培养上清中sCLU的含量。将100μL的各处理组细胞培养上清液加入酶标板,37℃孵育2 h。弃上清液后加入100μL sCLU抗体工作液孵育1 h。洗涤3次加入100μL亲和链霉素-HRP孵育30 min,TMB显影液显影。在450 nm波长处检测样品吸光度(A)值。根据标准品绘制标准曲线并计算样品浓度。
1.2.4 Western blot检测细胞中CLU、PINK1、Parkin、LC3蛋白表达 收集1.2.1分组中实验1、实验2各组细胞。采用0.05%胰蛋白酶消化,PBS洗涤3次;加入450μL RIPA蛋白裂解液裂解细胞,提取细胞总蛋白。采用BCA蛋白浓度测定试剂盒检测蛋白浓度。各组分别取30μg蛋白上样,SDS-PAGE蛋白电泳;电泳结束后将蛋白转移到硝酸纤维素膜上,用5%脱脂奶粉封闭,按照常规的方法加入CLU、PINK1、Parkin、LC3、GAPDH抗体(均1∶1 000稀释),4℃孵育过夜;TBST缓冲液洗膜3次;加入HRP标记的羊抗兔IgG(1∶5 000),室温孵育2 h;TBST缓冲液洗涤;采用ECL化学发光试剂盒显色。Image J 1.8.0图像分析系统分析灰度值,计算目的蛋白相对表达水平。
1.2.5 MTT法检测细胞活力 将1.2.1分组中实验2、实验3各组细胞接种于96孔板,每孔200μL,含2×104个细胞,每组设3个复孔。每孔加入MTT溶液(5 g/L)10μL,孵育4 h,弃上清液,按每孔100μL加入二甲基亚砜(DMSO),震荡10 min,酶标仪490 nm处读取A值,设对照组细胞活力为100%,计算其余各处理组细胞活力。处理组细胞活力=(处理组A值/对照组A值)×100%。
1.2.6 TUNEL试剂盒检测细胞凋亡 将1.2.1分组中实验2、实验3各组细胞接种于6孔板中,4%多聚甲醛固定25 min,PBS洗涤2次,0.2%的TritonX-100处理5 min,漂洗2次,加入50μL TUNEL反应混合液,37℃避光孵育1 h。漂洗后加入DAPI染核,抗荧光淬灭封片液封片后,荧光显微镜(×200)下观察(激发波长550 nm)各组细胞红色荧光阳性细胞所占比例,即为细胞凋亡率。
1.2.7 MDA和SOD水平检测 将1.2.1分组中实验2各组细胞接种于6孔板中,培养结束后收集各组细胞的上清液,依据试剂盒说明书,检测各组细胞中MDA和SOD水平。
1.2.8 DFCH-DA荧光探针测定细胞ROS水平 将1.2.1分组中实验2各组细胞接种于6孔板中,用血清将DCFH-DA按照1∶1 000稀释制备试剂,加入6孔板中,每孔1 mL,37℃培养箱中孵育30 min。吸掉培养液,无血清DMEM洗涤3次。收集细胞,荧光显微镜(×200)下观察(激发波长488 nm)各组细胞的荧光强度。ROS水平以相对于Control组的相对荧光强度表示。
1.3 统计学方法 采用GraphPad 7.0软件进行数据分析。符合正态分布的计量资料以均数±标准差(±s)表示,2组间均数比较采用t检验;多组间比较采用单因素方差分析,组间多重比较采用Tukey检验(方差齐)或Dunnett’s T3法检验(方差不齐)。以P<0.05为差异有统计学意义。
2 结果
2.1 实验1 与Control组比较,H2O2组细胞中sCLUmRNA、细胞培养上清液中sCLU蛋白及细胞中CLU蛋白表达水平均降低(P<0.01),见表1、图1。
Tab.1 Comparison of the relative mRNA and protein levels of CLU in cells,and the protein levels of sCLU in the medium of H9C2 cells between the control group and the H 2O2 group表1 Control组和H 2O2组细胞中sCLU mRNA和蛋白相对表达水平、细胞培养上清液中sCLU蛋白水平的比较(n=3,±s)

Tab.1 Comparison of the relative mRNA and protein levels of CLU in cells,and the protein levels of sCLU in the medium of H9C2 cells between the control group and the H 2O2 group表1 Control组和H 2O2组细胞中sCLU mRNA和蛋白相对表达水平、细胞培养上清液中sCLU蛋白水平的比较(n=3,±s)
**P<0.01。
组别Control组H2O2组t sCLU mRNA 1.03±0.05 0.39±0.09 10.700**CLU蛋白0.98±0.09 0.56±0.08 6.298**细胞培养上清液sCLU蛋白(ng/L)237.90±25.12 80.05±17.06 9.002**

Fig.1 Comparison of the protein levels of CLU between the control group and the H2O2 group图1 Control组和H2O2组细胞中CLU蛋白表达水平的比较
2.2 实验2
2.2.1 各组细胞活力和凋亡水平比较 与Control组比较,pcDNA3.1组和pcDNA3.1-sCLU组细胞活力及细胞凋亡率差异均无统计学意义,H2O2组、H2O2+pcDNA3.1组细胞活力降低,细胞凋亡率升高(P<0.05),H2O2+pcDNA3.1-sCLU组细胞凋亡率升高(P<0.05),但细胞活力差异无统计学意义。与H2O2组比较,H2O2+pcDNA3.1组细胞活力及细胞凋亡率差异均无统计学意义,H2O2+pcDNA3.1-sCLU组细胞活力升高,细胞凋亡率下降(P<0.05),见表2、图2。
2.2.2 各组细胞ROS、MDA和SOD水平的比较 与Control组比较,pcDNA3.1组和pcDNA3.1-sCLU组细胞ROS、MDA和SOD水平差异均无统计学意义,H2O2组、H2O2+pcDNA3.1组、H2O2+pcDNA3.1-sCLU组ROS、MDA水平均升高,SOD水平均降低(P<0.05)。与H2O2组比较,H2O2+pcDNA3.1组细胞ROS、MDA和SOD水平差异均无统计学意义,H2O2+pcDNA3.1-sCLU组ROS和MDA水平均降低(P<0.05),SOD水平升高(P<0.05),见图3、表3。
Tab.2 Comparison of the viability and apoptosis levels between the six groups of cells表2 各组细胞活力和凋亡率的比较(n=3,%,±s)
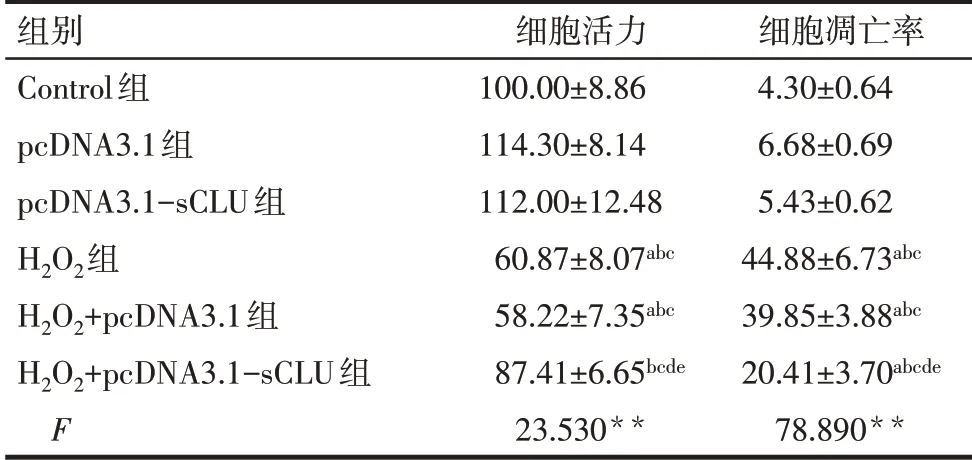
Tab.2 Comparison of the viability and apoptosis levels between the six groups of cells表2 各组细胞活力和凋亡率的比较(n=3,%,±s)
**P<0.01;a与Control组比 较,b与pcDNA3.1组比 较,c与pcDNA3.1-sCLU组比较,d与H2O2组比较,e与H2O2+pcDNA3.1组比较,P<0.05。
组别Control组pcDNA3.1组pcDNA3.1-sCLU组H2O2组H2O2+pcDNA3.1组H2O2+pcDNA3.1-sCLU组F细胞活力100.00±8.86 114.30±8.14 112.00±12.48 60.87±8.07abc 58.22±7.35abc 87.41±6.65bcde 23.530**细胞凋亡率4.30±0.64 6.68±0.69 5.43±0.62 44.88±6.73abc 39.85±3.88abc 20.41±3.70abcde 78.890**

Fig.2 Comparison of the apoptosis levels between the six groups(Bar=100μm)图2 各组细胞凋亡水平的比较(标志线=100μm)

Fig.3 Comparison of the ROS levels between the six groups(Bar=100μm)图3 各组细胞ROS水平的比较(标志线=100μm)
Tab.3 Comparison of the ROS,MDA and SOD levels between the six groups表3各组细胞ROS、MDA和SOD水平的比较(n=3,%,±s)
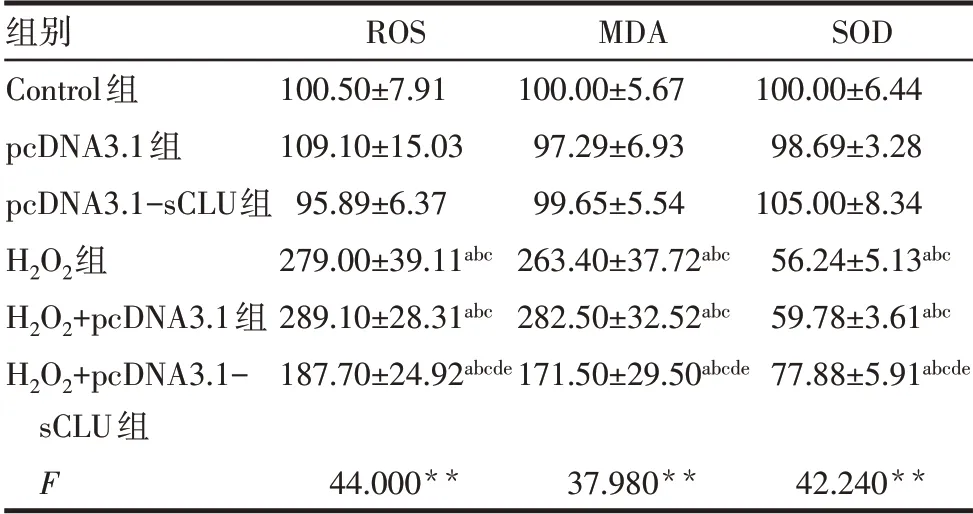
Tab.3 Comparison of the ROS,MDA and SOD levels between the six groups表3各组细胞ROS、MDA和SOD水平的比较(n=3,%,±s)
**P<0.01;a与Control组比 较,b与pcDNA3.1组比 较,c与pcDNA3.1-sCLU组比较,d与H2O2组比较,e与H2O2+pcDNA3.1组比较,P<0.05。
组别Control组pcDNA3.1组pcDNA3.1-sCLU组H2O2组H2O2+pcDNA3.1组H2O2+pcDNA3.1-sCLU组F ROS 100.50±7.91 109.10±15.03 95.89±6.37 279.00±39.11abc 289.10±28.31abc 187.70±24.92abcde MDA 100.00±5.67 97.29±6.93 99.65±5.54 263.40±37.72abc 282.50±32.52abc 171.50±29.50abcde SOD 100.00±6.44 98.69±3.28 105.00±8.34 56.24±5.13abc 59.78±3.61abc 77.88±5.91abcde 44.000**37.980**42.240**
2.2.3 各组细胞PINK1、Parkin和LC3蛋白表达水平的比较 与Control组比较,pcDNA3.1组和pcDNA3.1-sCLU组细胞PINK1、Parkin蛋白表达水平和LC3-Ⅱ/LC3-Ⅰ比值差异均无统计学意义,H2O2组和H2O2+pcDNA3.1组细胞PINK1和Parkin蛋白表达水平均升高,LC3-Ⅱ/LC3-Ⅰ比值均降低(P<0.05),H2O2+pcDNA3.1-sCLU组PINK1和Parkin蛋白表达水平及LC3-Ⅱ/LC3-Ⅰ比值差异均无统计学意义。与H2O2组比较,H2O2+pcDNA3.1组细胞PINK1和Parkin蛋白表达水平及LC3-Ⅱ/LC3-Ⅰ比值差异均无统计学意义,H2O2+pcDNA3.1-sCLU组PINK1和Parkin蛋白表达水平降低,LC3-Ⅱ/LC3-Ⅰ比值升高(P<0.05),见图4、表4。

Fig.4 The protein levels of PINK1,Parkin and LC3 in each group图4 各组细胞PINK1、Parkin和LC3蛋白表达水平
Tab.4 Comparison of the protein levels of PINK 1,Parkin and LC3 between the six groups表4 各组细胞PINK1、Parkin和LC3蛋白表达水平的比较(n=3,±s)

Tab.4 Comparison of the protein levels of PINK 1,Parkin and LC3 between the six groups表4 各组细胞PINK1、Parkin和LC3蛋白表达水平的比较(n=3,±s)
**P<0.01;a与Control组比较,b与pcDNA3.1组比较,c与pcDNA3.1-sCLU组比较,d与H2O2组比较,e与H2O2+pcDNA3.1组比较,P<0.05。
组别Control组pcDNA3.1组pcDNA3.1-sCLU组H2O2组H2O2+pcDNA3.1组H2O2+pcDNA3.1-sCLU组F PINK1 1.00±0.06 0.98±0.08 0.92±0.15 1.96±0.24abc 1.84±0.21abc 1.33±0.09de 26.190**Parkin 1.00±0.08 1.07±0.11 1.12±0.12 1.95±0.17abc 1.91±0.16abc 1.16±0.14de 33.040**LC3-Ⅱ/LC3-Ⅰ1.00±0.04 1.07±0.09 1.08±0.10 0.65±0.09abc 0.66±0.12abc 1.08±0.13de 14.180**
2.3 各组细胞活力和凋亡水平的比较(实验3)与DMSO组比较,Mdivi-1组细胞活力与细胞凋亡率差异均无统计学意义,H2O2+DMSO组细胞活力下降,而细胞凋亡率升高(P<0.05)。与H2O2+DMSO组比较,H2O2+Mdivi-1组、H2O2+pcDNA3.1-sCLU组和H2O2+pcDNA3.1-sCLU+Mdivi-1组细胞活力均升高,细胞凋亡率均降低(P<0.05)。与H2O2+Mdivi-1组比较,H2O2+pcDNA3.1-sCLU组和H2O2+pcDNA3.1-sCLU+Mdivi-1组细胞活力差异均无统计学意义,细胞凋亡率降低(P<0.05)。与H2O2+pcDNA3.1-sCLU组比较,H2O2+pcDNA3.1-sCLU+Mdivi-1组细胞活力及细胞凋亡率差异无统计学意义,见表5。
3 讨论
心血管疾病中,心肌损伤的很大一部分原因来自缺血过程中细胞的氧化应激产生的氧自由基[6]。CLU是一种广泛存在于人体组织和体液中,具有分子伴侣活性,可与多种分子结合并发挥多种功能的蛋白[7]。CLU可分为sCLU和核型。研究发现,sCLU参与多种重要的生理过程,包括细胞凋亡[8]、炎症反应[9]、内质网应激反应[10]、细胞黏附及组织修复[11]等,并与肿瘤的发生和发展关系密切[12]。此外,Turkieh等[3]发现,H9C2细胞中过表达sCLU可以降低蛋白酶体抑制剂MG-132诱导的细胞凋亡。小鼠心脏移植过程中,应用重组CLU保存的离体心脏受损程度降低,表现为细胞凋亡、中性粒细胞浸润和促炎因子分泌减少[13]。因此,sCLU可能作为氧化应激条件下的氧化还原传感器,对氧化应激损伤的细胞发挥保护作用。Polimeno等[14]也发现,H2O2诱导的胶质瘤细胞氧化损伤模型中sCLU蛋白表达水平降低。本研究应用H2O2处理离体培养的大鼠心肌细胞,结果发现,与Control组比较,H2O2组细胞中sCLUmRNA、细胞培养上清液中sCLU蛋白及细胞中总CLU蛋白相对表达水平均降低,提示sCLU可能在细胞氧化应激损伤过程中发挥保护作用。Jun等[15]研究发现,CLU可以通过激活Akt和GSK-3β信号通路而保护心肌细胞免受氧化应激损伤的影响。本研究结果亦显示,与Control组比较,H2O2组细胞活力降低,细胞凋亡率升高,ROS和MDA水平升高,SOD水平降低,证实H2O2能够通过氧化应激诱导心肌细胞损伤;另外,与H2O2组比较,H2O2+pcDNA3.1-sCLU组细胞活力升高,细胞凋亡率下降,ROS和MDA水平降低,SOD水平升高,再次证实sCLU过表达能减轻氧化应激对心肌细胞的损伤。另有研究显示,CLU过表达还可保护骨关节炎软骨细胞及肾足突细胞抵御氧化应激损伤[16-17],而在骨肉瘤、前列腺肿瘤等细胞中敲低CLU则可增强肿瘤细胞对氧化应激损伤的敏感性[18]。结合本研究,笔者认为CLU有保护细胞抵御氧化应激损伤的作用。
Tab.5 Comparison of the viability and apoptosis levels between the six groups表5 各组细胞活力和凋亡率的比较(n=3,±s)

Tab.5 Comparison of the viability and apoptosis levels between the six groups表5 各组细胞活力和凋亡率的比较(n=3,±s)
**P<0.01;a与DMSO组比较,b与Mdivi-1组比较,c与H2O2+DMSO组比较,d与H2O2+Mdivi-1组比较,e与H2O2+pcDNA3.1-sCLU组比较,P<0.05。
组别DMSO组Mdivi-1组H2O2+DMSO组H2O2+Mdivi-1组H2O2+pcDNA3.1-sCLU组H2O2+pcDNA3.1-sCLU+Mdivi-1组F细胞活力(%)100.00±4.84 94.48±3.07 59.50±6.54ab 78.56±4.65abc 87.87±7.54c 89.77±6.81c 18.630**细胞凋亡率(%)5.56±1.43 9.43±2.69 48.55±4.48ab 30.53±4.70abc 20.49±2.69abcd 17.18±2.69acd 67.280**
既往研究显示,CLU可以通过参与氧化应激、炎症、胰岛素生长因子1信号通路、KU70/BAX信号通路、肿瘤坏死因子α信号通路及丝裂原活化蛋白激酶信号通路等途径在心肌细胞中发挥作用[19]。本研究发现,与Control组比较,pcDNA3.1-sCLU组细胞活力、细胞凋亡率、ROS和MDA水平、SOD的差异无统计学意义,考虑可能是由于CLU仅在氧化应激等特定条件下才发挥相应的作用。He等[17]研究也发现,单独采用外源性CLU刺激肾足突细胞对细胞活力及氧化应激水平无显著影响。
线粒体自噬是一种以线粒体为目标的特殊自噬形式,其对整个线粒体网络的功能完整性和细胞存活具有重要作用。线粒体自噬通过调节线粒体的质量与数量维持心肌细胞的正常功能,线粒体自噬过度或不足均可影响心肌细胞的功能,甚至导致心肌细胞死亡。线粒体自噬过程受多种途径调控,PINK1/Parkin是线粒体自噬中研究最多的信号通路,而氧化应激是Pink1/Parkin介导的线粒体自噬发生的重要始动因素[20]。因此,本研究分析了sCLU在心肌细胞中是否通过PINK1/Parkin介导的线粒体自噬发挥抗氧化应激损伤作用,结果显示,与Control组比较,H2O2组PINK1和Parkin蛋白表达水平升高,且细胞活力下降,细胞凋亡率升高,表明H2O2过度激活了线粒体自噬,进而导致心肌细胞损伤;与H2O2组比较,H2O2+pcDNA3.1-sCLU组PINK1和Parkin蛋白表达水平降低,表明sCLU过表达抑制了线粒体自噬,同时细胞活力升高,细胞凋亡率下降。本研究进一步采用线粒体自噬抑制剂Mdivi-1处理细胞,结果发现,与H2O2+DMSO组比较,H2O2+Mdivi-1组、H2O2+pcDNA3.1-sCLU组和H2O2+pcDNA3.1-sCLU+Mdivi-1组细胞活力均升高,细胞凋亡率均下降;与H2O2+Mdivi-1组比较,H2O2+pcDNA3.1-sCLU组和H2O2+pcDNA3.1-sCLU+Mdivi-1组细胞活力无显著变化,细胞凋亡率降低,提示sCLU对氧化应激条件下H9C2细胞损伤的保护作用可能通过抑制线粒体自噬活性实现。另有研究显示,在口腔癌细胞中sCLU可以通过AMPK/Akt/mTOR通路促进线粒体自噬,进而提升口腔癌细胞在饥饿条件下的生存能力[21]。然而,在氧化应激损伤的心肌细胞中,sCLU调控PINK1/Parkin的分子机制尚不明确。
综上所述,sCLU可对氧化应激条件下的心肌细胞产生保护作用,其机制可能与抑制线粒体自噬的活化有关。sCLU有望成为一个新的治疗心肌氧化应激损伤的潜在靶标分子。
