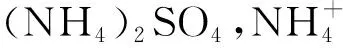高中化学反应图像问题的分析
2022-02-24毛健
毛 健
(安徽省颍上第一中学 236200)
高中化学图像类问题涉及知识点多,对学生读图以及迁移知识的能力要求较高.教学中为帮助学生更好的突破不同化学反应图像问题,增强其解题的自信,应结合具体教学内容做好相关例题的筛选与讲解,使其更好的把握相关细节,在解题中少走弯路,实现解题能力的进一步提高.
1 反应物质的定性分析
化学反应物质的定性分析相对来说难度不大,只要大致掌握化学反应的过程不难得出正确的分析结论.但是部分习题的反应过程掌握需要从图像进行突破.解题时应认真读图,结合图像的上升、下降趋势以及拐点,准确判断生成物的生成过程以及生成物类型,掌握相关物质的反应的顺序,思考何时生成沉淀、沉淀是增加还是减少、沉淀增加和减少的原因是什么等.
例1将Ba(OH)2溶液逐滴加入到含有1mol MgSO4和4mol HCl的混合溶液中,产生的沉淀质量m和加入的物质的量n之间的关系如图1所示,则( ).

图1
A.a→b产生的沉淀为Mg(OH)2和BaSO4
B.b→c发生的离子反应为

C.c→d时离子物质的量Ba2+可能大于Cl-
D.d→e时Ba2+的物质的量一定大于OH-
分析由题意可知a→b的反应
沉淀只有BaSO4;b→c,沉淀量未发生变化,发生的离子反应为

c→d沉淀量继续增加,发生的反应为

d点时的溶质为BaCl2,此时Ba2+的物质的量小于Cl-;d→e时的溶质为Ba(OH)2、BaCl2,因此,Ba2+的物质的量不一定大于OH-.综上可知只有B项正确.
2 反应物质的定量判断
对反应物质进行定量判断应用的知识较多,如各种守恒关系、化学方程式等,对学生分析问题以及计算能力具有一定要求.针对部分图像类的习题,难度较大,需要综合考虑的内容较多,不仅需要搞清楚坐标轴表示的含义,还需要明白各个阶段发生反应的化学方程式,反应后的产物等,必要情况下还需要配平化学方程式,而后根据给出的参数进行相关的计算.
例2将铁粉逐渐加入到200 mL 2 mol/L的HNO3溶液中直至过量,假设仅生成一种气体.整个过程中n(Fe2+)和n(Fe)变化关系如图2所示,则( ).

图2
A.当0 B.向c点反应溶液中加入盐酸无明显现象 C.当加入的铁粉的物质的量在0.1mol~0.15mol时,溶液中n(Fe3+)=(0.3-2n)mol D.图中a=0.15,b=0.15 n(HNO3)=0.4mol,则消耗n(Fe)=0.1mol,即b=0.1mol,生成的n(Fe3+)=0.1mol,反应剩余Fe的物质的量为(n-0.1)mol,其会和Fe3+发生反应,容易求得生成的n(Fe3+)=(2n-0.2)mol,则溶液中剩余n(Fe3+)=0.1mol-(2n-0.2)mol=(0.3-2n)mol,选择C项. 可逆反应是高中化学的重要反应,与化学平衡知识有着密切的联系.结合可逆反应平衡图像,对可逆反应相关参数进行分析是高考的热门考点.分析可逆反应图像时需具体问题具体分析,根据不同条件下图像的变化规律,明确反应吸放热以及反应前后分子量变化情况.而后观察图像中图线的变化规律,思考影响其走向的原因,最后结合所学的列下特列原理对相关参数的变化进行判断. 例3使用CO可以合成甲醇(CH3OH)的化学方程式为 按照相同的物质的量进行投料,在不同的温度条件下CO转化率和压强的关系如图3所示,则( ). 图3 A.温度T1>T2>T3 B.正反应速率v(a)>v(c),v(b)>v(d) C.平衡常数K(a)>K(c),K(b)=K(d) D.平均摩尔质量M(a) 分析解答该题的关键在于正确判断平衡移动方向.因反应为放热反应,升高温度平衡逆向移动,CO的转化率降低,温度越高对应的图线越在下面,结合图像可知T1 比较溶液中离子浓度大小是高中化学的重点难点知识.解答该类问题应用的知识点较多主要有离子反应、水的电离、弱电解质的水解等.部分习题与图象结合起来进行设问,较为抽象,难度较大,需要认真审题,结合所学的化学知识,充分挖掘图像中的隐含信息,搞清楚各段图线对应的化学反应以及溶液中的溶质.同时,注重灵活应用电荷守恒,物料守恒等进行分析. 例4 室温下,使用0.1mol/L的NaOH溶液对100mL 0.1mol/L的NH4HSO4溶液进行滴定操作,测得溶液中PH和加入NaOH溶液体积的关系如图4所示,以下说法错误的是( ). 图4 A.cd段对应的离子方程式为: B.b点溶液中离子浓度的大小关系为: C.a、b、c、d4点中,b点溶液中水的电离程度最大 D.a点溶液中离子浓度关系为: 分析加入NaOH溶液的不同溶液中溶质的构成不同,对应的离子浓度也会发生变化,因此,解题时应结合图中pH大小以及加入NaOH溶液的体积,判断溶液中的溶质种类,并灵活应用电荷守恒知识进行分析.A项,当加入NaOH溶液为100mL时溶液中的溶质为Na2SO4和(NH4)2SO4,继续加入NaOH溶液,则发生的离子方程式为 正确;B项,b点pH为7,氢氧根和氢离子浓度相等.由电荷守恒得到: 因为NaOH溶液过量,因此 对应离子浓度的大小关系为 正确.综上选择C项. 高中化学相关习题会涉及各种各样的图像,考查学生迁移所学知识以及分析问题的灵活性.部分图像类的习题较为抽象,具有一定的技巧性.教学中为提高学生解答反应图像习题的能力,应做好合理的教学安排,明确每节课教学目标的任务,做好理论讲解以及相关习题的解题示范,鼓励学生做好听课总结,把握不同习题类型的分析思路.同时,鼓励学生相互交流学习心得,积极向他人学习,不断提升自己.

3 化学反应方向的分析


4 离子浓度大小的分析