化学图像中的分段计算问题例析
2022-02-24边永平
边永平
(河北省丰宁满族自治县第一中学 068350)
带有图像的化学计算题,采用数形结合的形式,在考查基本知识的同时,着重考查学生的观察、分析与计算推理等能力.现将常见考查内容举例分析如下,供参考.
1 受热分解问题(热重曲线)
例1 将0.80 g CuSO4·5H2O晶体加热,其受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图1所示,回答:
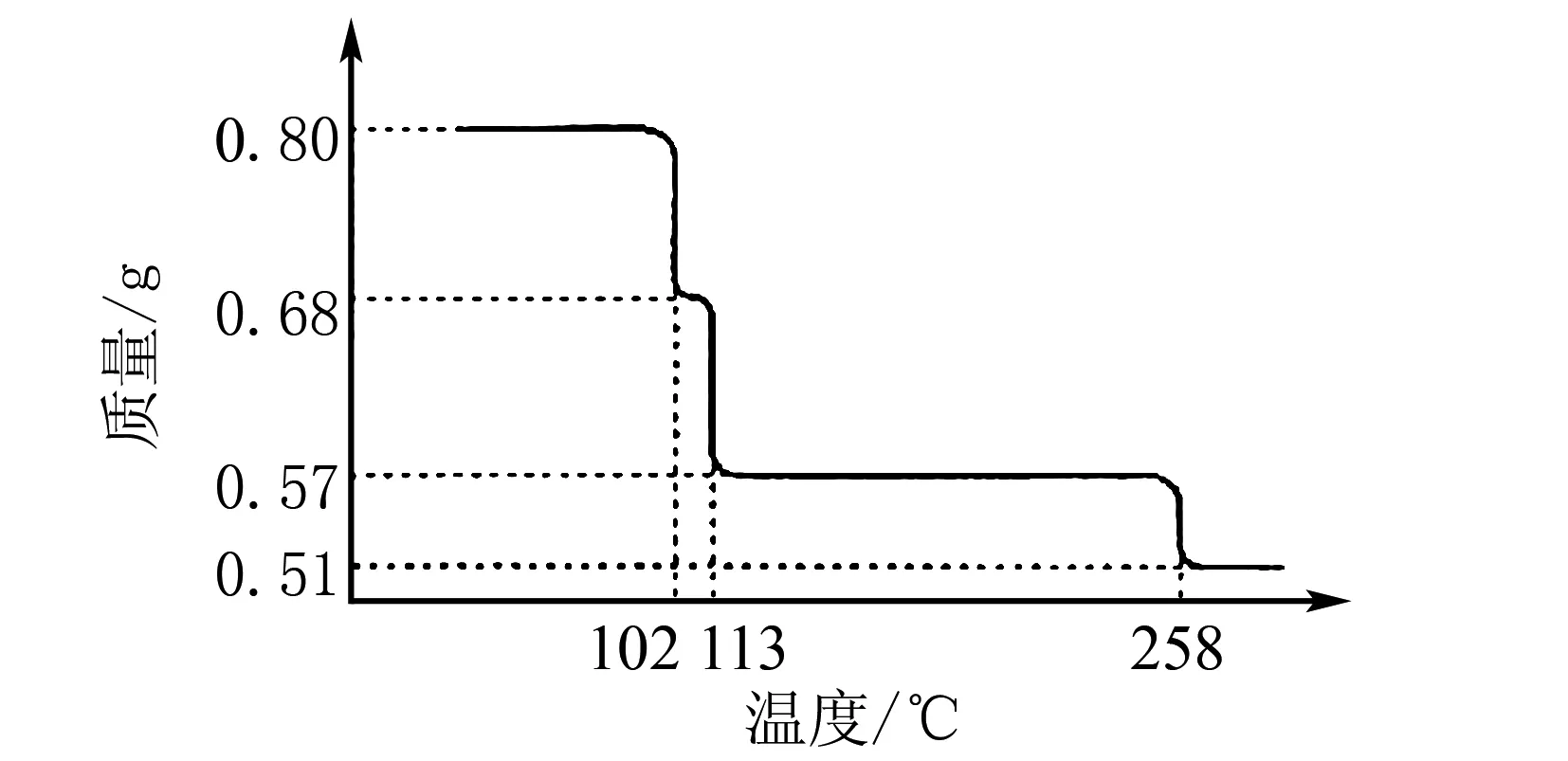
图1
(1)确定200℃时所得固体物质的化学式____(请写出推导过程).
(2)取270℃时所得的样品,于570℃灼烧,生成的主要产物为黑色粉末和一种氧化性气体,则此反应的化学方程式为____.向该黑色粉末中加入稀硫酸使之溶解,再经浓缩、冷却,析出晶体,则该晶体的化学式为____,其存在的最高温度是____.
解析(1)分析图像可知,CuSO4·5H2O受热到102℃时开始脱水分解,113℃时可得到较稳定的一种中间物,到258℃时才会继续分解.在200℃时失去的水的质量为
0.80g-0.57g=0.23g
根据反应的化学方程式:
250 18n
0.80g 0.23 g
求得n=4
即200℃时固体物质的化学式为CuSO4·H2O.
(2)用上述方法可求得258℃时失去所有结晶水,所得固体为CuSO4,即570℃灼烧时应该是CuSO4发生了分解,黑色粉末应该为CuO,氧化性气体则为SO3,该反应的化学方程式为:

把CuO溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为CuSO4·5H2O,其存在的最高温度为102℃.
评注热重分析类型的计算题,加热初期都是分阶段的失水,可以按失水反应式求解阶段产物.失去全部结晶水后再升温,即开始分解,可以结合题给信息分析推理所得产物,写出对应的化学方程式.
2 离子反应顺序问题
例2 将足量的CO2不断通入含有等物质的量的KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图2所示.回答问题:
(1)Oa段反应的化学方程式为____;
(2)bc段反应的离子方程式为____;
(3)ab段与cd段消耗的CO2的体积之比为____;
(4)c点与e点横坐标之比为____.

图2
解析本题主要考查离子反应的顺序问题,解题的关键是分析出图像中每一条线段对应的反应情况:



2Al(OH)3↓+ K2CO3



由于原溶液中KOH、Ba(OH)2、KAlO2物质的量相等,对比上述化学方程式可知:
ab段与cd段消耗的CO2的体积之比为1∶1;
c点与e点横坐标之比为4∶7.
评注混合液中通入CO2的反应,一般来讲是CO2先和碱反应(优先生成沉淀),再依酸性强弱,依次与弱酸盐反应.此类题型中常见的弱酸盐有硅酸钠、次氯酸钙、苯酚钠、偏铝酸钠等.
3 分段氧化问题


图3
A.0~a段:发生的离子反应为:
B.a~b段:参加反应的NaHSO3为1.8 mol
C.b~c段:I2既作氧化产物又作还原产物
D.当溶液里I-与I2二者物质的量之比为5∶1时,加入的KIO3为1.1 mol


0~b段无I2生成,即0~b点发生反应的离子方程式为:
则A项正确;a~b段横坐标为0.6mol,则a~b段参加反应的NaHSO3为1.8mol,则B项正确;b~c段发生反应为:
I2既是氧化产物又是还原产物,则C项正确;根据0~b段发生的反应方程式以及开始加入的NaHSO3的物质的量,可知0~b段加入的KIO3为1 mol,产生I-为1mol,假设后来又加入xmol KIO3,根据b-c段反应,可列出:
得到x=0.05,即当溶液中I-与I2的物质的量比值为5∶1时,加入的KIO3为1.05 mol,则D项错误,即答案为D.
评注分段氧化问题常涉及到的是有变价元素的还原剂和氧化剂反应时,根据加入氧化剂的量,以及氧化性、还原性的强弱关系写出反应式,根据方程式中存在的定量关系进行计算.
4 有关铁与硝酸反应的问题
例4 现有稀H2SO4和稀HNO3的混合溶液200 mL,分为等体积的两份.向第一份混合液中加入Cu粉,最多可溶解9.6 g.再向第二份混合液中加入Fe粉,产生气体的体积随加入Fe粉质量的变化趋势如图4所示(已知HNO3还原产物只有NO),下列分析或结果错误的是 ( ).

图4
A.原混合溶液中硝酸的物质的量为0.1 mol
B.OA段产生的气体是NO,AB段离子反应为

BC段产生的气体为H2
C.第二份溶液,最后所得溶质为硫酸亚铁
D.硫酸的物质的浓度是2.5 mol/L
解析根据HNO3和H2SO4的化学性质可知:各段相对应的反应式为:





BC段产生的气体为H2,最后所得溶液中的溶质全是FeSO4,则B、C均正确;在第二份溶液中:因最后得到的溶质都是FeSO4,根据硫原子守恒可得:
则硫酸的物质的浓度为:
0.25mol/0.1 L=2.5mol/L
则D项正确,即答案为A.
评注铁是高中化学重点讲到的变价金属,而硝酸是含有多种还原产物的氧化性酸,二者可以有多种反应形式.同时要注意Fe与Fe3+间的反应.
5 与Al3+和OH-反应有关的问题
例5 某实验小组对一含有Al3+的未知溶液进行了如下分析:
(1)滴入少量氢氧化钠,无明显变化;
(2)继续滴加NaOH溶液,有白色沉淀;
(3)滴入过量的氢氧化钠,白色沉淀明显减少.
实验小组经定量分析,得出如图5所示沉淀与滴入氢氧化钠体积的关系.下列说法错误的是( ).

图5
A.该未知溶液中至少含有3种阳离子
B.滴加的NaOH溶液的物质的量浓度为5 mol/L
C.若另一种离子为二价阳离子,则a=10
D.若将最终沉淀过滤、洗涤、灼烧,其质量一定为6 g
解析本题中开始加入NaOH溶液时无沉淀,说明含有H+;根据沉淀量的变化趋势可知,溶液中除了Al3+以外,还含有其它金属离子,则该未知溶液中至少含有3种阳离子,A项正确;根据曲线下降段可知:
n[Al(OH)3]=0.20 mol-0.15 mol=0.05mol
溶解Al(OH)3需要NaOH也为0.05mol,对应NaOH溶液体积为
110 mL-100 mL=10mL
则NaOH溶液的物质的量浓度为
0.05 mol/0.01 L=5mol/L
则B项正确;若另一种离子为二价阳离子,含量为0.15mol,沉淀时消耗NaOH 0.3mol,Al3+沉淀时消耗NaOH 0.15mol,则两种金属离子沉淀时共消耗NaOH 0.45mol,即90mL,则a=10,则C正确;由于另一种金属离子未知,故无法计算最终沉淀过滤、洗涤、灼烧后所得氧化物的质量,即D项错误,答案为D.
评注与Al3+和OH-反应相关的图像问题,一般从沉淀减少段入手突破,从而确定出Al3+的量,以及形成Al(OH)3沉淀阶段消耗的NaOH的量.
6 中和滴定问题
例6 常温下,用 0.1000 mol/L NaOH溶液滴定20.00mL、0.1000 mol/L CH3COOH溶液所得滴定曲线如图6所示.回答问题:

图6
(1)若点①的纵坐标为5,且点①所示溶液中:c(CH3COO-)=1.7c(CH3COOH),则醋酸的电离常数为____.
(2)若点③对应的纵坐标为8,计算CH3COO-的水解常数Kh____.
解析(1)点①所示溶液中,最初得到等物质的量的 CH3COOH和CH3COONa,此时溶液pH=5,说明CH3COOH的电离大于CH3COO-的水解,因此有
c(CH3COO-)>c(CH3COOH)
若c(CH3COO-)=1.7c(CH3COOH),根据醋酸的电离常数表达式
Ka=c(CH3COO-)·c(H+)/c(CH3COOH)
可求得Ka=1.7×10-5.
(2)点③所示溶液为恰好中和的状态,溶质全为CH3COONa,CH3COO-水解方程式为:

CH3COO-的水解常数
Kh=c(CH3COOH)·c(OH-)/c(CH3COO-)=Kw/Ka=5.9×10-10
评注有关滴定过程的计算,要搞清滴定过程中每一阶段所得溶液的组成成分,再结合电荷守恒、物料守恒、质子(H+)守恒以及电离常数进行相关计算.