化学法鉴别有机化合物*
2022-02-24荣一霖
刘 磊,荣一霖,赵 阳
(1 吉林大学化学学院公共化学教学与研究中心,吉林 长春 130012;2 吉林大学药学院,吉林 长春 130021)
在学习有机化学课程的过程中,常要求利用各类有机物的特征反应进行不同有机物的鉴别、分离或提纯。所谓鉴别,即针对不同有机化合物的性质,采用适当方法将有机化合物区别开来[1]。鉴别将选用现象明显的化学反应,例如可以产生溶解、沉淀、颜色变化或气泡冒出。但大多数初学者对相关知识的了解不够全面、系统和透彻,本文介绍常见有机化合物的特征反应,给出解析思路及鉴别举例,也能对考研学生给以有机化合物的鉴别指导。
1 烷烃的鉴别
烷烃分子中碳原子间皆以C-H、C-C单键相连,是最稳定的有机化合物。室温下,烷烃不与强酸、强碱、氧化剂或还原剂发生反应。
2 环烷烃
小环环丙烷常温与溴的四氯化碳溶液(Br2/CCl4)反应加成开环,使溴的红棕色溶液褪色。
3 烯烃和炔烃的鉴别
3.1 碳碳双键和碳碳叁键的鉴别
3.1.1 溴的四氯化碳试验
室温下,碳碳双键和碳碳叁键能与溴的四氯化碳溶液反应而使溴的红棕色溶液褪色,此反应常用来区分烷烃和烯烃,烷烃和炔烃[2]。在烯烃中滴入Br2/CCl4后,溶液迅速褪色生成1,2-二溴代烷,且无溴化氢气体生成。在炔烃中滴入Br2/CCl4后,先生成邻二溴代烯,进一步生成四溴代烷。但三环和四环的小环烷烃也能与溴试剂反应褪色。
3.1.2 高锰酸钾试验
碳碳双键和碳碳叁键都能被KMnO4氧化,KMnO4溶液的紫红色将褪色[3]。烷烃和环烷烃都不能被KMnO4氧化。但注意醇、醛、芳香烃或胺等也能被KMnO4氧化而褪色。
(1)酸性高锰酸钾溶液试验
在酸化的条件下,烯烃能被高锰酸钾彻底氧化为酮、羧酸、二氧化碳和水,炔烃能被高锰酸钾彻底氧化为羧酸、二氧化碳和水,紫色高锰酸钾褪色,还有棕黑色MnO2沉淀生成。
端烯或端炔的氧化产物有CO2气体放出。
(2)中性或稀碱性高锰酸钾溶液试验
在温和条件下,烯烃能被中性或稀碱性高锰酸钾氧化为顺-邻二醇,炔烃能被氧化为羧酸盐。紫色高锰酸钾溶液褪色,还有棕黑色MnO2沉淀生成。
3.2 共轭二烯烃的鉴别
共轭二烯烃与顺丁烯二酸酐可以发生Diels-Alder反应,生成白色沉淀[4]。
3.3 炔烃的其它鉴别方法
3.3.1 加水试验(催化剂HgSO4/H2SO4或HgCl2/HCl)
炔烃在酸性二价汞盐溶液中发生水合反应而生成醛或酮[5]。通过检验产物醛或酮可间接鉴别反应底物炔烃。乙炔被氧化为乙醛。端炔被氧化为甲基酮。其他炔烃被氧化为两个酮。
3.3.2 炔化物的生成
端炔与硝酸银氨或氯化亚铜氨的水溶液反应,迅速生成白色炔化银或砖红色炔化酮沉淀。
3.4 鉴别举例
举例1:鉴别环丙烷、环戊烷、环戊二烯、丙烯和丙炔。

表1 鉴别环丙烷、环戊烷、环戊二烯、丙烯和丙炔
4 芳香烃的鉴别
利用无α-氢的烷基苯不能被酸性KMnO4溶液氧化,含α-氢的烷基苯能被酸性KMnO4溶液氧化而使溶液褪色的特点,可区别二者。
举例2:鉴别叔丁基苯和异丙基苯。使用酸性KMnO4溶液,仅异丙基苯令KMnO4溶液紫色褪色。
5 卤代烃的鉴别
多数卤代烃与硝酸银的乙醇溶液(AgNO3/C2H5OH)反应生成硝酸酯和卤化银沉淀[6]。不同的卤化银沉淀的颜色不同:氯化银(白色)、溴化银(浅黄色)和碘化银(黄色)。故可根据沉淀颜色和其生成的快慢来鉴别卤代烃。
5.1 鉴别卤原子种类(卤代烃的结构相同)
不同卤代烃的反应活性次序是:RI>RBr>RCl。碳架结构相同时,碘代烷在室温下能与AgNO3/C2H5OH反应。而一级溴代烷、二级溴代烷、一级氯代烷和二级氯代烷需温热片刻才能反应[7]。
举例3:鉴别碘代乙烷、氯代丙烷和溴代异丙烷。第一步使用AgNO3/C2H5OH,碘代乙烷将产生黄色沉淀。另外两个物质分别与AgNO3/C2H5OH加热后,氯代丙烷产生白色沉淀,溴代异丙烷产生浅黄色沉淀。
5.2 鉴别卤代烃的结构(卤原子种类相同)
卤代烃的反应活性次序是:苄基、烯丙基型> 孤立型(三级>二级>一级)> 苯基、乙烯型。反应物的活性越低,反应发生所需要的条件就越苛刻,甚至不反应[7]。卤原子相同时,苄基、烯丙基型卤代烃在室温下就与AgNO3/C2H5OH反应。孤立型卤代烃在加热条件下反应。苯基、乙烯型卤代烃不能反应[7]。
举例4:鉴别苄基氯、烯丙基氯、1-苯基-2-氯乙烷、氯乙烯和氯苯。
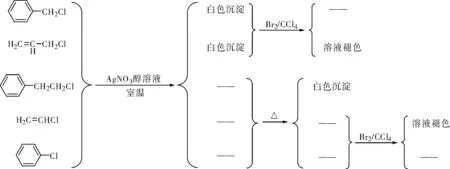
图1 鉴别苄基氯、烯丙基氯、1-苯基-2-氯乙烷、氯乙烯和氯苯
6 醇的鉴别
6.1 醇羟基的鉴别
6.1.1 与金属Na
醇是弱酸,可与Na缓慢放出氢气。适于3个C到8个C的醇的鉴别。但水、端炔、醛、酮、羧酸等活泼氢的化合物都能与Na反应。
6.1.2 酰化试验[2]
低级醇能和酰氯反应,根据反应过程中是否有酯类的水果香味逸出,可判断该化合物是否含有醇羟基。检验高级醇、酚类时则用苯甲酰氯。
6.1.3 硝酸铈铵试验[2]
十碳以下的醇能与硝酸铈铵反应,生成红色或橙红色的配合物,其颜色随碳链增长而变浅。此反应非常灵敏,根据反应中的颜色变化可以鉴别小分子醇类化合物。
6.2 不同级别醇的鉴别
6.2.1 卢卡斯(Lucas)试验
由浓盐酸和无水氯化锌配制的溶液称为卢卡斯(Lucas)试剂。氢卤酸的反应活性次序:HI>HBr>HCl。醇的反应活性次序:烯丙型或苄基型醇>叔醇>仲醇>伯醇。六个碳原子以下的各级醇均溶于该试剂,反应生成不溶于水的油状氯代烷,溶液呈浑浊后分层,可鉴别6个C以下的伯、仲或叔醇。叔醇立即浑浊分层,仲醇数分钟后浑浊分层,伯醇不出现浑浊,伯醇加热后出现浑浊。
6.2.2 Jones试剂和Sarrett试剂
Jones试剂是三氧化铬的稀硫酸水溶液。Sarrett试剂是CrO3吡啶配合物的CH2Cl2溶液。它们和醇反应的原理均为将橙色的Cr6+变成蓝绿色的Cr3+,产物为酮。
6.2.3 高锰酸钾和2,4-二硝基苯肼试验[8]
含α-氢的伯、仲醇被酸性高锰酸钾氧化成醛、酮后,再和2,4-二硝基苯肼反应生成黄色沉淀。叔醇与稀酸性高锰酸钾不反应,此反应可以将叔醇和大部分的伯、仲醇区分开来。
6.3 邻二醇的鉴别
6.3.1 与氢氧化铜的反应
顺-邻二醇与新鲜的氢氧化铜的反应,得到绛蓝色的溶液。
6.3.2 与高碘酸的反应
顺-邻二醇类化合物可被高碘酸(HIO4)氧化,生成醛、酮或羧酸类化合物。产物碘酸(HIO3)与硝酸银溶液生成白色沉淀(AgIO3)。
7 酚的鉴别
7.1 酚易氧化
空气中的氧就可以将苯酚慢慢氧化,白色晶体苯酚颜色逐渐变黑。苯酚与K2Cr2O7溶液氧化得到金黄色对苯醌。多元酚和苯环上有给电子基的酚类,更易氧化;苯环上有吸电子基的酚类难以氧化。
7.2 苯酚与NaOH
弱酸苯酚可以与NaOH中和,苯酚白色晶体溶解在NaOH水溶液中,得到C6H5ONa。继续向体系中通入CO2,苯酚析出。
7.3 溴水试验[8]
苯酚和极少量的溴水发生定量的亲电取代反应而使溴水褪色,迅速产生白色2,4,6-三溴苯酚沉淀。但苯胺也能被溴代,生成白色沉淀2,4,6-三溴苯胺。
7.4 三氯化铁试验[2]
三氯化铁能和多数酚发生显色反应,如与苯酚作用生成蓝紫色络合物。参与反应的酚的种类不同,产生的配合物的颜色也不同。
7.5 4-氨基安定吡啉试验[3]
碱性条件下,酚与4-氨基安定吡啉反应生成染料。此反应不仅可以鉴别酚,而且用于微量酚的定量分析,可以用于饮用水中酚的微量检测。苯酚和4-氨基安定吡啉反应生成红色染料。当某些种类的取代基处于酚羟基对位时会阻碍反应,对位无取代基的芳香胺也能发生此反应。
8 醚的鉴别[2]
9 醛酮的鉴别
9.1 醛、酮的一般检验[7](2,4-二硝基苯肼试验)
醛或酮能与氨衍生物反应,产物大多是有特殊颜色且有固定熔点的结晶。常用2,4-二硝基苯肼来鉴别羰基化合物,生成黄色、橙色或红色沉淀。
9.2 醛的检验
9.2.1 托伦(Tollens)试剂
托伦(Tollens)试剂是硝酸银的氨水溶液,也称为银镜反应。脂肪醛与托伦试剂反应快,芳醛慢,酮不反应。
9.2.2 斐林(Fehling)试剂
斐林(Fehling)试剂是由硫酸铜和酒石酸钾钠的氢氧化钠溶液混合而成的一种深蓝色的二价铜离子络合物溶液。与脂肪醛反应时,铜络离子被还原成为红色的氧化亚铜沉淀,正二价铜的蓝色消失。菲林试剂不和芳醛或酮反应。
9.2.3 本尼迪特(Benedict)试剂
本尼迪特(Benedict)试剂由硫酸铜和柠檬酸钠的碳酸钠溶液混合而成的一种深蓝色的二价铜离子络合物溶液。它和斐林试剂都可鉴别脂肪醛,反应现象也和斐林试验相似。芳醛、酮和甲醛也不与之反应。
9.2.4 西夫(Schiff)试剂
西夫试剂是通入SO2的品红无色水溶液。它和醛反应生成紫红色染料,脂肪醛反应快,芳香醛慢,酮不反应。甲醛和其他醛第二步加入硫酸后,甲醛的紫红色保持,其它醛的紫红色褪色。
9.3 甲基酮的鉴别
具有三个α-H的醛或酮(乙醛或甲基酮)在碱溶液中,与I2作用,生成有特殊气味的亮黄色固体三碘甲烷(碘仿)和羧酸盐。甲基仲醇、乙醇可以被NaIO分别氧化成甲基酮、乙醛后,也能发生碘仿反应。
9.4 区别某些醛与酮的举例
举例5:鉴别苯乙醛和苯乙酮。利用苯乙醛能和饱和NaHSO3溶液反应生成白色沉淀,而苯乙酮不能反应的原理。
举例6:鉴别2,4-己二酮和2,5-己二酮。前者互变为烯醇式结构能与FeCl3溶液反应生成紫红色络合物。
10 醌的鉴别
醌中的C=C令溴水、酸性高锰酸钾褪色,醌中的羰基令2,4-二硝基苯肼生成有色沉淀。
11 羧酸的鉴别
11.1 羧酸的酸性
羧酸具酸性,与Na2CO3或NaHCO3溶液反应生成CO2气体。
举例7:鉴别苯甲酸、苯甲醇和苯酚。第一步加入5%NaHCO3,苯甲酸冒泡生成CO2。另外两个物质分别加入5%NaOH,仅苯酚溶解。
11.2 低级羧酸和低级醇酯化
低级羧酸R1COOH和低级醇R2OH在酸性介质中,生成有水果香味的酯R1COOR2。
11.3 甲 酸
甲酸既具有羧基表现羧酸的一般通性,还具有醛基带来的还原性,能与Tollens试剂发生银镜反应,令高锰酸钾试剂褪色反应。
11.4 草 酸
草酸即乙二酸是二元羧酸,有还原性,能使高锰酸钾溶液褪色,但不与Tollens试剂反应。
12 羧酸衍生物
12.1 酰 卤
低级酰卤极易水解,在潮湿空气中产生白雾(HX吸收水份),在加入AgNO3溶液生成AgX沉淀。
12.2 酸 酐
酸酐易水解为羧酸,产物羧酸加入NaHCO3或Na2CO3产生CO2气泡。
12.3 酯
酯有香气,将酯溶解在乙醇中,加入几滴有酚酞的KOH溶液,加热酚酞粉红色消失。
12.4 酰 胺
酰胺与NaOH加热至沸腾,氨气溢出,湿的石蕊试纸可以检验氨气。
13 硝基化合物的鉴别[3]
13.1 锡-盐酸还原试验
碱性条件下,锡-盐酸可将硝基化合物还原为伯胺,通过伯胺的特征反应可检出有氨基化合物生成,从而间接鉴别硝基化合物。
13.2 锌粉试验
在乙酸介质中,硝基化合物被锌粉还原为能发生银镜反应的羟胺,通过加入托伦试剂检验羟胺的存在,从而间接鉴别硝基化合物。运用此法时应排除有醛基的化合物的干扰。
13.3 氢氧化亚铁试验
硝基化合物能将白色的Fe(OH)2氧化成棕色的Fe(OH)3。此反应颜色变化明显,但当羟胺类、亚硝基化合物、醌类等存在时会对此试验产生干扰。
14 胺的鉴别
14.1 兴斯堡(Hinsberg)试验
碱性条件下,一级胺、二级胺和苯磺酰氯的反应称为兴斯堡反应。苯磺酰伯胺的氮上的氢原子有弱酸性,故能溶于稀碱NaOH变成盐。苯磺酰仲胺呈中性,故不溶于稀碱NaOH。三级胺不发生反应。利用此反应可以区分一级、二级或三级胺。
14.2 亚硝酸试验
脂肪伯胺与HNO2反应有氮气生成。芳香伯胺在低温时与HNO2作用生成可溶的芳香重氮盐,但在室温下芳香重氮盐会变成酚,同时生成氮气。仲胺与HNO2反应生成中性的黄色油状物或固体。叔胺与HNO2反应生成不稳定、易溶的亚硝酸盐。
14.3 苯 胺
苯胺与溴水反应生成2,4,6-三溴苯胺白色沉淀。苯酚也可与溴水生成白色2,4,6-三溴苯酚沉淀。
14.4 鉴别举例
举例8:鉴别苯胺、苯酚、苯甲酸和甲苯。
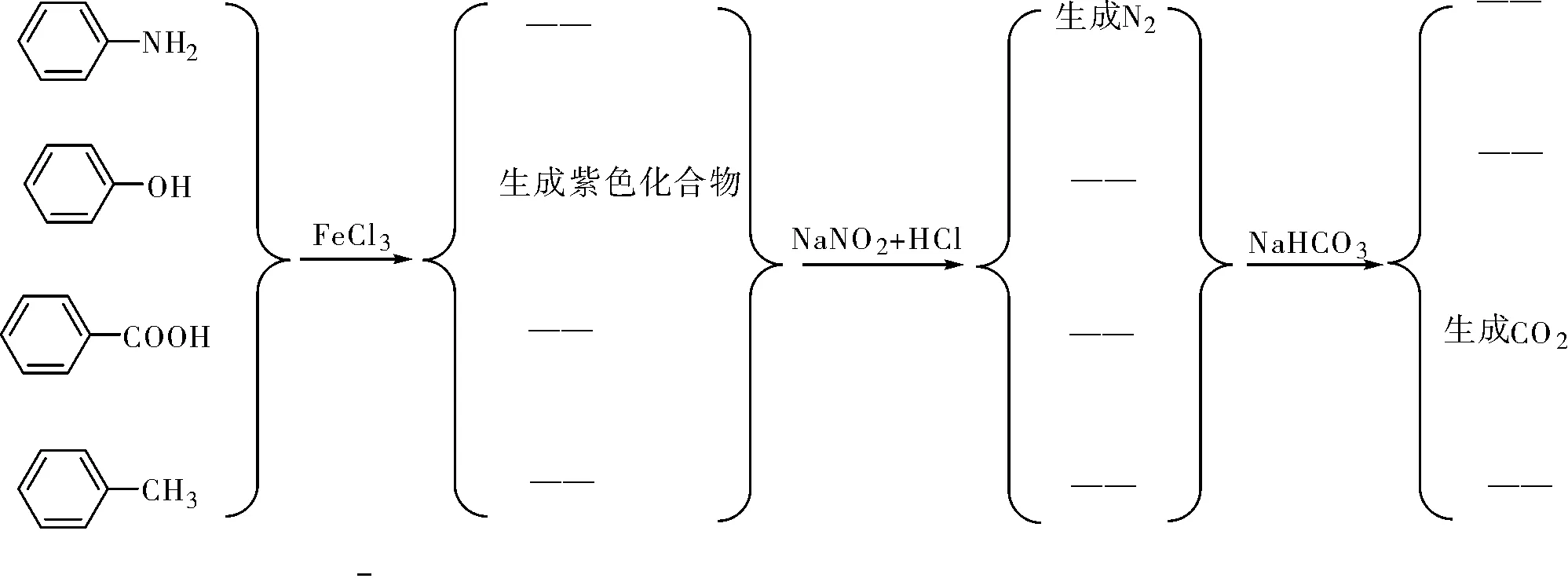
图2 鉴别苯胺、苯酚、苯甲酸和甲苯
举例9:鉴别苯胺、苯酚、环己醇、环己胺和环己酮。
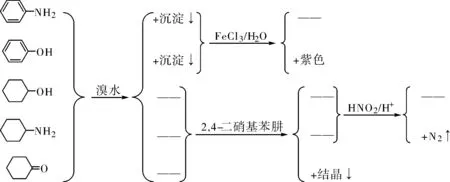
图3 鉴别苯胺、苯酚、环己醇、环己胺和环己酮
举例10:鉴别苯胺、N-甲基苯胺、N,N-二甲基苯胺和苯甲酰胺。

图4 鉴别苯胺、N-甲基苯胺、N,N-二甲基苯胺和苯甲酰胺
15 杂环化合物

表2 常见杂环化合物的鉴别
16 单糖的鉴别
16.1 成脎反应[3]
醛糖和酮糖中的羰基都可与3 mol苯肼经三步反应生成糖脎。糖脎为黄色结晶,不同糖的脎结晶形状、熔点和生成的时间不同,可用于鉴别单糖。
举例11:D-葡萄糖或D-果糖的成脎反应。利用二者成脎的反应的时间与晶型的不同。
16.2 溴水(pH=6.0)鉴别醛糖与酮糖
利用醛糖可以被溴水氧化而使溶液褪色,酮糖不能被溴水氧化的特点,可以区分酮糖和醛糖。葡萄糖能使溴水褪色,而果糖不能。
举例12:鉴别D-葡萄糖和D-果糖。葡萄糖能使溴水褪色,而果糖不能。
16.3 鉴别单糖和二糖
举例13:鉴别D-葡萄糖、D-果糖和蔗糖。先使用Tollens试剂,D-葡萄糖、D-果糖都发生银镜反应。D-葡萄糖、D-果糖再分别加入溴水,仅D-葡萄糖令溴水褪色。
17 α-氨基酸的鉴别
17.1 等电点和旋光度
各种氨基酸由于其组成和结构不同而具有不同的等电点pI值。除甘氨酸外,其它氨基酸的α-碳原子均为手性碳原子,因此氨基酸具有旋光性,不同氨基酸有不同的比旋光度。
17.2 与亚硝酸的反应
α-氨基酸中的氨基与脂肪族伯胺的氨基相似,与亚硝酸反应放出N2生成α-羟基酸。
17.3 与水合茚三酮
α-氨基酸与水合茚三酮反应,生成紫色化合物。
17.4 α-羧基与α-氨基与金属盐配合
α-氨基酸的羧基与氨基与某些金属盐如二价铜配合,形成蓝色的晶体络合物。
17.5 多肽链的N末端氨基酸鉴定
α-氨基酸的氨基与丹磺酰氯生成有荧光的酰胺衍生物。
17.6 鉴别举例
举例14:鉴别α-氨基丁二酸和丙二酸。加入硝酸,α-氨基丁二酸冒泡,放出氮气。
举例15:鉴别3-苯基-α-氨基-丙酸与3-苯基-α-乙酰氨基丙酸。加入稀盐酸,3-苯基-α-氨基-丙酸溶解。
举例16:鉴别3-羟基-α-氨基丙酸和3-羟基-α-氨基丁酸。加入NaOH和I2,3-羟基-α-氨基丁酸产生亮黄色的碘仿沉淀。
18 结 论
本文总结了烷烃、环烷烃、烯烃、炔烃、芳香烃、卤代烃、醇、酚、醚、醛、酮、醌、羧酸、羧酸衍生物(酰卤、酸酐、酯和酰胺)、硝基化合物、胺、杂环化合物、单糖和α-氨基酸共22类有机化合物的鉴别方法,给出了16个鉴别举例。旨在让初学者通过这些典型例题掌握分析问题方法和解决问题的思路,从而在学习、应试或考研过程中运用好所学的有机化学知识解决问题。
