钛表面高强度仿生形貌涂层构建及生物安全性评估
2022-02-24牛强王潇懿张周阳宁小娜郭维维张羽博翰吕前欣王乐刘富伟张浚睿
牛强 王潇懿 张周阳 宁小娜 郭维维 张羽博翰 吕前欣 王乐 刘富伟 张浚睿
骨结合效果是牙种植体远期成功率的重要决定因素[1]。天然骨组织是由纳米级尺度的胶原纤维、矿物盐结晶等逐步组装成微米级尺度的骨小梁、哈佛式系统,进而形成宏观尺度的松质骨、皮质骨[2]。因此,仅从仿生学的角度,在种植体表面构建具有微米级、纳米级的梯度仿生形貌,将有助于促进骨结合效果。
基于上述理念,多种表面形貌改性技术已应运而生,如喷砂、阳极氧化、等离子沉积、水热处理、激光蚀刻等,可构建出纳米管、突、刺、沟槽等多种形貌。研究报道,表面形貌改性可提升钛及钛合金表面亲水性,减低骨组织剪切力,并有利于细胞粘附、成骨分化以促进骨结合效果[3]。然而,临床上牙种植体在植入与长期应用过程中,材料与周围骨组织间界面将产生较大应力,易造成材料破坏、涂层脱落。而脱落的材料颗粒将可能通过激活巨噬细胞炎症小体等机制引发界面慢性炎症,不利于新骨形成,并造成种植体溶骨性松动。这种由涂层强度不足造成的生物安全性问题成为制约表面改性技术临床应用的关键[4]。
本研究将通过联用酸蚀、磁控溅射技术,旨在构建一种兼顾涂层强度与生物安全性双重要求的,微米级、纳米级梯度仿生形貌涂层,以满足临床应用。
1 材料与方法
1.1 涂层构建及形态观察
钛片(Ø 15 mm×1 mm, 西安中邦生物钛科技有限公司);钛酸锶靶材(Ø 75 mm×10 mm,北京汇方圆科技有限公司);丙酮、 无水乙醇(天津富宇化学试剂有限公司); 去离子水、氢氟酸(HF,天津致远化学试剂有限公司)。砂纸打磨,直至钛片表面光如镜面,得到光滑组钛片。在此基础上,将制备好的光滑钛片浸泡于2.5%浓度氢氟酸中3 min,对表面进行酸蚀,得到微米级形貌。随后以钛酸锶为靶材通过磁控溅射技术(功率80 W,溅射时间7 200 s,基靶间距10 cm,室温)在微米级形貌表面进一步构建纳米粒形貌,形成微米级、纳米级梯度仿生形貌。最后通过场发扫描电镜(FE-SEM, S-4800,日立公司, 日本)对该表面进行形貌观察。
1.2 涂层强度检测
采用纳米划痕试验对该新型涂层强度进行检测。对照组选择经典形貌纳米管,制备方法如下:微米级形貌制备如前,随后在0.5% HF电解液中阳极氧化处理30 min(电压20 V,金属铂作为阴极);处理完毕后,依次经丙酮、无水乙醇、蒸馏水超声振荡清洗,烘干塑封,钴-60照射消毒。
纳米划痕试验:将钛片置于划痕仪上,通过声发射法检测压头在不断加力过程中涂层划破或剥落时的临界载荷,由此得到涂层与基体的临界载荷,于扫描电镜下观察记录。
1.3 实验动物
8周龄雄性SD大鼠, 体重260~300 g(空军军医大学动物实验中心)。
1.4 涂层生物安全性检测
1.4.1 皮肤刺激与迟发性超敏试验 浸提液的制备:根据国家标准(GB/T 16886.12-2017)中浸提液体积计算公式,以每个钛片对应1.178 mL PBS, 在(37±1) ℃, (24±2) h条件下完成浸提液制备。
皮肤刺激试验:SD大鼠10 只,分笼饲养,分为光滑钛片组(对照组,n=5)和新型涂层组(实验组,n=5),在同等条件下自由饮食,适应性饲养1 周。
根据国家标准(GB/T 16886.10-2017),大鼠背部备皮消毒后,在相应皮肤部位放置2.5 cm×2.5 cm大小的贴敷片,将0.5 mL光滑钛片或新型涂层浸提液滴到观察部位贴敷片中,对照部位滴浸提溶剂(PBS)。用绷带固定4 h后墨水标记,除去敷贴片后1、 24、 48、 72 h记录接触部位情况。
迟发型超敏反应:SD大鼠10 只,分为光滑钛片组(对照组,n=5)和新型涂层组(实验组,n=5),同等条件自由饮食,适应性饲养1 周。
诱导阶段:将2.5 cm×2.5 cm大小的敷贴片浸透新型涂层浸提液,局部贴敷于动物左上背部位,绷带包扎, 6 h后除去包扎带和敷贴片。 1 周中连续3 d重复该步骤,同法操作3 周。贴敷光滑钛片浸提液组大鼠作为对照。
激发阶段:最后一次诱导贴敷后14 d(±1 d),分别用光滑钛片或新型涂层发浸提液对对照动物和试验动物进行激发,将2.5 cm×2.5 cm大小的敷贴片浸透浸提液,贴敷于每只动物去毛的未试部位(诱导阶段未贴敷部位),包扎固定。6 h后除去固定器、包扎带和贴敷片。激发24 h后,用温水彻底清洗脱毛区,毛巾擦干后放回笼中,2 h后观察动物试验部位皮肤有无红斑及水肿等,再过24 h(即激发后48 h),再观察一次并记录。
1.4.2 全身毒性试验 根据国家标准(GB/T 16886.11-2011),SD雄性大鼠15 只,分笼饲养,分为正常健康组(空白组,n=5),光滑钛片组(对照组,n=5)和新型涂层组(实验组,n=5),在同等条件下自由饮食,适应性饲养1 周。
从笼内将大鼠取出,根据体表标记识别动物编号。用16#灌胃注射器抽取相应组别浸提液3 mL,排空注射器内的空气,将灌胃针头由大鼠左侧口角,顺着上颚后壁插入咽部,沿着平行于动物的纵轴,把灌胃针头插入胃部,稳定推动针芯,慢慢注入受试物。大鼠给药后前3 d每天测量体重并记录;给药2 周后取材,取大鼠心、肝、脾、肺、肾组织固定包埋成蜡块,行切片及HE染色,观察评价各组织脏器病理表现。
1.4.3 溶血试验 根据国家标准(GB/T 16886.4-2016),采用正常大鼠外周血溶血实验评价种植体血液相容性。首先取5 mL大鼠外周血1 500 r/min离心15 min,取下层红细胞,用生理盐水离心洗涤红细胞3 次,随后,用 PBS 溶液将红细胞稀释10 倍。然后,取 0.3 mL 稀释后的红细胞悬浮液,分别加入 1.2 mL 的 PBS(-)和 1.2 mL 的0.1% Triton X-100(破膜液,溶血率≈100%)作为阴性对照和阳性对照。另外取光滑钛片浸提液和新型涂层浸提液1.2 mL,分别加入0.3 mL稀释后的红细胞。2 h 后,1 500 r/min离心15 min,取上清液,通过 UV-vis 分光光度计测试上层清液的吸光值。使用下面的公式计算红细胞的溶血百分率:溶血率(100%)=[(样本吸光值-阴性对照吸光值)/(阳性对照吸光值-阴性对照吸光值)]×100%。
1.4.4 血清生化参数分析 选取空白组及实验组大鼠各10 只,通过眼球取血法取1 mL外周血6 000 r/min离心5 min,吸出上层血清,于西京医院检验科检测血清ALT、AST、CK-MB及BUN水平,通过SPSS 20.0软件统计分析。
2 结 果
2.1 高强度仿生形貌涂层构建
扫描电镜结果显示,通过联用酸蚀、磁控溅射技术,可在光滑纯钛基底表面(图 1)制备具有微米级、纳米级梯度结构的仿生形貌(图 1)。其中, 1 000 倍下可见沟壑样微米结构; 30 000 倍下可见以圆顿的凸起为主纳米结构,均匀分布。

图 1 高强度仿生形貌涂层构建及观察
2.2 涂层强度检测
纳米划痕试验显示,钛表面经典形貌纳米管,在0~100 N逐渐加力的过程中(从左至右),在28 N附近发生明显的涂层断裂、剥落现象(图 2)。而新型高强度仿生形貌涂层在0~100 N逐渐加力的过程中,其形成划痕较纳米管组浅,表明该新型涂层表面硬度高,且仅在接近100 N处出现少量的涂层断裂、剥落现象,表明该新型涂层与基底结合强度好,可以满足临床应用需要(图 2)。

图 2 新型高强度仿生形貌涂层与经典形貌纳米管的涂层强度对比
2.3 生物安全性检测
在大鼠背部所示相应部位(图 3A),贴敷光滑钛片(对照组)或新型涂层(实验组)浸提液14 d后,大体观察可见,大鼠未出现皮肤刺激症状(图 3B);同时与对照组大鼠相比,实验组未出现迟发性超敏反应(图 3C);进行灌胃后,新型涂层浸提液组大鼠体重变化情况与光滑钛片浸提液组无显著差异(423.3±11.2 gvs. (429±10.07) g,P>0.05, 图 3D);通过HE染色检测新型涂层浸提液对大鼠全身重要脏器的影响,结果显示,实验组大鼠与健康对照大鼠无明显差异,具体表现为:心肌排列整齐,无坏死及炎性细胞浸润等;肝小叶结构清晰完整,肝索排列整齐,肝细胞均匀致密,形态正常且无坏死,无明显炎性细胞浸润现象;脾脏组织结构正常,红、白髓分界清晰,脾小结较多,大小较为一致;肺脏组织完整,无水肿、出血、透明膜形成及上皮细胞损伤等;肾小球体积正常,系膜细胞和上皮细胞无坏死、水肿,无透明管型等;表明该新型涂层浸提液不会对心、肝、脾、肺、肾这些重要脏器产生毒性作用(图 3F),溶血试验是植入材料必须检测的指标,发现实验组溶血率(3.51%±1.04%)与正常组(2.90%±0.65%)间无统计学差异(P>0.05)(图 3E)。血清生化分析结果显示,实验组大鼠较正常组大鼠ALT〔(45.00±2.74) U/Lvs.(48.89±19.14) U/L〕、 AST〔(92.50±4.98) U/Lvs.(104.11±31.52) U/L〕、 BUN〔(7.74±0.45) mmol/Lvs.(6.00±0.60) mmol/L〕及CK-MB〔(408.80±42.17) U/Lvs.(516.44±33.24) U/L〕水平均无统计学差异(表 1)。
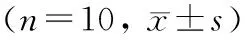
表 1 血清生化检测
3 讨 论
自骨结合理论提出开始,基于钛及钛合金等生物材料的替代重建技术已被广泛应用于口腔缺牙种植修复、赝复体固定、骨缺损修复等多种领域[5]。仅以口腔种植为例,我国种植牙已超过200 万颗,成为全球种植牙增速最快的市场[6]。骨结合效果是牙种植体长期行使功能的重要决定因素,如何又快、又好的实现骨结合是生物植入材料领域关心的重要问题。
天然骨组织在微观上具有微米级、纳米级的梯度结构,基于仿生学理念,在种植体表面构建出近似天然骨组织微观梯度形貌将有助于骨结合效果[7-8]。其中,微米级形貌在尺度上与天然骨组织中骨小梁、哈佛式系统等相近,可以有效增加种植体与骨组织的接触面积,使二者形成机械嵌合,并降低界面处骨组织在咀嚼运动时受到的剪切力,从而促进种植体稳定[9-11]。同时,微米级形貌也可改善植入材料亲水性,吸引蛋白粘附以促进骨结合。纳米级形貌在尺度上与天然骨组织中胶原纤维、矿物盐颗粒等细胞外基质成分相近[12]。研究显示,纳米级形貌在对细胞影响上较微米级形貌更直接,可显著促进成骨细胞、骨髓间充质干细胞等成骨相关细胞的粘附,并通过整合素介导的细胞骨架力学传递通路,或黏着癍激酶相关通路促进细胞增殖及分化[13-16]。同时,随着骨免疫学的发展,纳米级形貌对巨噬细胞等免疫细胞及相关炎症反应的调控作用也越来越受到人们重视。由此研究者开发了多种技术以制备上述形貌。
现阶段,能够在以钛及钛合金为代表的金属植入材料表面构建微米级形貌的主要方法有喷砂、酸蚀等,这也是目前临床种植体主要的形貌制备方法[17]。而在纳米级形貌构建上,阳极氧化、等离子沉积、水热处理等是常用方法,可以构建出纳米管、突、刺等多种形貌,具有良好的促成骨效果。然而临床上牙种植体在植入与长期应用过程中,材料与周围骨组织间界面将产生较大应力,上述工艺方法制备涂层的强度难以满足该要求,涂层易破坏、脱落。巨噬细胞在吞噬这些脱落的涂层颗粒时将大量释放促炎因子,造成界面过度炎症反应,不利于新骨形成,甚至破坏周围骨质。同时多转为慢性炎症,造成溶骨性松动,是种植体远期失败的重要因素[18-19]。近年来,激光蚀刻等新型技术被引入金属材料形貌构建上,具有强度高、可控性强、精细度高等优势,但此类技术制备成本高昂,不利于产业化推广[20]。
为解决上述问题,本研究通过联用酸蚀、磁控溅射技术,在钛表面构建了一种兼顾涂层强度与生物安全性双重要求的,具有微米级、纳米级梯度仿生形貌的新型涂层。形成的纳米结构主要为圆顿的凸起,均一、稳定、可控性高。与经典的纳米形貌,纳米管相比,新型涂层具有显著的表面硬度及界面结合强度优势,能够满足临床应用需求。同时,基于国家标准,对该新型涂层的生物安全性进行系统检测,证实其在体生物安全性高,与纯钛无统计学差异,有望快速转化。此外,该涂层由于选择了钛酸锶作为磁控溅射靶材,其表面中也添加入了锶元素,鉴于雷尼酸锶等锶盐类药物在骨质疏松等疾病中的积极治疗作用,该新型涂层也势必具有一定的药物促成骨效果。
综上所述,本研究构建了一种微米级、纳米级梯度仿生形貌的新型涂层,该涂层具有高强度、高生物安全性的特点,具有良好的临床转化应用前景。
