脱矿牙本质基质和丝素蛋白复合生物膜的初步构建
2022-02-24杨兴华韩晓艳李俊福刘敏
杨兴华 韩晓艳 李俊福 刘敏
家蚕丝素蛋白(silk fibroin protein, SF)因具有致孔性、可吸收性、良好生物相容性,而应用于骨组织工程支架的研究[1]。但SF缺乏细胞活性因子、低抗压性,难以满足临床需要。牙本质硬度高,脱矿后暴露的牙本质基质(demineralized dentin matrix, DDM)含有大量对细胞调控的活性因子[2-3]。聚乙二醇(polyethylene glycol, PEG)无免疫原性、毒性、保护药物活性,可用作载体和交联剂[4-5]。本研究尝试以PEG为交联剂结合SF、DDM材料优点,构建具有多孔、生物活性和抗压的可吸收骨替代材料,以期应用于临床牙槽骨、颌骨骨量不足的治疗。
1 材料与方法
1.1 主要材料与仪器
CCK-8试剂盒(CCK-8 kit, 广州奕源生物科技); 傅立叶红外光谱仪(Tensor II 布鲁克, 德国); 扫描电镜(JSM 6610LV JEOL, 日本); BCA试剂盒 (北京PC0020 Solarbio); ALP一抗(ab108337)、BMP-2一抗(ab14933)、RUNX2抗 (ab23981 )、I型胶原一抗(ab21286 )﹑OCN一抗 (ab13420)(abcam, 英国);SD 大鼠(山东大学试验动物中心),动物试验经山东第一医科大学伦理委员会批准。
1.2 方法
1.2.1 SF溶液的制备 蚕丝洗净、干燥后0.02 mol/L碳酸钠溶液中脱胶、凉干,得到丝素;丝素在LiBr(摩尔浓度9.3 M)溶液中溶解、透析得到SF溶液;SF经稀释或者浓缩得到工作浓度。
1.2.2 DDM颗粒的制作 正畸拔除的健康年轻恒牙,经拔髓、脱钙、脱脂、清洗、晾干、冷冻后制成粒径为100~500 μm的颗粒, -20 ℃保存备用。
1.2.3 SF及SF-DDM膜的制备 6% SF溶液-20 ℃预冷12 h, -60 ℃真空冷冻干燥, 80%冷乙醇浸泡,去离子水冲洗、冻干,得到SF膜。SF膜粉碎为100~500 μm的颗粒湿润后与DDM以体积比9∶1(10%)、 7∶3(30%)、 5∶5(50%)混合加入试件模具,滴加含1% PEG6000的6% SF溶液至液平,经预冷冻、冷干、异构、冲洗、干燥得到DDM-SF生物膜。
DDM-SF生物膜性能测定:支架孔径采用电竞下根据标尺测量10 个不同位点的孔径取均值。孔隙率的测量:室温下制作的材料浸入正己烷5 min,浸入前体积V1,浸入后体积V2和材料取出后体积V3,采用公式致孔率&%=(V1-V3)/(V2-V3)得出。压缩强度测定:万用电子力学测试机测得的材料力学数值取均数(n=3)。
1.2.4 红外光谱仪测定 将生物膜各成份加工成粉末,KBr 压片制样,傅立叶红外光谱仪测试, 4500~400 cm-1吸光度扫描,得到红外吸收光谱。
1.2.5 X-Ray Diffraction(XRD)检测生物材料的空间结构 样品表面研磨抛光,制样、X射线衍射仪上架、设置参数、测试、检索。
1.2.6 大鼠骨髓基质干细胞(rat bone marrow stem cells rBMSCs)的体外培养、鉴定 2 周龄大鼠截取股骨冲洗髓腔、全血贴壁培养。贴壁第二代细胞经CD11b、CD29、CD44、CD45、CD90流式细胞仪检测;细胞以5×105个/mL铺板进行成脂、成骨、成神经元样细胞分化诱导。
1.2.7 CCK-8对生物膜表面干细胞活性检测 无菌条件下生物膜剪成小片覆盖96 孔板底部, SF为对照组、含DDM膜为试验组, 5×105个/mL rBMSCs接种于膜,进行1~7 d的CCK-8检测。检测时取酶标仪450 nm处培养基的吸光光度值(A值)。
1.2.8 生物膜对干细胞分化检测 1×106个/mL rBMSC接种DDM-SF膜上。SF为对照组和含DDM为试验组。1、 3、 5 周时,采用研磨法提取细胞的蛋白,进行ALP、RUNX2、COL-1、BMP-2的蛋白印染检测(Western blot)、扫描电镜(SEM)检测1 周时生物膜上的细胞。
1.2.9 大鼠颅骨极限缺失模型的建立和修复 SD雄性成年大鼠麻醉后,颅骨制备直径5 mm极限骨缺损区。含1×106个 /mL细胞的30% DDM-SF膜(试验组)、SF膜(对照组)分别放置入5 mm颅骨缺损中,术后2、 4、 12、 24 周取出膜,进行HE染色和RUNX2、COL-1、 OCN组化免疫染色检测。
2 结 果
2.1 制备的DDM-SF膜特性
生物膜呈白色、多孔、有弹性,孔径(图 1)随DDM比例的增加而逐渐缩小,比较各组间孔径(Newman-Keuls多重比较测试,P<0.05)有差异。生物支架压缩强度(图 1),生物支架压缩强度随牙本质比例的增加逐渐增大,各组间压缩强度(单因素方差分析P<0.000 1,P<0.05 )有差异。30% DDM-SF孔隙率82.99%±0.3433%。DDM-SF生物膜与SF膜的孔径、压缩强度对比如下(图 1)
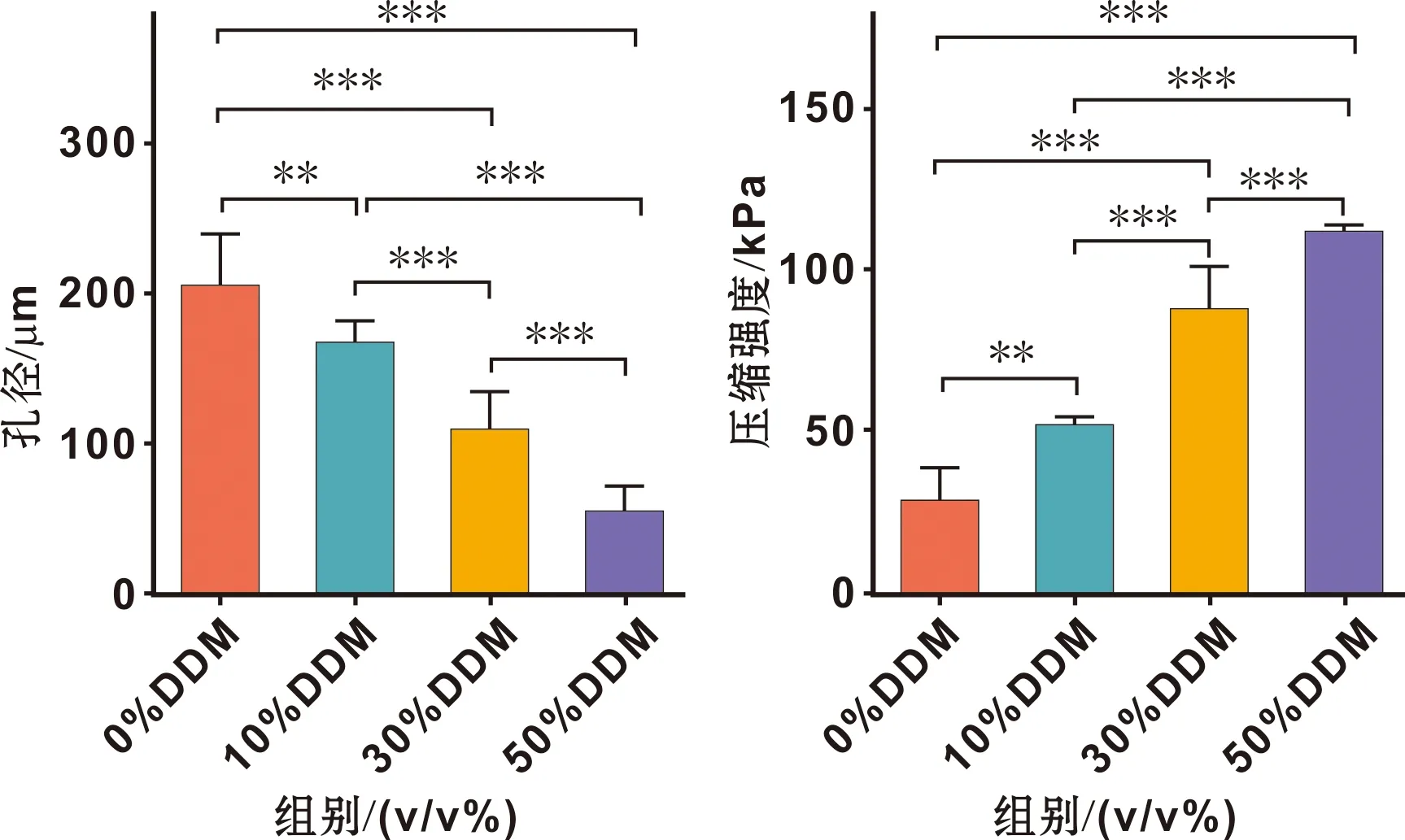
图 1 DDM-SF膜的孔径和压缩强度
2.2 DDM-SF生物膜傅立叶红外光谱检测
测得的SF(图 2A)特征吸收峰出现在3 500 cm-1的酰胺基;牙本质的吸收特征波长(图 2B)为1 033 cm-1处磷酸根、 1 385 cm-1处碳酸根、 3 442.20 cm-1、 1 631.92 cm-1氮氢键。PEG特征吸收峰(图 2C)体现在2 886 cm-1为O-H键。在DDM-SF生物支架(图 2D)中SF 1 631 cm-1和3 442 cm-1处谱峰为酰胺键中-CN伸缩振动和-NH面内变形振动,PEG在峰值2 886 cm-1C=O键伸缩振动,-CO-NH形成。红外光谱图如下(图 2)。

图 2 DDM-SF膜傅里叶红外光谱图
2.3 XRD检测数据分析
经软件Jade5.0分析:DDM-SF材料的结晶度好,存在无机盐衍射峰,材料具有三维有序结构。
2.4 rBMSCs的细胞培养、鉴定
培养骨髓干细胞呈多角形、短梭形。第二代干细胞经流式细胞仪检测:CD29、CD44、CD90呈阳性,CD11b、CD45呈阴性。诱导后的rBMSC茜素红染色
为阳性、油红O染色呈粟状红色、NSE免疫荧光染色呈阳性。
2.5 在DDM-SF膜上rBMSC的cck-8检测结果
DDM-SF膜、SF膜在1~7 d的时间内培养基A值(图 3 )1~3 d均缓慢下降, 4 d之后DDM-SF膜A值提升快于SF膜。对照组与试验组 A way ANOVA 检验, 具有差异显著性(P<0.05)。30% DDM-SF对细胞生长促进效果最佳。酶标仪 450 nm(n=6)处测CCK-8培养基吸光度A值如下:
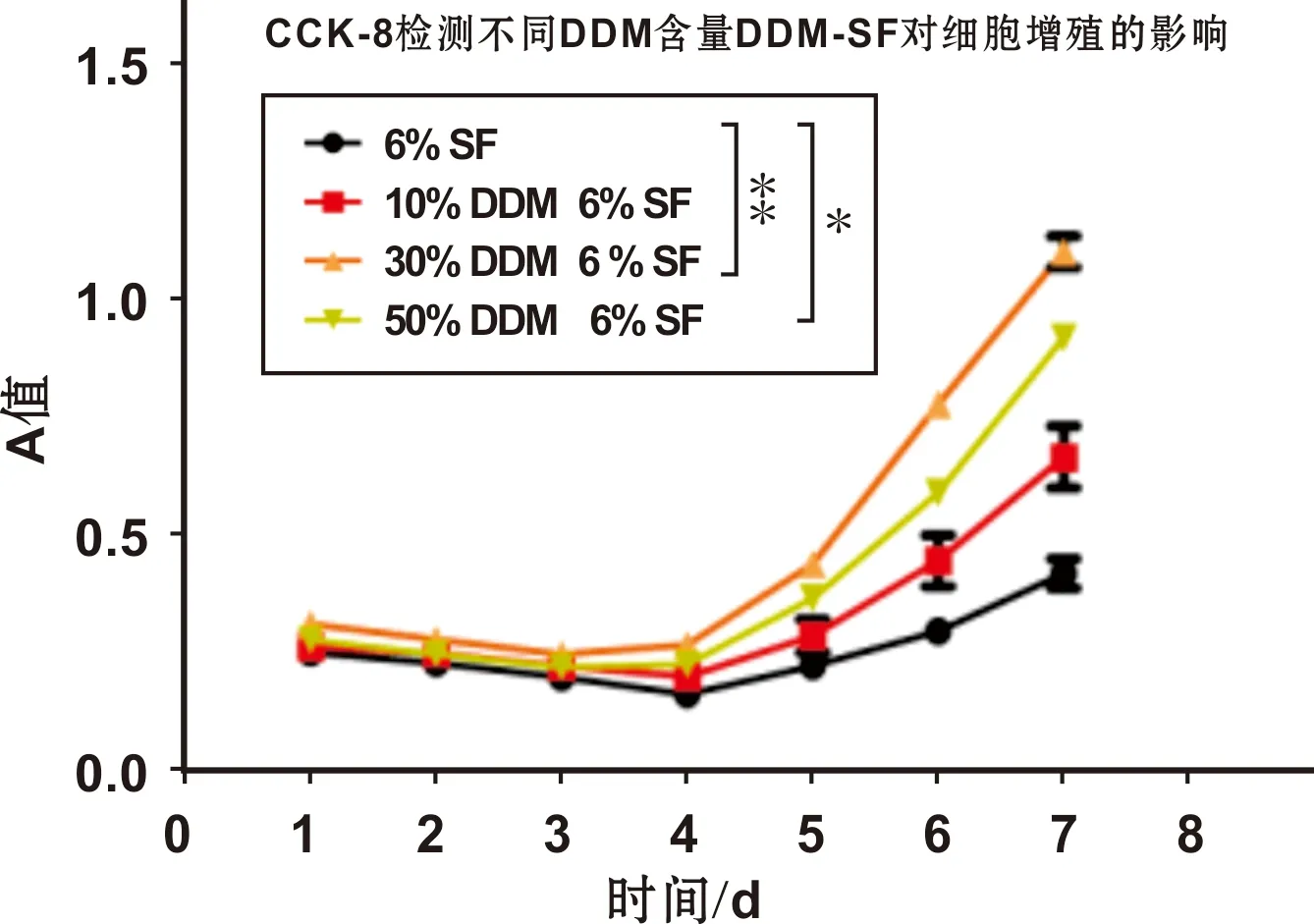
图 3 BMSCs的增殖曲线(CCK-8实验)
2.6 SEM对DDM-SF结构及rBMSC的观测
DDM与SF结合紧密,生物膜呈多孔状(图 4A),DDM散在分布。随着DDM比例的增加,支架孔隙率在减少。rBMSC在生物膜表面3 d时贴壁欠佳, 1 周时与DDM-SF贴壁,细胞舒展(图 4B)。

图 4 DDM-SF结构与贴壁细胞(SEM)
2.7 接种rBMSC的DDM-SF不同时间段提取蛋白Westernblot检测结果
RUNX2表达较晚且随时间逐渐增强。ALP、Col-1有较早表达,ALP在第三周时表达最为充分,30% DDM-SF对成骨分化促进最佳(图 5)。
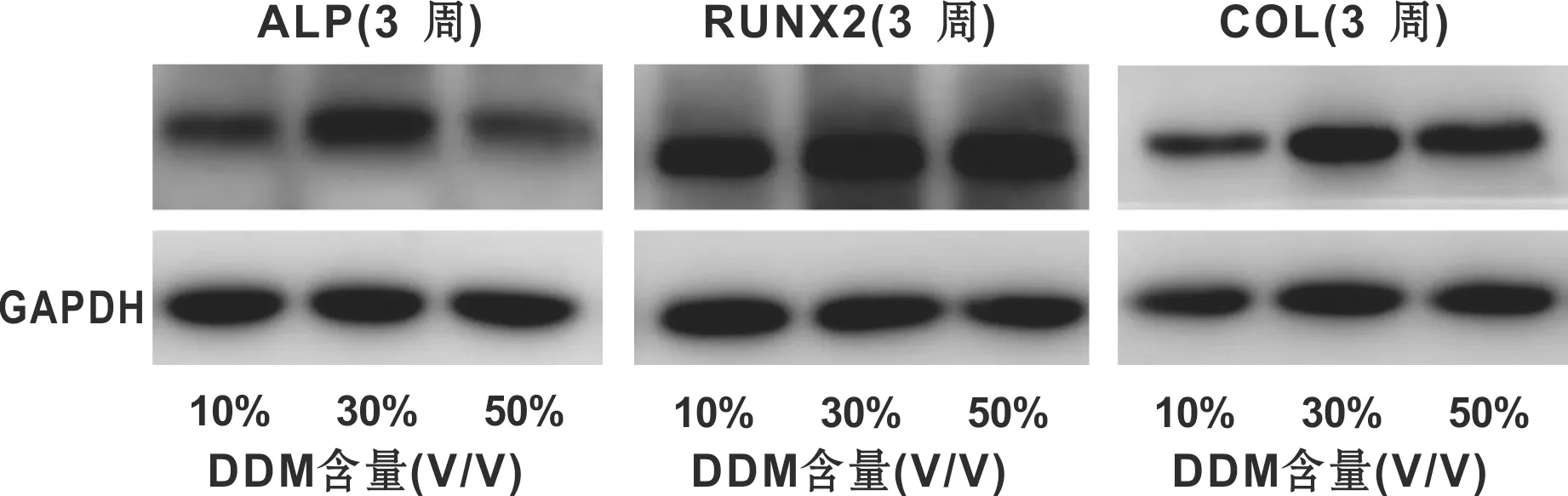
图 5 Western blot检测BMSCs-DDM-SF随时间蛋白生成变化
2.8 生物膜在植入大鼠颅骨缺损区组织化学免疫染色结果(图 6)
COL-1第2 周时局部有弱的表达(图 6A), 4、 12 周时在牙本质凹陷内表达显著, 24 周COL-1最显著(图 6B)。RUNX22 周时表达阴性(图 6C), 4 周在DDM凹陷处出现强表达(图 6D), 24 周时RUNX2表达广泛但强度下降。OCN出现最晚, 12 周开始出现表达( 图 6E), 24 周时有较强表达(图 6F)。免疫组化显示: COL-1、RUNX2、OCN随时间延长依次表达。
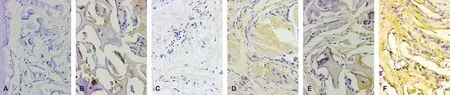
图 6 DDM-SF在植入动物体内的免疫组化染色(×200)
2.9 SF、 30% DDMSF在动物体内的HE染色结果
HE染色显示6%SF膜结构呈连续性孔的结构。SF膜体内修复骨缺损2 周时细胞散在支架空隙中,在4 周时(图 7A)细胞增殖明显, 12 周时高倍镜下细胞在膜局部区域密集,增殖较快,充满整个通道;孔隙较大的区域细胞稀疏(图 7B)。 24 周时丝素蛋白大部吸收。试验组30% DDM-SF与SF膜比较组织形成分散均匀, 4 周时(图 7C)类成骨细胞和类骨质在牙本质表面附近出现; 12 周时细胞、类骨质和成骨细胞更加丰富; 24 周时类骨质在DDM吸收的凹陷处形成明显(图 7D)。
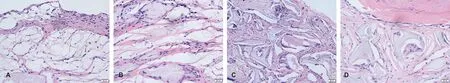
图 7 SF膜、DDM-SF膜植入动物体内不同时间段HE染色(×100)
3 讨 论
3.1 孔径对生物膜及组织工程支架承载细胞功能的影响
骨组织工程中支架的孔状结构为种子细胞提供附着、代谢、迁移的空间,理想的空隙直径在100~300 μm之间[6-9]。30% DDM-SF制作的生物膜孔隙直径为(106.637 0±25.445 4) μm、孔隙率为82.99%,适合细胞进行正常的生理活动。当DDM比例增加至50%时,孔径<100 μm,不适合再作为骨组织工程支架。XRD显示生物膜为DDM散布其间的多孔立体结构,有利于细胞的生长。在HE染色的局部剖面中显示膜适宜孔径通道对细胞增殖迁移较佳,局部过大或过小的孔径不利于细胞的迁移、增殖。
支架孔的制备方法中冷冻干燥法工艺相对简单,为常采用的孔隙制备方法[10],但膜的孔径、孔隙率与浓度呈反比,孔隙率随冷冻温度的降低而升高。DDM-SF经-20 ℃预冷冻保留了孔的较大直径,再经-60 ℃冻干增加了材料的致孔率,与有关研究一致[11]。
3.2 DDM和PEG在丝素蛋白支架生物材料中的作用
成骨材料需要承受生理压力,来维持正常的功能,压缩强度是一个重要指标。研究资料显示SF支架的压缩强度与浓度呈正相关,同等条件下冻干制备的材料强度更佳[5,12]。目前SF支架的研究浓度多集中在1%~15%之间,不能承受骨在功能状态下的压缩,需生物羟基磷灰石、壳聚糖以及加入交联剂等方法提高材料力学性能[13]。本研究中以PEG为交联剂[14],PEG与DDM、SF可形成共价键,使DDM-SF压缩强度显著提高,同时PEG增加了生物膜的柔韧性[15]。但PEG具有一定的溶解性,易致细胞培养基变浑浊,使用浓度不宜过高。
在DDM-SF膜中DDM另外一个重要功能是作为细胞调控因子使用,也可以为成骨提供原材料[16];100~1 000 μm粒度的DDM被认为更有利于新骨形成[17],生物活性因子主要存在于有机基质内[18]。rBMSC接种到DDM-SF生物膜经体内、外培养,经WB检测RUNX2、BMP-2、ALP、Col-1等成骨蛋白有显著性表达;HE染色、组织化学免疫染色显示有类成骨细胞广泛分布及类骨质样组织形成,验证了DDM对成骨的诱导性。牙本质及DDM在牙髓病治疗和牙种植骨量不足临床患者中使用具有Bio-Oss同样的成骨效果[3,19]。
3.3 DDM-SF支架膜的生物相容性和应用展望
丝素在多项研究中认为是无细胞毒性的可吸收材料[20], 在模拟体内骨细胞生长环境中多孔丝素支架承载的细胞生长正常并有羟基磷灰石的沉淀以及类骨小梁细胞的出现[21]。SEM和CCK-8检测到细胞初期抑制,考虑与SF、DDM的材料处理试剂残留有关。生物膜在动物体内经HE染色、组织化学免疫染色切片中未见炎性细胞浸润,也验证了生物膜没有排斥反应;生物膜24 周时组织切片中细胞成分占据大部分,SF、DDM也大部吸收,说明DDM-SF具有良好的生物相容性、可吸收性。
综上, 由于SF、牙本质取材广泛、还可利用自体牙进行个性化的骨替代材料的制作,克服了伦理问题和免疫反应。随着新技术、新材料的发明如静电纺丝和石墨烯等,可以进一步提高DDM-SF材料性能,逐步解决细胞贴壁速率、材料孔径的均质性控制,材料的体内降解速度等。DDM-SF有望广泛应用于牙种植牙槽骨骨量不足的骨替代、下颌骨局部或大部丧失后的重建、面部美容等治疗。
