白内障术毕结膜囊应用黏弹剂对患者术后早期干眼的预防效果
2022-02-24李孝纯李明武
杨 斐 李孝纯 于 洋 李明武
干眼是因泪液的质或量以及泪液动力学异常而导致的以泪膜不稳定或眼表微环境失衡为特征的慢性眼表疾病[1]。目前已知白内障手术可诱发干眼或加重术前已有的干眼,影响患者术后视觉效果及生活质量[2-3]。由于干眼的发病机制尚未完全明确,临床常采用人工泪液对症治疗。近年来研究发现,白内障手术中将黏弹剂均匀覆盖角膜能够一定程度改善患者术后泪膜破裂时间(BUT)、眼表染色评分(OSS)等干眼相关指标,但对术后早期的干眼效果并不明显[4-6]。本研究拟探讨白内障术毕结膜囊应用黏弹剂对患者术后早期干眼的预防效果。
1 资料与方法
1.1 一般资料本研究为前瞻性随机对照研究。随机选取2020年6月至2021年2月在北京大学国际医院眼科行超声乳化白内障吸除联合人工晶状体植入术的年龄相关性白内障患者95例(114眼)。采用随机数字表法将患者分为两组,黏弹剂组48例(58眼),年龄(67.6±10.7)岁;对照组47例(56眼),年龄(69.9±11.3)岁。本研究遵循《赫尔辛基宣言》所要求的伦理学原则,并获得北京大学国际医院伦理委员会批准,患者均签署知情同意书。
1.2 纳入及排除标准纳入标准:(1)年龄相关性白内障患者;(2)年龄50~90岁;(3)晶状体核硬度为II-III级(按Emery核硬度分级标准)。排除标准:(1)眼睑异常(严重睑板腺功能障碍、睑缘炎、睑内翻倒睫、睑外翻等);(2)角结膜异常(长期配戴角膜接触镜、角结膜炎症等);(3)白内障手术后发生并发症;(4)合并泪道疾病;(5)有其他眼部疾病史或手术史;(6)合并糖尿病或自身免疫性疾病等。
1.3 手术方法手术均由同一位技术熟练的眼科医师完成。患者术眼表面麻醉2次,使用2.8 mm穿刺刀做透明角膜切口,前房注入DisCoVisc黏弹剂(美国Alcon公司),连续环形撕囊(直径5.0~5.5 mm),水分离,采用超声乳化仪(美国Alcon公司)进行超声乳化,抽吸皮质。之后前房再次注入黏弹剂,囊袋内植入可折叠、单焦点非球面后房型人工晶状体,吸除黏弹剂,水化闭合切口。术毕,黏弹剂组患者结膜囊内滴入黏弹剂后取出开睑器,敷料覆盖术眼;对照组患者结膜囊内滴入平衡盐溶液充分湿润眼表后取出开睑器,敷料覆盖术眼。记录手术总时长,从放置开睑器开睑后起始至术毕取出开睑器结束。术后两组患者均给予相同的预防感染及抗炎滴眼液。
1.4 观察指标术前1周,术后1 d、7 d、30 d依次记录和检测患者主观眼表疾病指数(OSDI)量表评分、BUT、OSS、Schirmer I 试验值(SIt),所有检查均由同一位医师完成。(1)OSDI量表评分:通过询问患者干眼相关的主观感受评价干眼程度,填写OSDI问卷调查表[7],统计得分。(2)BUT:在室内将湿润的丽丝胺绿-荧光素钠试纸条(天津晶明公司)接触患者下结膜囊1 s,嘱患者眨眼3~4次后在裂隙灯钴蓝光下观察。记录自最后一次瞬目后睁眼至角膜出现第一个黑斑的时间,连续测3次取平均值。(3)OSS:结膜染色按照睑裂区鼻侧及颞侧结膜着染点的数量进行评分。评分标准:无着染点或≤10个独立的着染点为0分;10个<着染点≤32个为1分;32个<着染点≤100个为2分;着染点>100个为3分;结膜OSS最高为6分。角膜染色根据着染点的数量、形态、分布进行评分。评分标准:无着染点为0分;1个≤着染点≤5个为1分;6个≤着染点≤30个为2分;着染点>30个为3分;着染点有融合、着染点位于瞳孔区或出现丝状角膜炎则在上述着染点评分基础上各加1分;角膜OSS最高为6分[8]。(4)SIt:室内安静环境下进行SIt检测,无表面麻醉下将泪液试纸条的反折段放置于患者下结膜囊中外1/3交界处,嘱患者轻轻闭眼,5 min后取出并记录试纸条泪液浸湿的长度即为SIt。
1.5 统计学方法采用SPSS 22.0统计学软件进行数据处理。采用K-S检验对数据进行正态性检验。正态分布数据比较采用t检验,非正态分布数据比较采用秩和检验;计数资料比较采用χ2检验。检验水准:α=0.05。
2 结果
2.1 两组患者一般资料及术前干眼相关指标比较两组患者的性别、年龄、手术总时长,术前OSDI评分、BUT、角膜与结膜OSS及SIt比较差异均无统计学意义(均为P>0.05)(表1)。
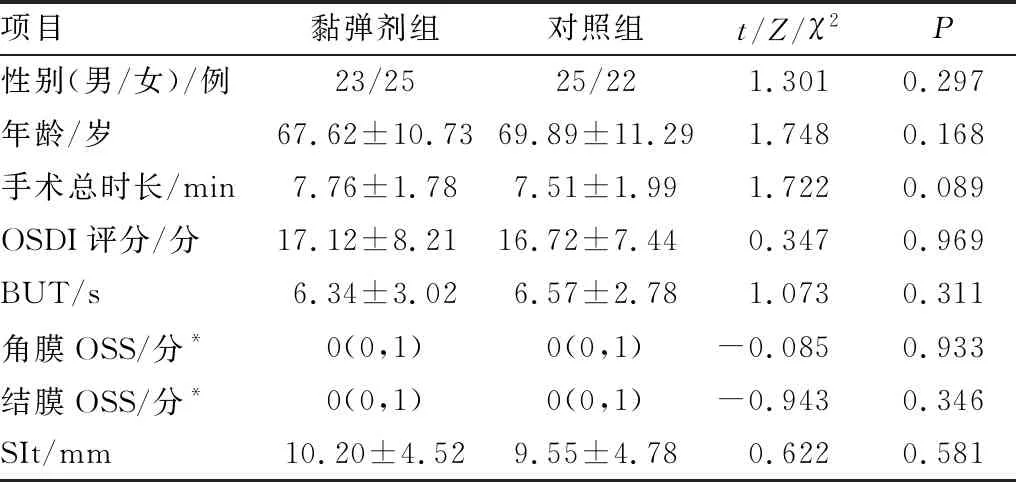
表1 两组患者一般资料及术前干眼相关指标比较
2.2 术后两组患者OSDI评分及BUT比较术后1 d、7 d、30 d两组患者OSDI评分均较术前提高,差异均有统计学意义(均为P<0.05)。术后1 d及30 d,黏弹剂组患者OSDI评分均低于对照组,差异均有统计学意义(均为P<0.05)。黏弹剂组患者术后1 d及7 d BUT较术前升高,对照组术后1 d BUT较术前降低,差异均有统计学意义(均为P<0.05)。术后1 d及7 d,黏弹剂组患者BUT均高于对照组,差异均有统计学意义(均为P<0.05)。其余时间点两组间比较差异均无统计学意义(均为P>0.05)(表2)。
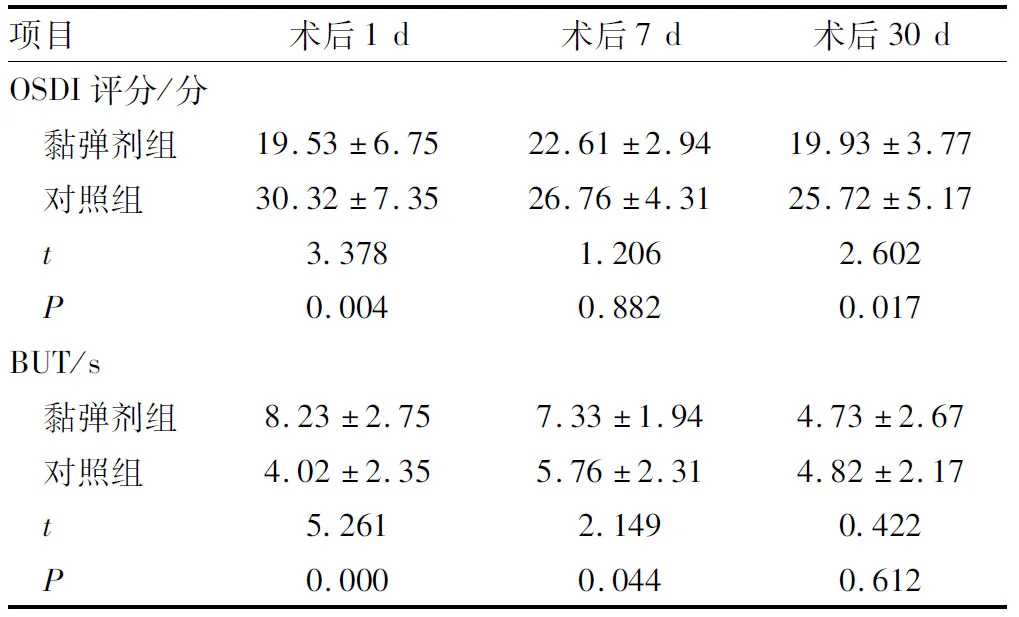
表2 术后两组患者OSDI评分及BUT比较
2.3 术后两组患者OSS及SIt比较对照组患者角膜OSS在术后1 d、7 d及30 d均高于术前,结膜OSS在术后1 d高于术前;黏弹剂组患者仅角膜OSS在术后1 d高于术前,差异均有统计学意义(均为P<0.05)。术后1 d、7 d及30 d黏弹剂组患者角膜OSS均低于对照组,术后1 d结膜OSS低于对照组,差异均有统计学意义(均为P<0.05)。术后1 d黏弹剂组患者SIt低于对照组,差异有统计学意义(P<0.05)。其余时间点两组间比较差异均无统计学意义(均为P>0.05)(表3)。
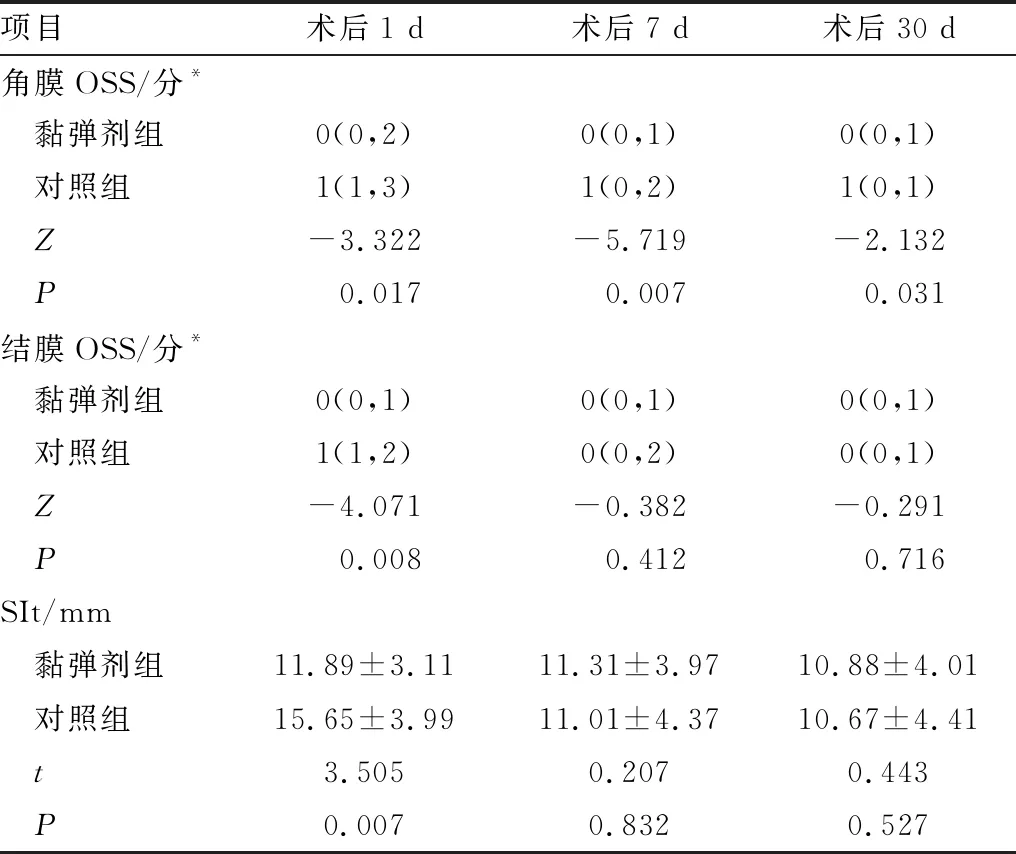
表3 术后两组患者OSS及SIt比较
3 讨论
术中操作对白内障患者眼表造成的损伤是导致术后干眼的重要原因,包括手术切口直接损伤角膜神经纤维、眼表暴露、药物毒性作用及灌注液冲刷等[9-11]。近年来国内外针对围手术期干眼防治的研究取得一定成果,其中黏弹剂在白内障手术中的作用受到人们的关注[12]。眼用黏弹剂主要成分为透明质酸及甲基纤维素,具有较好的水分保持及润滑功能。透明质酸可以加速角膜上皮细胞增殖并能下调炎症因子表达,促进眼表损伤修复[13-14]。随着透明质酸浓度增加,黏性相应升高,在眼表的停留时间延长,患者舒适度也随之提高[15-16]。本研究中黏弹剂组患者术后早期眼部主观感受优于对照组,这与黏弹剂组患者BUT、OSS、SIt术后早期的变化相一致。两组患者角膜及结膜OSS术后均出现不同程度升高,这可能与手术操作、术后药物使用损伤眼表有关,然而术后各时间点黏弹剂组患者角膜OSS均显著低于对照组,结膜OSS在术后1 d也同样低于对照组,且对照组即使随访至术后30 d,角膜OSS与术前及黏弹剂组仍然存在差异,据此可以解释为何对照组OSDI评分直至术后30 d仍高于术前。
本研究中两组患者BUT在术后30 d呈现相反的变化趋势。黏弹剂组患者BUT在术后1 d呈现短暂的增加,在术后7 d小幅度回落并且于术后30 d下降至基线水平以下。而对照组患者术后1 d的BUT较术前基线值显著下降,在术后7 d小幅度增加后再次于术后30 d下降。两组患者的BUT变化趋势都提示术后存在相对不稳定的泪膜状态。本研究对照组患者结果与Li等[9]研究结果一致,BUT在白内障手术后首先呈现显著下降,随后轻度增加,但直至术后3个月仍不能恢复至术前水平。而Yoon等[17]通过在白内障手术中应用眼用黏弹剂作为角膜保护剂,术后1个月内患者BUT变化趋势与本研究中黏弹剂组患者BUT的变化相同。分析原因可能为留置于结膜囊内的黏弹剂在瞬目后均匀覆盖于角膜及结膜表面,有助于预防及修复角膜、结膜上皮损伤,同时眼表的黏弹剂能够有效抑制术后眼表炎症因子聚集[18],从而减轻因炎症所诱发的干眼。因此在术后早期,两组患者BUT差异较大,而当术后规律使用抗炎药物后,黏弹剂的保护作用逐渐被洗脱,BUT值开始再次下降。本研究对照组患者的SIt在术后1 d显著高于黏弹剂组,结合OSS及BUT结果,我们考虑这与对照组患者的角膜、结膜上皮损伤较黏弹剂组显著,反射性刺激泪液分泌增加有关。以上结果表明,虽然开睑器、表面麻醉药物、长时间光照刺激及术后滴眼液的应用等多种无法避免的因素均会导致白内障患者术后存在不同程度的干眼,但结膜囊留存黏弹剂可有效减少手术所致的眼表上皮损伤,改善患者术后干眼症状和体征。
综上所述,白内障术毕结膜囊应用黏弹剂有助于减轻手术对患者干眼相关指标如OSS及SIt的影响,且在一定程度上提高了泪膜稳定性,改善了患者术后早期的主观不适感。此外,在白内障手术中常规均使用黏弹剂,术毕应用黏弹剂并不会额外增加患者的经济负担。因此,白内障术毕结膜囊应用黏弹剂可作为白内障患者术后预防及改善干眼的有效方法。
