特发性黄斑前膜合并白内障患者房水中细胞因子表达及其与白内障手术预后的相关性研究△
2022-02-24李鹏飞耿文静袁玉蓉管怀进
宋 佩 李鹏飞 耿文静 苏 舒 袁玉蓉 陈 威 吴 坚 季 敏 管怀进
黄斑前膜(ERM)是沿着视网膜内表面异常发展的无血管性纤维增殖膜[1]。ERM在病变早期呈薄而透明的状态,进展之后可引起黄斑皱褶或增厚,破坏视网膜结构,导致视力降低、视物变形和复视等视觉质量问题[2-3]。流行病学研究调查结果显示,我国不同地区ERM的发生率为7.6%~8.4%[4-5];在国外,由于种族差异,ERM的发生率为7.0%~28.9%[6-7],并且随着年龄的增加而提高[8]。ERM由细胞和细胞外基质(ECM)组成,发生率最高的类型是特发性黄斑前膜(iERM),但其具体发病机制尚不十分清楚,有研究显示,其与眼内疾病或者手术史均不相关[8]。近年来,有学者发现在细胞因子的刺激作用下,视网膜胶质细胞、视网膜色素上皮细胞(RPE)等会发生增殖、迁移和上皮-间充质转化(EMT),促进ECM的过度沉积,导致iERM的形成[9-10],因此,检测细胞因子表达变化对研究iERM的发病机制具有一定价值。
眼内液是重要的细胞因子生存环境,但很少见关于iERM患者房水中细胞因子检测的报道。本研究检测了iERM患者和老年性白内障(ARC)患者房水中细胞因子浓度变化,并将其与白内障超声乳化术后3个月相关预后指标进行相关性分析,以挖掘与iERM形成和术后恢复相关的细胞因子。
1 资料与方法
1.1 一般资料选取2020年5月至2021年2月在南通大学附属医院眼科住院并行白内障超声乳化术的iERM患者(iERM组)25例(27眼)和ARC患者(对照组)23例(25眼)为研究对象。iERM组患者纳入标准:(1)光学相干断层扫描(OCT)检查发现视网膜内表面不规则、中强反射信号条带;(2)合并有白内障且仅需接受白内障超声乳化术的患者。iERM组患者排除标准:(1)合并有糖尿病等系统性疾病、高度近视、青光眼、眼外伤、眼内手术史或其他引起非iERM的任何视网膜疾病;(2)房水量不足50 μL。对照组患者纳入标准:符合ARC诊断标准并接受白内障超声乳化术,且无其他眼部或全身疾病者。该研究已通过南通大学附属医院伦理办公室的批准,所有患者均签署知情同意书。
1.2 方法所有患者术前和术后随访均接受了全面的眼科检查,包括视力、眼压、裂隙灯、OCT等检查。两组患者均接受标准的白内障超声乳化术。在制作角膜切口前用一次性1 mL注射器于角膜缘处行前房穿刺,抽取未稀释房水样本50~100 μL装入无菌Eppendorf管中,立即存入-80 ℃冰箱以待检测。细胞因子的测定采用Luminex液相芯片技术,使用Bio-Plex Pro Human Cytokine Screening 48-plex Panel 试剂盒(Bio-Rad公司,美国),所有的步骤均严格按照说明书进行。主要步骤:准备好标准品、样品、空白孔样品各50 μL加入已振荡混合好的磁珠中,封板,避光振荡,室温孵育30 min。洗板3次,每孔加入25 μL稀释好的检测抗体,封板,避光振荡,室温孵育30 min。洗板3次,每孔加入50 μL稀释好的链霉亲和素-藻红蛋白,封板,避光振荡,室温孵育10 min。洗板3次,每孔加入125 μL缓冲液重新悬浮磁珠,封板,避光振荡,室温孵育30 s。使用Bio-Plex 检测系统软件进行分析,最终获取样本的浓度值。
1.3 观察指标记录iERM组患者白内障超声乳化术术前和术后3个月的最佳矫正视力(BCVA)。使用蔡司CIRRUS HD-OCT500 以黄斑为中心进行扫描,测量黄斑中心凹厚度(CFT)、黄斑体积(MV)和黄斑平均厚度(MT)。当黄斑中心凹存在时,以黄斑中心凹为扫描中心;若黄斑中心凹不存在,则以内核层与外核层交界面向玻璃体凸起的最高点作为中心凹[11]。CFT定义为中心凹周围1 mm范围内内界膜内界到RPE层外界的平均厚度。MV和MT分别为中心凹周围6 mm范围内内界膜内界到RPE层外界的总体积和平均厚度。当CFT>250 μm时被认定为黄斑水肿(ME)。检测4类房水细胞因子,包括促炎性细胞因子[干扰素(IFN)-α2、白细胞介素(IL)-1α、干细胞因子(SCF)、肿瘤坏死因子(TNF)-α等]、促炎性趋化因子[皮肤T细胞虏获趋化因子(CTACK)、生长调节致癌基因-α(GRO-α)、嗜酸性粒细胞趋化因子(Eotaxin)、单核细胞趋化蛋白-1(MCP-1)、干扰素-γ诱导单核细胞因子(MIG)、干扰素诱导蛋白-10(IP-10)、巨噬细胞炎症蛋白-1α(MIP-1α)和基质细胞衍生因子-1α(SDF-1α)等],抗炎性细胞因子[巨噬细胞游走抑制因子(MIF)等]和生长因子[碱性成纤维细胞生长因子(bFGF)、粒细胞集落刺激因子(G-CSF)、肝细胞生长因子(HGF)、巨噬细胞集落刺激因子(M-CSF)、血小板源性生长因子-BB(PDGF-BB)和干细胞生长因子-β(SCGF-β)],共48种。只有在两组中检出率都达到90%的细胞因子才进行下一步分析[12],共33种细胞因子符合要求。
1.4 统计学方法采用SPSS 24.0统计学软件进行数据处理。计量资料采用均数±标准差表示。BCVA转换为logMAR形式进行分析。属于正态分布的资料运用独立样本t检验,非正态分布资料则采用Mann-WhitneyU检验;分类资料采用χ2检验。为避免由于排除低于标准曲线拟合的细胞因子浓度值引起的偏差,将这些浓度值设置为该细胞因子最低标准浓度的一半。为避免I型错误,我们应用了Bonferroni校正,并将P<0.001 5 (0.05/33)认为差异具有统计学意义。差异表达的细胞因子之间以及细胞因子与临床指标之间应用Spearman秩相关进行相关性分析。检验水准:α=0.05。
2 结果
2.1 两组患者一般资料比较iERM组患者25例(27眼),男6例(7眼),女19例(20眼),年龄(73.70±5.76)岁。对照组患者23例(25眼),男5例(6眼),女18例(19眼),年龄(72.88±5.06)岁。在性别和年龄分布上,两组受试者差异均无统计学意义(均为P>0.05),组间具有可比性。
2.2 iERM组和对照组患者房水中各细胞因子浓度比较iERM组患者房水样本中有16种细胞因子的浓度水平相比于对照组显示出明显的升高趋势(均为P<0.05),包括CTACK、G-CSF、GRO-α、HGF、IL-2、IL-4、IL-7、IL-8、IL-10、IL-12(P40)、MCP-3、MIG、MIP-1α、PDGF-BB、SCGF-β 和 TNF-α;剩余的17种细胞因子在两组患者中展现出相似的浓度值。然而,经过校正后,只有4种细胞因子的浓度在iERM组患者比在对照组患者中表达明显升高(均为P<0.001 5),即GRO-α、IL-2、IL-7和PDGF-BB(表1)。
2.3 iERM组患者房水样本中差异表达的细胞因子相关性分析在比较对照组和iERM组患者的房水细胞因子浓度后发现,iERM组患者有4种细胞因子明显高表达,包括GRO-α、IL-2、IL-7和PDGF-BB,并且在iERM组患者中各因子两两之间均存在显著的正相关关系(均为P<0.05)(表2)。
2.4 iERM组患者白内障超声乳化术术前和术后BCVA和OCT参数的比较iERM组中有23例患者(24眼)完成了术后3个月随访,均无不适主诉;其余2例自觉恢复可,拒绝随访。所有患者均未出现iERM等级加重。1例未出现iERM等级加重患者OCT图和眼底图见图1。其中,5例(5眼)术前iERM不累及黄斑中心凹的患者其术后黄斑区无明显变化;6例(6眼)术前iERM累及黄斑中心凹但未出现继发性ME的患者术后黄斑区无明显变化;12例(13眼)术前iERM累及黄斑中心凹并出现继发性ME的患者中,有1例出现明显的囊样水肿,其余均出现轻微的弥漫性黄斑水肿加重。总体上,患者白内障超声乳化术术后3个月,iERM组患者的BCVA较术前明显改善,CFT、MV和MT则均较术前明显升高,差异均有统计学意义(均为P<0.05)(表3)。
2.5 iERM组患者房水中细胞因子浓度与BCVA和OCT参数之间的相关性分析iERM组患者房水中CTACK浓度与BCVA(logMAR)变化(术后与术前的差值)呈正相关关系(r=0.445,P=0.043),IL-4浓度与MT变化(术后与术前的差值)呈负相关关系(r=-0.471,P=0.031),其余细胞因子与临床指标间均未表现出统计学意义的相关(均为P>0.05)。
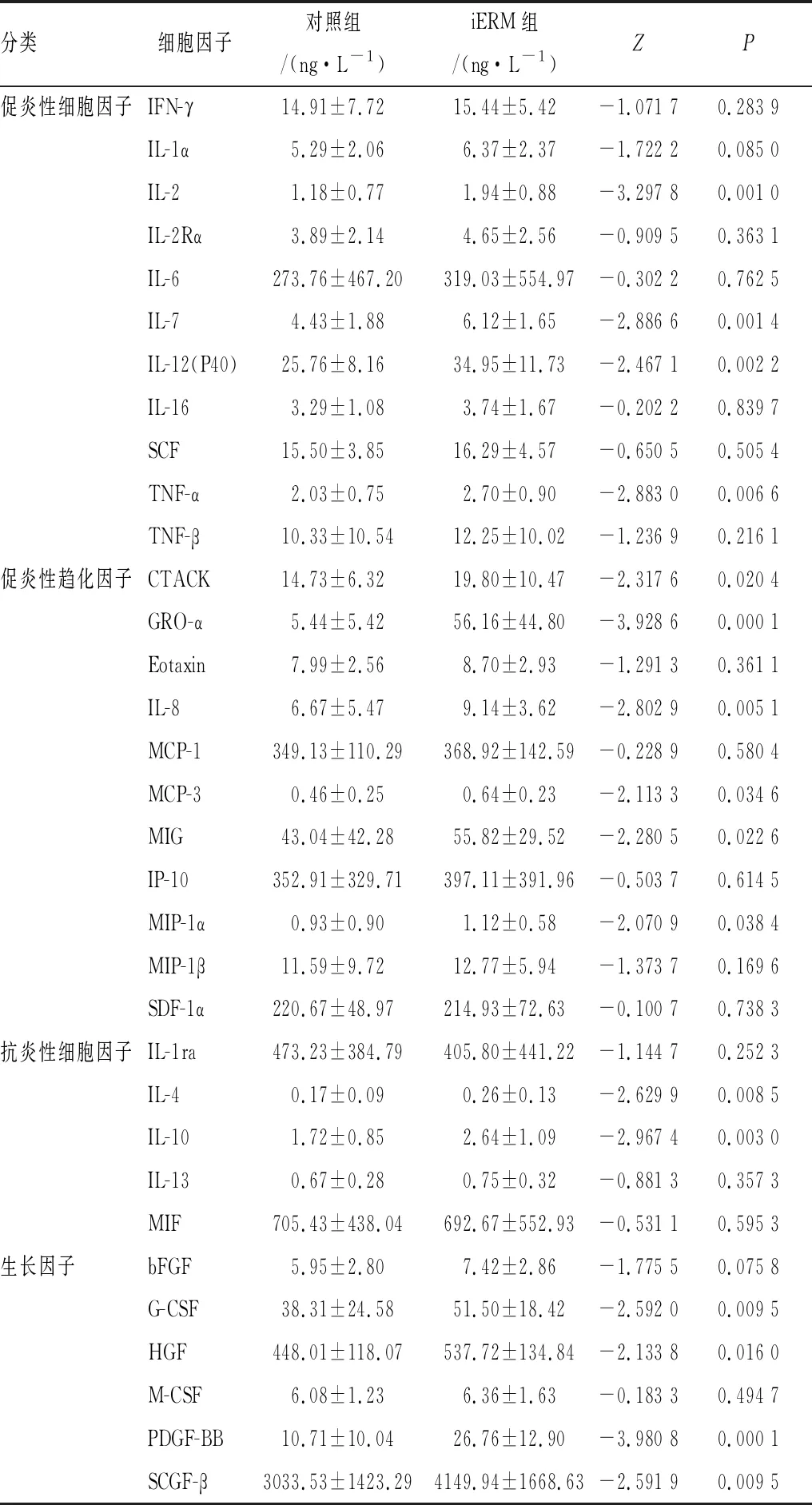
表1 对照组与iERM组患者房水中各细胞因子浓度比较
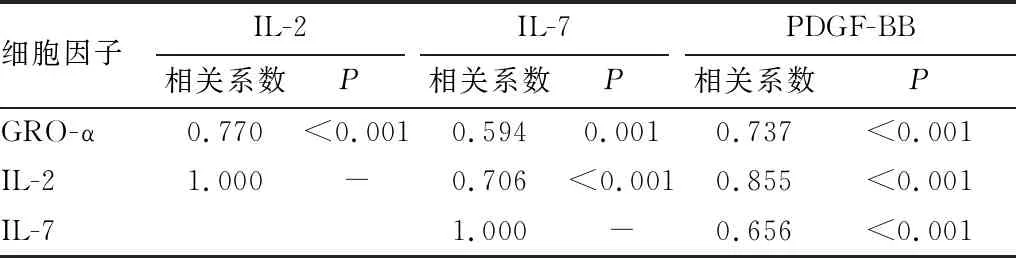
表2 GRO-α、IL-2、IL-7和PDGF-BB细胞因子间相关性分析结果
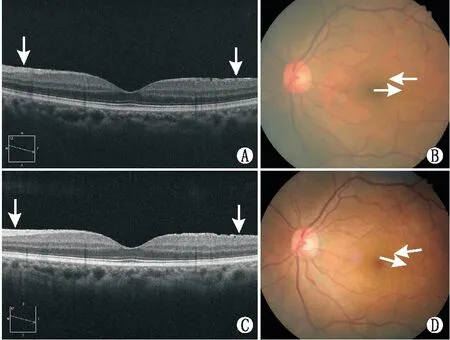
图1 1例iERM患者白内障超声乳化术术前和术后3个月的OCT图像和眼底照片 A:患者术前OCT图像;B:患者术前眼底照片;C:患者术后3个月OCT图像;D:患者术后3个月的眼底照片。注:箭头示视网膜皱褶;方格示OCT图像对应的眼底界面位置。
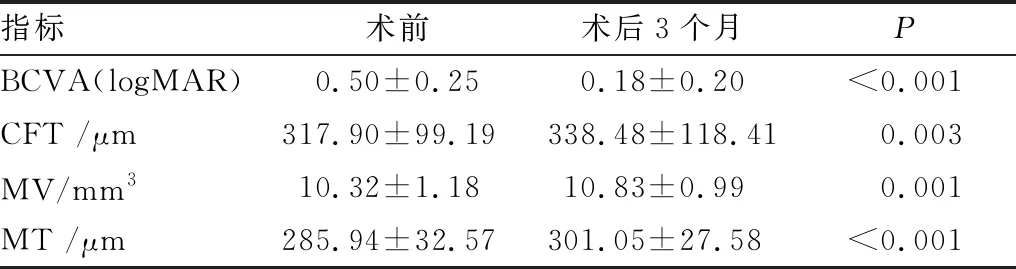
表3 iERM组患者白内障超声乳化术术前与术后3个月BCVA和OCT参数的变化比较
3 讨论
细胞因子通过介导视网膜胶质细胞炎症和纤维化反应促使iERM的形成,进而影响人们的视觉质量[13]。因此,有研究发现,iERM形成相关的细胞因子具有重大研究价值[14]。眼内液是眼内细胞因子生存的主要环境,检测房水是目前研究眼内疾病细胞因子机制的常用手段[15-17]。同时考虑到房水获取的安全性、便利性和可重复性[18],以及目前鲜有人对iERM患者的房水进行检测,所以本研究也选择将房水作为检测样本,采用Luminex液相芯片技术检测iERM组患者和对照组患者房水细胞因子的表达;同时,本试验也将细胞因子与临床预后指标进行相关性分析,探讨其对iERM患者白内障超声乳化术预后的影响。
有研究对iERM患者的玻璃体细胞因子进行了检测,并提出有一半以上的细胞因子水平明显高于对照组[19]。与之相似,本研究结果显示,相比于对照组,iERM组患者的房水微环境整体呈现高度炎症状态,有一半的细胞因子出现明显的上升趋势,其中,GRO-α、IL-2、IL-7和PDGF-BB水平升高趋势最为明显。GRO-α属于趋化因子CXC家族,有报道指出,GRO-α通过促进RPE细胞的迁移加快视网膜纤维增殖性疾病,例如增生性玻璃体视网膜病变(PVR)的发展[20-21]。IL-2则能通过与转化生长因子-β相互作用,加强细胞的增殖、迁移、EMT过程和ECM的过度沉积,加速纤维增殖膜的形成[22-23]。PDGF-BB也通过类似的作用参与ECM的沉积和重塑过程,介导ERM形成[24-25]。IL-7属于促炎性细胞因子,能通过诱导RPE产生MCP-1和IL-8从而发挥促纤维化能力[26-27]。本研究中,这4种细胞因子的升高说明其在iERM的发生发展中起着至关重要的作用,可能成为未来iERM患者新的治疗靶点。
同时,本研究还探讨了细胞因子之间的关系,结果显示,GRO-α、IL-2、IL-7和PDGF-BB之间均存在正相关关系。细胞因子之间的正反馈现象表明这4种细胞因子之间彼此通过联动调控,共同参与iERM的形成过程,单独治疗其中一种因子的升高不能有效治疗iERM。所以了解它们之间的联系更有助于我们全面了解iERM的机制以及后续治疗方案的设计。
有研究显示,白内障超声乳化术可能会加快iERM的进展或发生,并伴随术后视力恢复差和黄斑区结构变化等问题[28-29]。本研究将iERM患者白内障超声乳化术前和术后3个月视力及OCT参数进行对比发现,术后患者的黄斑区呈现出增厚的趋势,这与Tsilimbaris等[30]和Giansanti等[31]的研究结果相似。继往研究显示,细胞因子作为调节蛋白,参与眼内多种疾病的发生发展过程。本研究在进行相关性分析后发现,CTACK与BCVA(logMRA)变化呈正相关,即高表达CTACK与视力恢复缓慢有关;同时,CTACK作为促炎性趋化因子,在PVR眼中表达明显升高[32-33]。本试验中,CTACK在iERM眼中也显示出上升趋势,所以我们推测,CTACK很可能与术后视网膜纤维增殖膜的形成发展而导致的视力恢复缓慢有关。此外,本研究还发现术前高浓度IL-4能抑制白内障超声乳化术术后黄斑厚度的增加。众所周知,IL-4是典型的抗炎性细胞因子,主要通过将巨噬细胞的促炎表型M1极化为抗炎表型M2发挥抗炎作用[34]。研究显示,在眼部疾病中,IL-4通过下调VEGF的表达显著改善高葡萄糖环境下被IL-1β诱导的人RPE和视网膜内皮细胞的炎症反应[35]。所以,IL-4有望成为改善白内障患者术后黄斑厚度增加的治疗靶标。值得注意的是,除了细胞因子外,机械性牵拉也可能导致黄斑区增厚,例如,手术刺激导致iERM收缩牵拉黄斑区、晶状体取出后玻璃体前移牵拉视网膜等,本研究也无法完全忽略这些因素的影响。然而,本研究结果初步显示,并未发现患者出现iERM等级加重,但是也不能排除iERM产生新皱褶或者皱褶加深等细微变化带来的影响。
综上所述,iERM患者房水中具有独特的、与炎症和纤维化过程密切相关的细胞因子微环境。本研究结果显示,GRO-α、IL-2、IL-7和PDGF-BB的房水细胞因子浓度表达在iERM患者眼中明显升高。这4种细胞因子可能通过彼此的协同关系参与iERM的发生机制。本研究扩充了iERM形成相关的房水细胞因子,并为iERM的机制和治疗研究提供了参考。此外,本研究还发现与白内障超声乳化术术后视力和黄斑厚度变化相关的细胞因子CTACK和IL-4,其可以作为优化白内障手术预后的潜在治疗靶点。但是,本研究也存在样本量小,随访时间短等局限性,无法进行深度分析,结果存在一定的偏倚性。后续我们会继续扩大入组患者数量,延长随访时间,增加试验结果的可信度。
