菲对日本虎斑猛水蚤摄食、生长发育和繁殖的影响❋
2022-02-24李连旭汝少国
李连旭, 王 军, 李 旋, 王 东, 汝少国
(中国海洋大学海洋生命学院, 山东 青岛 266003)
多环芳烃(Polycyclic aromatic hydrocarbons, PAHs)是指由两个或两个以上苯环组成的有机化合物,具有致癌、致畸、致突变和难降解等特性,一直以来都是环境科学领域备受关注的一类污染物[1-2]。PAHs在水体、沉积物和生物体内被广泛检出,并且低环PAHs占主导地位[3-5]。Yu等[6]发现二环和三环PAHs是中国七条主要河流PAHs污染的主要组分,其中三环的菲(Phenanthrene, Phe)被认定为需要优先控制的一种PAHs。Phe在中国海水与地表水中的浓度通常在50 ng/L~26.1 μg/L之间[7-8],如九龙江河口、闽江河口、珠江澳门水域和长江口表层水体中Phe的浓度分别为1 370、1 700、101.8和91.73 ng/L[9-13]。鉴于Phe的高检出率与高环境浓度,它常被作为PAHs的代表,用于研究此类污染物对海洋生物的毒性效应[14-15]。
萘、菲、荧蒽和苯并[a]芘对大型蚤(Daphniamagna)的24 h半数致死浓度(LC50)分别为5.485、3.226、0.295和0.004 1 mg/L;0.4 mg/L的Phe暴露会对大型蚤的体长、产卵时间与初次产幼时间产生显著影响[16]。1,2-二甲基萘和芘对火腿伪镖水蚤(Pseudodiaptomuspoplesia)的96 h LC50分别为788.98和54.68 μg/L[17]。Hung等[18]调查表明台湾高平海域浮游动物体内PAHs含量在5~5 440 ng/L(干质量),其中Phe是最主要的化合物,占总PAHs的10.5%。Yoshinori等[19]表明短时间内苯并[a]芘会对浮游动物的丰度和群落结构产生影响。由于海洋浮游动物占据着重要的生态学地位,所以急需拓展相关污染物对浮游动物的毒性效应研究。
海洋桡足类是海洋次级生产力的主要组成部分,在海洋生态系统的物质循环和能量流动中起重要作用[20-21]。日本虎斑猛水蚤(Tigriopusjaponicus)是一种广泛分布于西太平洋近岸的底栖桡足类[22],在实验室内易于培养、世代周期短、对污染物敏感,已被用作海洋污染物毒性测试的标准生物[23-24]。本研究选择日本虎斑猛水蚤为受试生物开展Phe的毒性效应研究。首先,测定了Phe对日本虎斑猛水蚤96 h的LC50。随后,利用不同浓度的Phe开展全生命周期暴露,从摄食率、发育周期、持续产幼量与卵囊发育时间等多个指标综合探究了Phe对日本虎斑猛水蚤的摄食、生长发育和繁殖能力的潜在危害,以期为评估PAHs对海洋浮游动物的生态风险提供基础。
1 材料与方法
1.1 实验材料和实验生物
菲(Phe, CAS NO.: 85-01-8, 纯度99.9%)购自Dr. Ehrenstorfer GmbH公司(奥格斯堡, 德国),二甲基亚砜(DMSO, CAS NO.: 67-68-5, 纯度99.5%)购于Sigma-Aldrich公司(上海, 中国)。将5 mg Phe溶于1 mL DMSO制备成5 mg/mL的储液,常温下避光保存,每周更新一次。
本研究所用的日本虎斑猛水蚤已在实验室内连续培养了数代,在光照培养箱培养,条件为温度(21±2) ℃,光暗比12 h∶12 h。培养所用海水经0.45 μm滤膜过滤后灭菌,培养盐度为29±1。每天投喂1×105cells/mL青岛大扁藻(Platymonashelgolandica),并清除培养器皿底部沉降的饵料、粪便和尸体等残渣。
1.2 生物毒性实验
1.2.1 急性毒性实验 参照国标《GB/T 13266-91水质 物质对蚤类(大型蚤)急性毒性测定方法》进行。设置空白对照组、溶剂对照组,以及2.0、2.8、3.9、5.4、7.4、10.4、14.4 mg/L Phe暴露组,共9组。每个组挑选20只孵化时间小于24 h的日本虎斑猛水蚤无节幼体,持续暴露96 h,期间投喂青岛大扁藻作为饵料,浓度为1 × 105cells/mL。暴露体系为5 mL,所有实验组中的DMSO浓度均不高于0.1 ‰,每组设置3个平行。每24 h更新一次暴露液,并观察日本虎斑猛水蚤的状况,通过反复转动试验容器,以15 s内失去活动能力视为死亡,根据概率单位分析方法计算96 h的LC50[25]。
1.2.2 比生长速率 根据急性毒性实验结果设置Phe的慢性暴露浓度分别为0、5、50、500 μg/L,挑选孵化24 h以内的无节幼体开展暴露实验。实验在六孔板中进行,每孔放置10只无节幼体,每个实验组设置3个平行,所有实验组中的DMSO浓度均不高于0.1‰,实验过程中水质等条件与养殖过程相同。实验期间每天更换暴露液,并从各组随机选取6只日本虎斑猛水蚤,在显微镜下观察拍照,用S-gauge测量,记录体长、体宽,根据公式g=[ln(lt)-ln(l0)]/t,计算生长速率(g),式中:lt表示培养当天的日本虎斑猛水蚤体长,l0表示初始的无节幼体体长,t表示培养的天数。
1.2.3 发育时期 在实验前一天挑选带红褐色卵的雌性个体(n=100)于六孔板中培养,以保证实验所需的无节幼体均为同一时间段孵化。挑选新出生的F0代无节幼体(< 24 h)于12孔板中,每孔1只,每个实验组20个重复,暴露体系为4 mL,喂食和换液方式同1.2.1。每天在解剖镜下观察无节幼体的发育情况,记录各组从无节幼体至桡足幼体(N~C)、桡足幼体至成体(C~A)的发育时间。各时期虫体的判断标准为:无节幼体虫体腹部出现分节表示发育到桡足幼体期,而雄性触角特化为执握器、雌性生殖节愈合或挂卵表示发育到成体(见图1)。

(A~F.无节幼体时期Naupliu stages;G~J.为桡足幼体期Copepodid stages;K.雄性成体(箭头所示为特化成的执握器)。Adult males (The arrow shows the specialized clasper);L.雌性成体(箭头所示为愈合生殖节)。Adult females (The arrow shows the genital segments).)
1.2.4 总产幼数与卵囊发育时间 待日本虎斑猛水蚤发育至性成熟后,从各组收集雌体,在相同的Phe浓度下继续暴露,观察并记录日本虎斑猛水蚤10 d内的卵囊发育情况和产幼数量,以及卵囊发育时间(从挂卵孵化到下一次挂卵的时间)。
收集各组第三批新出生的F1代无节幼体(<24 h),转移至不含有Phe的清水中孵育,培养方式同上。统计F1代无节幼体(N)发育到桡足幼体期(C)和成体期(A)所需的时间。
1.2.5 摄食率、滤水率与呼吸率 在100 mL的密闭塑料瓶中配置含有0、5、50、500 μg/L Phe和1×105cells/mL青岛大扁藻液的培养体系。向每个瓶中投放30只饥饿了24 h的无节幼体,置于黑暗中持续暴露24 h。同时,设置溶剂对照组和藻类对照组(无桡足类),以表示微藻在无捕食条件下的正常生长情况,每个浓度设置3个平行。实验结束后,首先用YSI溶氧仪测定对照组和实验组的溶解氧(DO),然后取1 mL暴露液用鲁哥氏液固定,在显微镜下用血球计数板计数,计算青岛大扁藻的浓度。根据公式(1)~(3)计算滤水率、摄食率和呼吸率:
F=V(lnCt-lnCtf)/(N·t);
(1)
G=V(lnCt-lnCtf)(Ctf-C0)/[N·t(lnCtf-lnC0)]。
(2)
式中:F代表滤水率(mL·h-1),即每只桡足类每小时过滤的海水量;G代表摄食率(cells·h-1),即每只桡足类每小时过滤的饵料细胞数;V代表食物溶液体积(mL);N代表桡足类的只数;C0代表起始食物浓度(cells·mL-1);Ct代表对照瓶中的最终食物浓度(cells·mL-1);Ctf代表实验瓶中剩余食物浓度(cells·mL-1);t代表摄食时间(h)。
R0=(C0-Ci)·V·0.7/(n·t)。
(3)
式中:R0代表呼吸率 (μL·ind-1·h-1);C0代表空白对照组DO浓度(mg·L-1);Ci代表实验组DO浓度(mg·L-1);V代表实验溶液体积(mL);n为每瓶桡足类个数;t代表实验时间(h);0.7代表氧气质量转化体积的系数。
1.3 数据分析
数据采用平均值±标准差表示,用SPSS 22.0软件进行统计学分析,方差同质性用Levene’s方法检验,采用单因素方差分析(One-Way·ANOVA)评价对照组和各暴露组间的差异,并进行Tukey’s显著性检验,置信水平P< 0.05为差异显著,P< 0.01为差异极显著。
2 结果
2.1 Phe对日本虎斑猛水蚤的半数致死浓度
溶剂对照组日本虎斑猛水蚤的抑制率均为0。采用概率单位法计算出Phe对日本虎斑猛水蚤的48、72、96 h LC50分别为3.061、3.983和3.675 mg/L(见表1)。通过观察,日本虎斑猛水蚤死亡率随着暴露时间的延长和暴露浓度的升高逐渐升高,表现出明显的剂量效应关系(见图2)。

表1 Phe对日本虎斑猛水蚤急性毒性实验结果
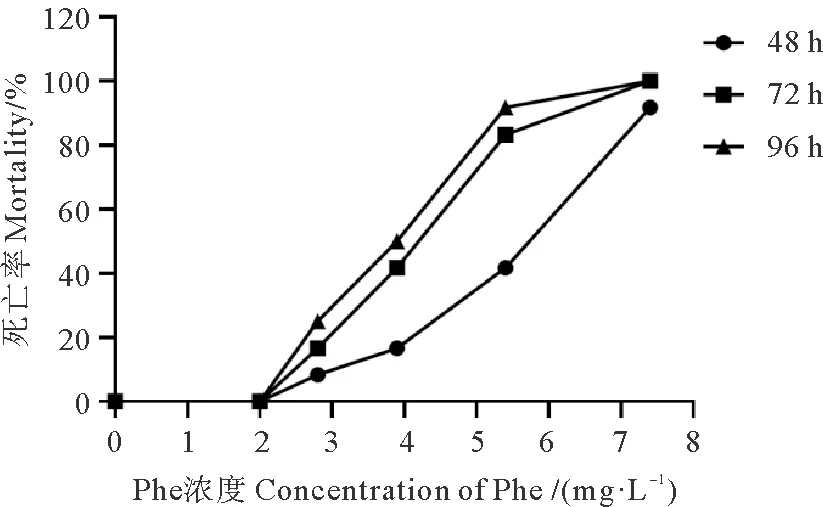
图2 不同浓度Phe对日本虎斑猛水蚤的致死率结果
2.2 Phe对摄食率、滤水率和呼吸率的影响
与空白对照组相比,50和500 μg/L Phe暴露显著降低了日本虎斑猛水蚤的滤水率与摄食率(P<0.05),其中摄食率只有对照组的45.1%与27.8%(见图3)。日本虎斑猛水蚤的呼吸率则在Phe的暴露下出现了剂量依赖性下降,与对照组相比分别下降了68.5%、84.4%、93.8%(P<0.01)。
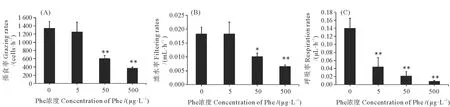
(表示与对照组相比具有统计学上的显著性(P<0.05),表示与对照组相比具有统计学上的极显著性(P<0.01)。The asterisks indicate statistically significant differences from the control group (P<0.05, P<0.01).)
2.3 Phe对生长和繁殖的影响
2.3.1 比生长速率 与空白对照组相比,5、50和500 μg/L Phe暴露72和96 h均显著降低了日本虎斑猛水蚤的比生长速率(P<0.05),其中500 μg/L Phe暴露组72和96 h的比生长速率分别比对照组下降了67.2%和63.9%(P<0.01, 见图4)。50和500 μg/L Phe暴露24 h后日本虎斑猛水蚤的比生长速率也出现了显著下降(P<0.05),而48 h时各组的比生长速率无显著性差异(P>0.05)。
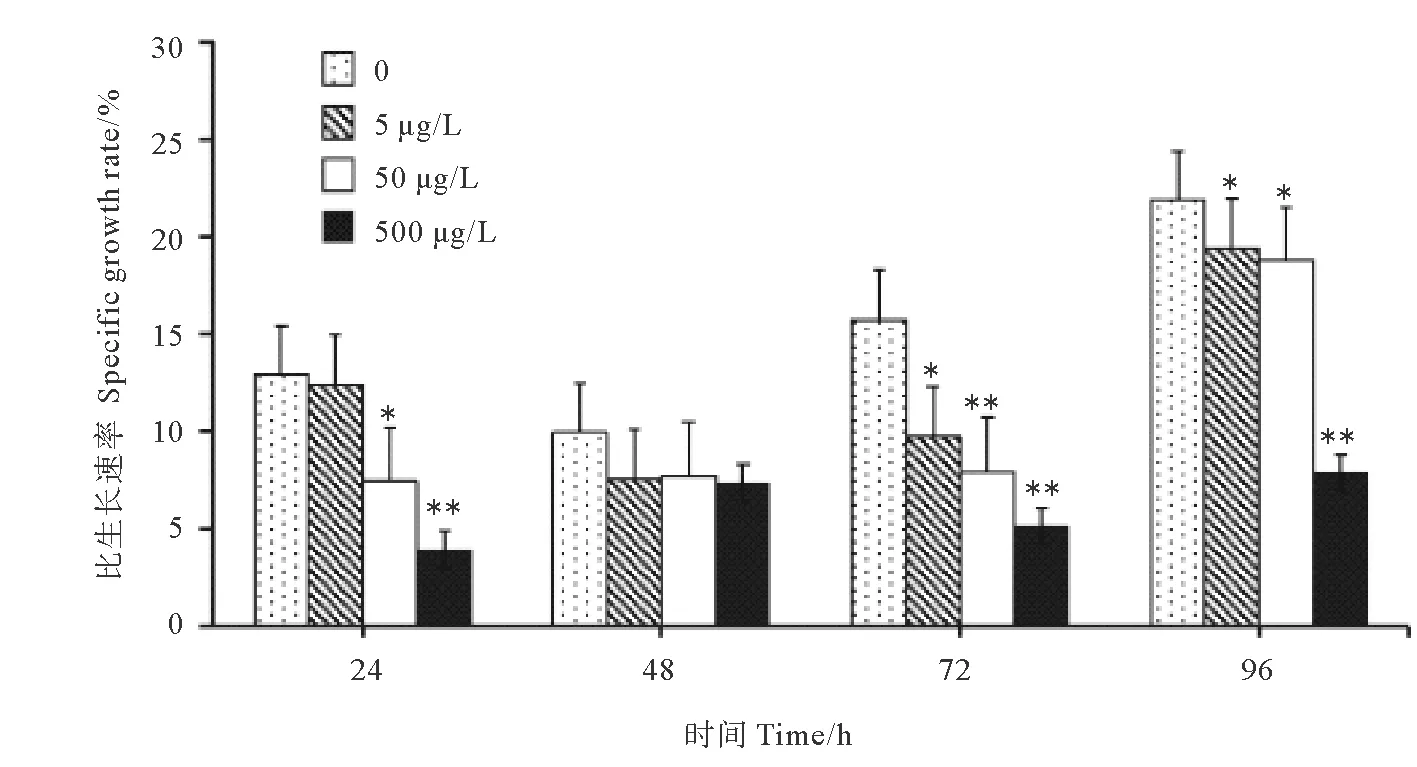
(表示与对照组相比具有统计学上的显著性(P<0.05),表示与对照组相比具有统计学上的极显著性(P<0.01)。The asterisks indicate statistically significant differences from the control group (P<0.05, P<0.01).)
2.3.2 发育时间 与对照组相比,5、50和500 μg/L Phe暴露显著延长了F0代日本虎斑猛水蚤从无节幼体发育到桡足幼体、从无节幼体为发育到成体,以及从桡足幼体发育到成体的时间,并且Phe对F0代发育时间的延长表现出明显的剂量依赖效应(P<0.01, 见图5)。500 μg/L Phe暴露下F0代交配后无挂卵雌蚤出现,未产出F1代。收集5和50 μg/L Phe暴露后F0代雌蚤产出的F1代在清水中培养,发现它们的发育时间与对照组相比显著延长(P<0.01)。

(表示与对照组相比具有统计学上的显著性(P<0.05),表示与对照组相比具有统计学上的极显著性(P<0.01)。The asterisks indicate statistically significant differences from the control group (P<0.05, P<0.01).)
2.3.3 挂卵率 与对照组相比,5、50和500 μg/L Phe暴露18 d显著降低了日本虎斑猛水蚤的挂卵率,其中500 μg/L Phe暴露组未出现挂卵现象(P<0.01),导致生殖失败(见图6)。
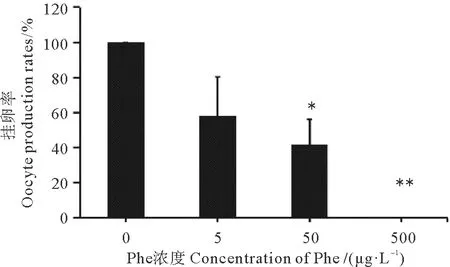
(表示与对照组相比具有统计学上的显著性(P<0.05),表示与对照组相比具有统计学上的极显著性(P<0.01)。The asterisks indicate statistically significant differences from the control group (P<0.05, P<0.01).)
2.3.4 总产幼数和卵囊发育时间 与对照组相比,50 μg/L Phe暴露导致日本虎斑猛水蚤10 a内的总产幼数出现显著下降(P<0.01),仅为对照组的58.3%(见图7A)。此外,50 μg/L Phe暴露下卵囊发育时间也出现了显著延长(P<0.01, 见图7B)。

(表示与对照组相比具有统计学上的显著性(P<0.05)。The asterisks indicate statistically significant differences from the control group (P<0.05).)
3 讨论
3.1 Phe对日本虎斑猛水蚤幼体的急性毒性效应
本研究测得Phe对日本虎斑猛水蚤幼体的96 h-LC50为3.675 mg/L。急性毒性试验即单次给药毒性试验,指机体(人或试验动物)一次(或24 h内多次)接触外来化合物之后所引起的中毒效应,甚至死亡[26-28]。桡足类种类繁多且存在多个发育阶段,导致同一种污染物对不同桡足类的急性毒性数据存在较大差异。例如,Phe对汤氏纺锤水蚤(Acartiatonsa)的48 h LC50为316.7 μg/L,而Phe对萼花臂尾轮虫(Brachionuscalyciflorus)的24 h EC50为195.7 mg/L[29-30]。有研究报道Phe对伪镖水蚤(Pseudodiaptomuspelagicus)的96 h LC50为161 μg/L[31],远低于本研究测得Phe对日本虎斑猛水蚤的96 h LC50值。急性毒性测试结果为污染物环境基准的制订与生态风险评估工作的开展提供基础数据。为保证制订的环境标准能够有效保护整个生态系统,建议采用生物的敏感期开展暴露实验。
3.2 Phe对日本虎斑猛水蚤摄食、呼吸以及生长发育的影响
慢性毒性暴露实验结果表明,5、50和500 μg/L Phe暴露均导致日本虎斑猛水蚤的呼吸率显著下降,同时高浓度的Phe暴露显著降低了其摄食率和滤水率。随着Phe暴露浓度的增加,日本虎斑猛水蚤的比生长速率逐渐降低,其中中、高浓度Phe暴露显著降低了日本虎斑猛水蚤F0和F1代的发育周期。低浓度Phe暴露虽然没有影响F0代的发育周期,但是导致F1代的发育周期延长。Yoon等[32]报道20 mg/L阿特拉津长期暴露日本虎斑猛水蚤,会导致生长发育迟缓,蜕皮和变态时间延长。Fei等[33]研究表明,食物短缺会延长日本虎斑猛水蚤的幼虫发育。本研究的生长速率的降低和发育周期的延长也是摄食率的降低导致。例如,暴露于3.5 μg/L甲维盐24 h后日本虎斑猛水蚤出现部分个体趴底、运动能力明显下降的现象,而5 μg/L甲维盐会导致所有个体均趴底,无自主活动能力,严重影响到其摄食和滤水的效率[34]。因此,Phe可能是通过减少桡足类的摄食,降低其营养积累,导致最终生长发育缓慢。
3.3 Phe对日本虎斑猛水蚤繁殖能力的影响
Phe暴露下日本虎斑猛水蚤虽有持续交配行为,但随着Phe浓度的升高其挂卵率不断下降,500 μg/L暴露组甚至无挂卵,导致无F1代产生。在高浓度Phe暴露下,日本虎斑猛水蚤的10 d总持续产幼数显著下降,且卵囊发育时间显著增加。出现这一现象的原因可能是其在面临环境的胁迫时将自身所获得的能量更多的分配在抵御环境胁迫上,而减少分配在发育及繁殖上的能量。王超等[35]研究指出55.29 μg/L的四溴双酚A(TBBPA)可以导致日本虎斑猛水蚤雌体生殖力显著升高。徐风风[36]的研究发现高浓度的四溴联苯醚(BDE-47)会导致日本虎斑猛水蚤产幼数量明显减少。桡足类的卵富含脂类,会积聚高浓度的亲脂污染物[18,37]。Almeda等[37]报道Acartiatonsa经过石油暴露后,其卵中会存在Phe、荧蒽(Fluoranthene)等PAHs,表明PAHs可以通过卵向下一代转移。金香琴等[16]报道PAHs会对雌性大型水蚤的最终体长、初次挂卵时间、初次产幼时间以及产水蚤总量产生显著的影响,其中雌性大型水蚤的最终体长和产水蚤总量对PAHs最为敏感。因此,PAHs暴露会引起桡足类为抵御不良状态而降低产卵量,同时降低生长发育速率,导致种群数量减少。
综上所述,Phe暴露导致日本虎斑猛水蚤的摄食率、滤水率和呼吸率受到抑制,发育周期延长,繁殖能力下降,且存在一定时间和剂量效应。海洋桡足类作为食物链中重要的一环,是多种海洋生物幼体的优质开口饵料[38],其繁殖能力的降低可能会缩小种群规模,群落结构发生改变,进而影响海洋生态系统功能。
4 结语
Phe对日本虎斑猛水蚤幼体的96 h LC50为3.675 mg/L。Phe的短期暴露降低了日本虎斑猛水蚤的摄食率、滤水率与呼吸率,导致能量摄入减少,进而造成比生长速率降低和发育周期延长;Phe长期暴露会导致日本虎斑猛水蚤挂卵率降低,总持续产幼数减少,卵囊发育时间延长,甚至在最高浓度组无挂卵,繁殖能力受到严重损伤。
