miR-430对斑马鱼原始生殖细胞迁移和性腺发育影响的初步研究❋
2022-02-24林小涵金超凡张全启
林小涵, 金超凡, 高 晨, 汪 波❋❋, 贺 艳,2, 齐 洁,2, 张全启,2
(1. 中国海洋大学海洋生物遗传学与育种教育部重点实验室, 山东 青岛 266003;2. 青岛海洋科学与技术试点国家实验室 海洋渔业科学与食物产出过程功能实验室, 山东 青岛 266237)
生殖细胞是多细胞生物体内能繁殖后代的细胞的总称,包括PGCs及其分化后形成的生殖细胞。PGCs通过有丝分裂产生,随后迁移至原始性腺形成的区域,也就是生殖嵴,通过进一步的分化形成精原细胞或卵原细胞,最终分化生成成熟的卵子和精子。
miRNA是内源性的非编码小RNA,含有18~25个核苷酸,以序列特异性的方式参与转录后基因的表达调控,通过识别和招募蛋白复合物结合到靶基因的 3′UTR来抑制翻译或影响mRNA稳定性,在细胞增殖、分化以及器官发育等多种生物学过程中发挥关键作用[1]。其保守的种子区由5′端的第2~7位核苷酸组成,是靶向配对过程中的决定因子[2]。单个miRNA可以结合多个靶mRNA,因此每个miRNA均可以参与并调节多种生物学过程[3]。
miRNAs在生殖细胞发育过程中扮演着十分重要的角色,主要参与PGCs的分化、生殖细胞的维持及发育过程,这在之前的研究中已经得到了广泛的证明。在果蝇PGCs迁移分化过程中,miR-6和miR-9能够影响vasa和nanos的表达,这些基因都是关键的生殖质组分[4]。在生殖细胞的维持及分化过程中,miRNA同样发挥着十分重要的功能。例如在生殖干细胞自我更新时,miRNA在有丝分裂的G1期向S期转换的过程中,通过抑制细胞周期抑制因子dap来促进生殖干细胞的有丝分裂进程,进而促进生殖干细胞的自我更新[5]。此外,果蝇中的miR-184可以调控sax受体表达,进而影响雌性生殖细胞的发育和分化过程[6]。在小鼠中,miR-122a主要在晚期雄性生殖细胞中表达,抑制精子发生过程中特异性表达的mRNA。
尽管miRNAs的功能得到了广泛的证实,但是在鱼类中的研究还较少,大部分都在斑马鱼和青鳉等模式生物中进行[7-9]。miR-430家族最初是在硬骨鱼中被发现和鉴定,该家族在脊椎动物中高度保守,与其他脊椎动物miRNAs在进化上密切相关。在斑马鱼中,miR-430家族在受精卵中合子基因转录开始时表达,是合子基因组中最早转录且转录水平最高的基因簇之一[10],能直接调控数百个靶基因。其中,大多数靶基因是母源基因,在缺失miR-430的情况下会在细胞中积累[11]。在斑马鱼胚胎发育的过程中,miR-430参与维持PGCs特异性表达基因的调控。例如,miR-430可靶向体细胞中的nanos和tdrd7基因,降低它们mRNA的稳定性并且抑制其翻译,从而维持它们在PGCs生殖质中的特异性表达和分布[8]。此外,miR-430还影响趋化因子sdf1a和cxcr7b的表达,通过降解原表达域内的sdf1amRNA来调节其表达量和分布范围,同时调节cxcr7b的表达水平以避免sdf1a过度消耗,确保PGCs的准确迁移[12]。但是斑马鱼PGCs迁移到生殖嵴之后,在其向成熟的生殖细胞分化以及性腺发育的过程中,miR-430的功能还未得到探究。
本研究以斑马鱼为实验对象,通过上调miR-430的表达探究其对斑马鱼PGCs的形成、迁移、生殖细胞发育以及性腺发育的影响。研究发现过表达miR-430会导致斑马鱼PGCs迁移紊乱,并且造成nanos3等生殖细胞标记基因mRNA表达量的显著下调。通过组织学观察发现过表达miR-430会造成卵母细胞发育异常,卵巢发育迟缓,但不影响斑马鱼的性别分化以及精巢的发育。
1 材料方法
1.1 材料
本实验所用斑马鱼包括野生型AB品系以及CZ18品系,均购买于国家斑马鱼资源中心。其中CZ18品系为kop:EGFP-UTR-nanos3转基因斑马鱼,其PGCs可特异性表达绿色荧光蛋白(EGFP)。成鱼饲养在自动水循环系统中,水温控制在28 ℃,光周期为14 h光照/10 h黑暗,喂食卤虫或鱼饲料(每天3~4次)。斑马鱼受精卵放置于斑马鱼胚胎培养液中,在28 ℃恒温条件下孵育,孵化后在静水中饲养一个月,而后转移至水循环系统中喂养。
1.2 方法
1.2.1 显微注射和荧光检测 miR-430 mimic (5′-UAUUGCACUUGUCCCGGCCUGU-3′)和Control miRNA (5′-UAACACGUCUAUACGCCCA-3′)由上海吉玛制药技术有限公司合成;LNA-430 (5′-ACAGGCCGGGACAAUGCAAUA-3′)由EXIQON公司合成,其与miR-430有较高的结合亲和力,用于抑制miR-430的功能。在斑马鱼胚胎1细胞时期进行显微注射,其中miR-430 mimic和LNA-430的注射浓度均为5 μmol/L。
使用尼康SMZ1500体视显微镜在胚胎不同发育阶段观察和跟踪PGCs的形成以及定位。
1.2.2 实时荧光定量PCR 在受精后12 h收集30枚AB品系斑马鱼胚胎,每个处理重复取样3次,用PBS清洗后转移至RNA wait中,4 ℃保存。按照说明书用TRIzol法提取斑马鱼胚胎RNA,使用g-eraser反转试剂盒(宝生物工程有限公司)合成cDNA。
用Primer5设计定量引物,选择β-actin作为内参基因,本研究所用引物详见表1。使用宝生物工程有限公司的2xSYBR Green PCR Master Mix试剂和罗氏Lightcycler 480 PCR仪进行实时荧光定量PCR扩增。采用2-ΔΔCt法计算基因的拷贝数,用SPSS 2.0进行显著性分析。

表1 本研究所用引物
1.2.3 报告载体构建 从NCBI数据库获取nanos3的基因序列,设计带有酶切位点的引物扩增nanos3的3′UTR区域,将其克隆至pMD-19T载体,验证序列正确性后,用XhoⅠ和HindⅢ酶对nanos33′UTR和EGFP-N1质粒进行双酶切,连接、转化后测序获得EGFP-nanos33′UTR报告载体。用XhoⅠ酶线性化报告载体后,按照Message Machine SP6试剂盒(赛默飞公司)的指示在体外合成mRNA。
1.2.4组织切片 为检测过表达miR-430对斑马鱼性腺发育的影响,分别在30、60和100时取斑马鱼性腺样品,每个处理组随机取30尾斑马鱼样品。放在4%多聚甲醛中过夜保存,随后梯度甲醇脱水,-20 ℃保存。将样品切成2~3 mm3的小块,经脱水、透明后进行石蜡包埋,使用徕卡RM2016切片机切片,分别在60和37 ℃条件下展片和烘片,在脱蜡、脱水后进行切片染色和封片。使用尼康AZ100荧光显微镜观察不同发育时期的斑马鱼性腺切片结果。
2 结果
2.1 过表达miR-430影响PGCs迁移
为检验合成的miR-430能否影响PGCs的形成及迁移,本文作者将miR-430 mimic注射到CZ18品系斑马鱼的1细胞时期的胚胎中,使用荧光显微镜检测PGCs的形成和迁移情况。检测结果表明miR-430不影响PGCs的正常形成,但在原肠晚期发现过表达miR-430的胚胎中PGCs的迁移发生紊乱,多数PGCs分散成单个细胞进行迁移运动(见图1a’),而对照组胚胎中的PGCs以体轴为中心聚集成两簇进行迁移(见图1e’)。在胚胎发育至受精后20 h时,miR-430过表达的胚胎中PGCs的排列更为分散,排成一列向生殖嵴迁移(见图1b’)。在受精后24 h时,对照组中PGCs簇已经迁移至生殖嵴附近(见图1g’),而过表达miR-430的胚胎中部分PGCs迁移至卵黄延伸部的尾端,定位在生殖嵴以外的区域(见图1c’)。受精后36 h时PGCs迁移已经结束,对照组中PGCs聚集在生殖嵴区域(见图1h’),相较于对照PGCs的紧密分布,过表达组胚胎中PGCs排列松散,并且部分PGCs定位在卵黄延伸部的尾端(见图1d’)。本文作者还对PGCs的迁移情况进行了统计分析(见图1B),结果表明过表达组中有86%的胚胎出现PGCs迁移紊乱的表型,显著高于对照组。

(A. 注射miR-430 mimic和Control miRNA的胚胎中PGCs的迁移情况。a~d分别为受精后9、20、24和36 h miR-430 mimic注射组胚胎(白光);a’~d’分别为受精后9、20、24和36 h miR-430 mimic注射组胚胎(荧光);e~h分别为受精后9、20、24和36 h对照组胚胎(白光);e’~h’分别为受精后9、20、24和36 h对照组胚胎(荧光)。箭头指示迁移中的PGCs。B. 注射miR-430 mimic和Control miRNA后表型统计,每组处理分别统计了200枚胚胎。数据代表平均值±误差; 表示p < 0.01。A. PGCs migration in embryos injected with Control miRNA and miR-430 mimic. a~d: Embryos from miR-430 mimic injected group at 9, 20, 24 and 36 h post fertilization (white light); a’~d’: Embryos from miR-430 mimic injected group at 9, 20, 24 and 36 h post fertilization (fluorescent light); e~h: Embryos from control group at 9, 20, 24 and 36 h post fertilization (white light); e’~h’: Embryos from control group at 9, 20, 24 and 36 h post fertilization (fluorescent light). Arrows indicate PGCs in migration. B. Phenotype statistics after injection of Control miRNA and miR-430 mimic, 200 embryos were examined for each group. The data represent the mean ±SD (error bars); indicates p<0.01.)
随后,通过实时荧光定量PCR检测了过表达miR-430对生殖细胞特异性表达基因nanos3、piwil2和tdrd7的影响。实验结果如图2所示,在PGCs迁移的关键时期,miR-430的过表达会引起内源nanos3、piwil2和tdrd7mRNA表达水平的显著下调。在确定miR-430影响靶基因的表达后,通过将LNA-430、miR-430 mimic和Control miRNA分别与体外合成的EGFP-nanos33′UTR混合后共注射斑马鱼受精卵,进一步探究了过表达和抑制miR-430的表达对其靶基因nanos3表达和分布的影响。在受精后36 h时,荧光检测发现对照中绿色荧光蛋白可以在生殖细胞中表达,并且生殖细胞簇定位在生殖嵴(见图3C、C’)。在注射LNA-430的处理组中(见图3A、A’),观察到斑马鱼全身荧光相对于对照组增强,并且无法准确辨认被标记的PGCs。在共同注射EGFP-nanos33′UTR和miR-430 mimic组中(见图3B、B’),斑马鱼体内的绿色荧光明显弱于以上两个处理组,并且发现PGCs迁移紊乱,部分PGCs定位于生殖嵴以外的区域。

(数据代表平均值±SD(误差棒);表示p<0.01。The data represent the mean ±SD (error bars); indicates p<0.01.)

(A和A’代表共注射LNA-430和EGFP-nanos3 3′UTR的斑马鱼;B和B’代表共注射miR-430 mimic和EGFP-nanos3 3′UTR的斑马鱼;C和C’代表共注射Control miRNA和EGFP-nanos3 3′UTR的斑马鱼。箭头指示PGCs的定位。A and A’ represent zebrafish injected with LNA-430 and EGFP-nanos3 3’UTR; B and B’ represent zebrafish injected with miR-430 mimic and EGFP-nanos3 3’UTR; C and C’ represent zebrafish injected with Control miRNA and EGFP-nanos3 3’UTR. Arrows demonstrate the location of PGCs.)
2.2 miR-430对性腺发育和性别分化的影响
为了进一步探究miR-430对斑马鱼性腺发育的影响,向AB品系斑马鱼受精卵中注射miR-430 mimic,制备受精后第30、60和100天的性腺组织切片并进行观察分析(见图4A、B)。受精后第30天的对照组和实验组切片结果表明,斑马鱼性腺发育正常,此时性腺未出现明显的雄鱼特征,均表现为雌性特征。卵母细胞处于初级生长期,卵母细胞发育正常,和对照相比没有明显区别。对2月龄斑马鱼性腺组织切片的观察发现,在注射miR-430的斑马鱼中,雄鱼性腺和对照组并无区别;对照组的卵母细胞处于从初级生长期向卵黄发生期过渡的阶段,而过表达组的卵巢发育明显滞后,卵母细胞数目少且发育异常,细胞形态不完整。在受精后第100 天时,斑马鱼已经性成熟,精巢中有大量精细胞形成,同时可以观察到精原细胞和精母细胞;此时卵母细胞进入成熟期,卵黄颗粒基本充满卵母细胞,而过表达miR-430组的卵母细胞发育略有滞后,其内部的卵黄颗粒数目明显少于对照组卵黄颗粒数目。
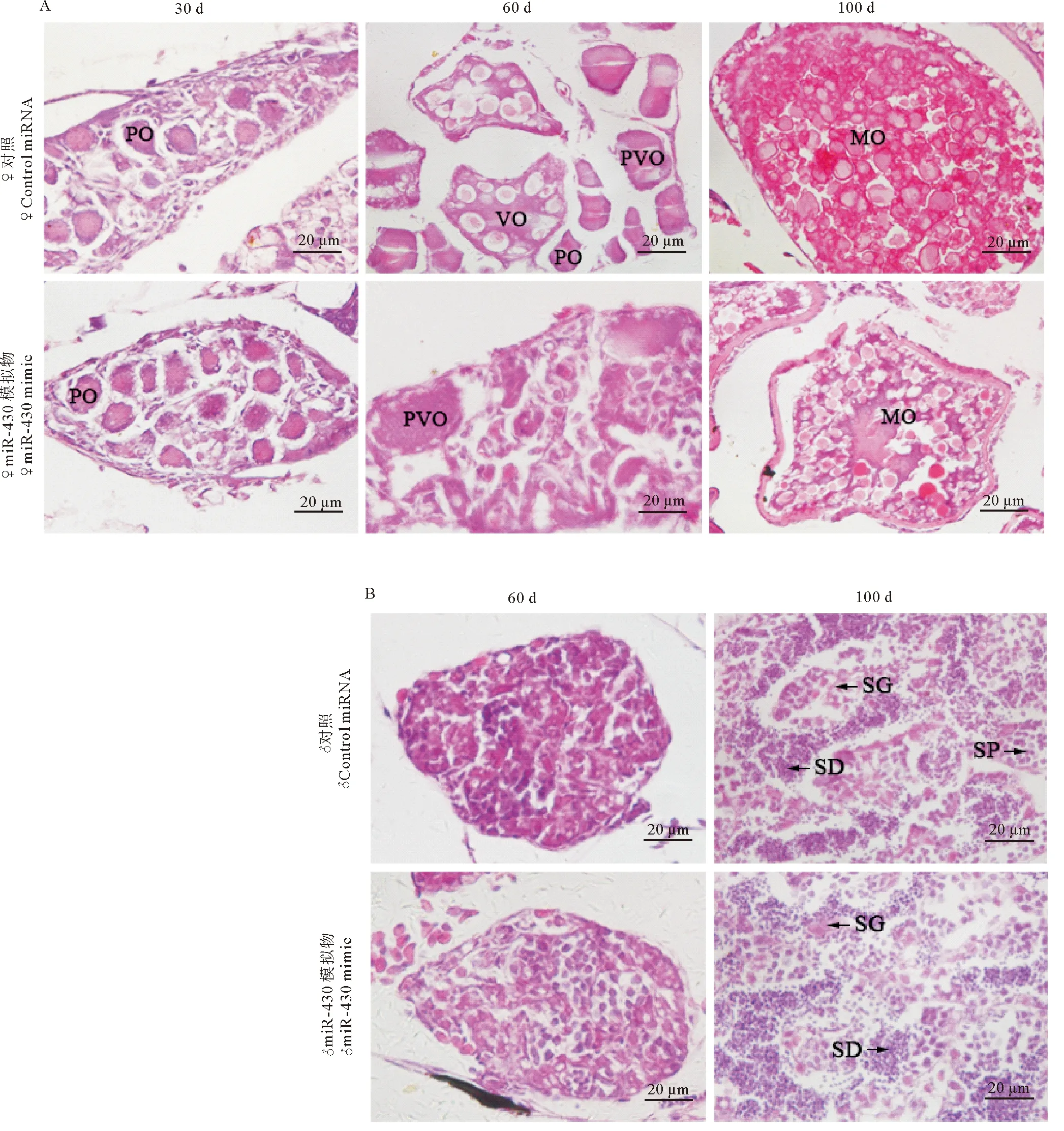
(A. 受精后第30、60和100天对照组和miR-430 mimic注射组斑马鱼的卵巢切片;B. 受精后第60和100天对照组和miR-430 mimic注射组斑马鱼的精巢切片。PO为初级生长期卵母细胞,PVO为卵黄发生前卵母细胞,VO为卵黄发生期卵母细胞,MO为成熟卵母细胞,SG为精原细胞,SP为精母细胞,SD为精细胞。标尺均为20 μm。A. Ovarial histology examination of zebrafish from control group and miR-430 mimic injected group at 30, 60, and 100 d post fertilization; B. Spermatic histology examination of zebrafish from control group and miR-430 mimic group at 60, and 100 d post fertilization. PO, primary-growth oocyte; PVO, previtellogenic oocyte; VO, vitellogenic oocyte; MO, mature oocyte; SG, spermatogonia; SP, spermatocyte; SD, spermatid. Scale bar=20 μm.)
另外,在受精后第100 天时对斑马鱼性腺的大小进行了进一步分析测定,解剖观察结果如图5所示,注射miR-430组雄鱼的精巢和对照组雄鱼的精巢形态与大小不存在明显差异;而注射miR-430的雌鱼的卵巢明显发育不良、体积偏小,约为对照组卵巢体积的二分之一。

图5 受精后100 d的斑马鱼性腺
在出生后第100天,已经可以通过表观特征群区分斑马鱼的雌雄,雄鱼的胸鳍表面存在锯齿状突起(见图6A),雌鱼的胸鳍表面光滑(见图6B)。在显微镜下观察斑马鱼胸鳍鉴定雌雄比例,发现miR-430注射组雄鱼胸鳍表面锯齿状突起较少(见图6C)且没有对照组明显。统计结果显示:miR-430注射组23.5%雄鱼,76.5%雌鱼;对照组24.0%雄鱼,76.0%雌鱼,表明斑马鱼的性别分化不受miR-430的影响。
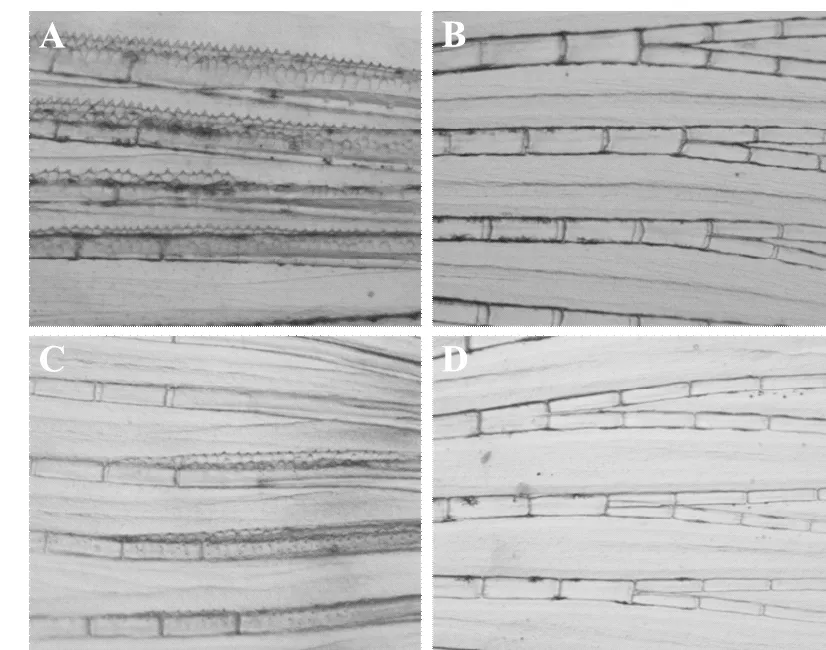
(A和B分别代表对照组雄性和雌性斑马鱼胸鳍;C和D分别代表miR-430过表达组雄性和雌性斑马鱼胸鳍。A and B: Pectoral fins of male and female zebrafish in the control group; C and D: Pectoral fins of male and female zebrafish in the miR-430 overexpression group.)
3 讨论
在本研究中,发现miR-430的过表达会引起斑马鱼PGCs迁移的紊乱,致使部分PGCs无法正常迁移至生殖嵴,并且导致nanos3等PGCs特异性表达基因mRNA水平降低。在生殖细胞发育过程中,上调miR-430可以抑制卵母细胞的发育,并且造成卵巢发育迟缓,但是对斑马鱼精巢发育及性别分化没有明显影响。
miR-430此前已被证明在PGCs迁移中发挥关键作用,miR-430及其哺乳动物同源基因miR-302均可拯救miRNAs缺失突变体中的PGCs异位表型,miR-430能够通过调节趋化因子sdf1a和cxcr7bmRNA的表达确保PGCs的准确迁移[12]。本研究通过注射miR-430 mimic在斑马鱼胚胎中过表达miR-430,同样发现PGCs的定位出现异常,从另一个角度探究了miR-430对PGCs迁移的影响。在斑马鱼中,PGCs的形成由生殖质这种特殊的母源性细胞质决定[13],一些母源mRNA,如dnd、vasa和nanos3等定位于生殖质中,这些mRNA随着胚胎发育被整合进入体细胞和PGCs。miR-430在受精卵中合子基因转录开始时就大量表达[7],由于受到miR-430介导的mRNA去烯化、mRNA降解和翻译抑制,部分生殖质基因在体细胞中会被迅速降解。在PGCs中,其靶mRNA也受到miR-430的调控[11],但nanos3和tdrd7mRNA 3′UTR中的顺式作用元件能补偿miR-430介导的抑制作用,使这些mRNA能在PGCs中稳定存在。此外,近些年的研究发现,一些生殖系特异性RNA结合蛋白也在维持生殖质基因的特殊表达模式中发挥重要作用。其中,dnd1可以通过结合mRNA以及阻止miRNAs与靶位点的相互作用,来抵消斑马鱼PGCs中miR-430等miRNAs的功能[14];DAZL能与tdrd7结合,通过诱导poly (A)尾部的伸长(聚腺苷酸化)来缓解miR-430介导的对tdrd7mRNA的抑制[15]。这些机制共同作用,保证了nanos3和tdrd7等基因在PGCs中的稳定表达和功能发挥。在本研究中,miR-430的过表达会进一步加剧其对体细胞中靶mRNA的抑制作用,并且超出了PGCs中nanos3和tdrd7等基因的顺式作用元件以及DAZL和dnd等保护机制对miR-430介导的降解的补偿范围,进而导致这些生殖质基因在PGCs中表达量减少。
斑马鱼中已有的研究显示nanos3的正常表达对于PGCs的迁移和存活至关重要,敲降nanos3会造成部分PGCs的错误定位[16]。本研究结果证明过表达miR-430可导致内源nanos3表达的下调以及外源nanos33′UTR的分布和定位变化,和已有的研究结果是一致的。表明miR-430可以通过调控PGCs中nanos3等生殖质基因的表达,参与调节PGCs的迁移运动。
鱼类的卵泡发育和卵母细胞成熟受下丘脑、垂体和卵巢产生的激素控制[17],卵母细胞的成熟是在卵泡刺激素(LH)、成熟诱导激素(MIH)和成熟促进因子(MPF)三种主要调节因子的控制下发生的[18]。近些年来,多项研究证明有多种miRNAs通过转录后调控在硬骨鱼类的卵母细胞发育、成熟以及卵子发生等过程中发挥作用。青鳉miR-202在卵子发生/卵泡发生中的起到关键作用,敲除miR-202导致早期卵泡发育受损,卵子数量减少[19]。斑马鱼23号染色体上的miRNA-200簇是卵母细胞成熟和排卵所必需的[20]。已有研究在斑马鱼卵泡细胞中检测到了miR-430b,认为miR-430b可能参与调控斑马鱼卵母细胞的成熟[21]。
斑马鱼的性腺发育一般从出生后第30天开始,在性别分化之前,所有性腺均发育为卵巢;在出生后第40~50天期间,性腺开始分化;当发育到第60天时,性腺分化结束,卵巢和精巢形成。已有的研究表明,足够数量的早期生殖细胞对雌性斑马鱼的性发育至关重要,斑马鱼早期胚胎中生殖细胞的缺失,会导致斑马鱼发育为雄性[22]。本研究结果表明,过表达miR-430会影响斑马鱼卵母细胞的正常发育,并导致卵巢发育迟缓,但不影响斑马鱼的性别分化。由于PGCs在迁移到生殖嵴后能与体细胞共同形成原始性腺,并最终增殖分化形成两性配子,PGCs的正常迁移和准确定位是其功能发挥的前提条件。因此,本文作者推测过表达miR-430导致部分PGCs不能正常迁移至生殖嵴,造成定位于生殖嵴的PGCs数目减少,进而影响了后续卵巢的正常发育。
综上所述,本研究对miR-430在斑马鱼生殖细胞发育中的功能进行了初步探究。证明过表达miR-430会造成PGCs迁移紊乱,miR-430可能通过影响PGCs中nanos3、piwil2和tdrd7等生殖质基因的表达及定位,在PGCs迁移过程中发挥关键作用。另外,在胚胎发育早期上调miR-430还会将会影响性腺分化时期卵母细胞的正常发育,导致卵巢发育迟缓。上述结果为后续研究miR-430在PGCs迁移和生殖细胞发育中的分子调控奠定了基础。
