大西洋鲑幼鱼适宜投喂频率和胃排空研究❋
2022-02-24邓乾龙董双林高勤峰
邓乾龙, 王 文, 董双林,2, 高勤峰,2❋❋
(1.海水养殖教育部重点实验室(中国海洋大学), 山东 青岛 266003;2.青岛海洋科学与技术试点国家实验室 海洋渔业科学与食物产出过程功能实验室, 山东 青岛 266237)
在水产养殖业,养殖效率很大程度上取决于投喂策略[1-2],投喂频率是投喂策略中的重要参数[3-4]。投喂频率显著影响鱼类对饲料的消化、吸收和利用效率,进而影响鱼类的生长[4-5],适宜的投喂频率能提高饲料转化率,促进鱼类生长,缩小个体间生长差异。过高的投喂频率会缩短饲料在鱼体消化道内的停留时间,饲料得不到充分的消化吸收[6]。不合理的投喂频率甚至会对养殖鱼类造成胁迫[5,7]。鱼类的胃排空率或胃排空时间是表征鱼类摄食量、摄食频率的重要参数[8-9],明确鱼类胃排空规律能为养殖投喂管理提供可靠的依据[10-12]。
大西洋鲑(Salmosalar)隶属于鲑形目(Salmonniformes)鲑科(Salmonoidea)鲑属(Salmo),是典型的冷水性鱼类。因其肉质鲜美、富含优质蛋白质和多不饱和脂肪酸(EPA、DHA等),在中国占有巨大的消费市场。黄海冷水团鲑鳟鱼绿色养殖的技术路线已得到验证[13],中国大西洋鲑养殖前景广阔。一些研究表明,投喂2次/天以上对大西洋鲑的生长、饲料系数无显著影响[14-15],也有学者认为过高的投喂频率会缩短饲料在大西洋鲑消化道内的驻留时间,降低饲料利用率[16]。目前暂未见小规格大西洋鲑的胃排空研究和投喂研究。本研究以大西洋鲑幼鱼为研究对象,探究大西洋鲑幼鱼在不同投喂频率下的摄食节律和生长性能的变化,并与胃排空实验相结合,以期为大西洋鲑投喂策略的优化提供依据。
1 材料与方法
1.1 实验材料
实验于2019年9月至12月在山东省烟台市黄海水产有限公司进行。将圆形玻璃缸(半径120 cm;高65 cm;容积2.0 m3)分隔成容积相等的围隔(500 L)作为养殖单元。大西洋鲑幼鱼购买于山东省东方海洋科技股份有限公司牟平分公司,于淡水中养殖1周后参考Xiong等[17]方法进行盐度驯化。暂养驯化期间,每天饱食投喂2次(6:30和18:30)。暂养和实验期间均采用3 mm膨化颗粒饲料(粗蛋白≥45%、粗脂肪≥20%、粗纤维≤3%、粗灰分≤8%、水分≤8.5%、总磷≤1.5%、钙≥0.8%),单颗饲料质量为0.026 g。
1.2 实验设计
1.2.1 投喂频率实验 挑选体质健壮、生长状况良好的大西洋鲑((107.6±9.1) g)225尾,随机分配至15个围隔内。设置5个投喂频率,分别为1次/天(F1组)、2次/天(F2组)、3次/天(F3组)、4次/天(F4组)和连续投喂(CF组),每个处理组3个重复。连续投喂组采用自动投饵机投喂,每90 s投喂一次,投喂持续时间为12 h,日投喂量为鱼体质量的2%。其余处理组为人工投喂至饱食状态,即单颗饲料沉入水中1 min内没有鱼摄食[6],结束投喂,投喂时间设置见表1。连续投喂组每天12:30和18:30清除粪便并收集残饵以计算实际摄食量,其余处理组每次投喂结束后捞出残饵以计算摄食量,并于2 h后清除粪便。每14天所有鱼停食称重一次,调整连续投喂组的投喂量。实验期间,记录死亡鱼的数量,环境指标如下:水温(15.5±0.5) ℃,溶氧>7.0 mg/L,盐度32~34,光周期14 L∶10 D(6:30—20:30),日换水率≥100%。实验周期48 d。

表1 投喂时间设置
1.2.2 胃排空实验 将大西洋鲑幼鱼暂养2周,每天6:30饱食投喂1次。实验前饥饿2 d使其消化道排空,挑选160尾体表健康、生长状况良好的实验鱼((204.1±16.4) g),取150尾随机分配至3个围隔(同投喂频率实验的围隔一致),每个围隔作为一个重复,剩下10尾鱼用于投喂前确定消化道排空程度并校准投喂后的摄食总量。实验开始,6:30对大西洋鲑饱食投喂一次,于投喂后的0.5、2、4、6、8、12、16、21.5、24、28、32、36、40和48 h取胃含物分析。实验期间所有条件与投喂频率实验保持一致。
1.3 样品采集与分析
1.3.1 投喂频率实验 实验结束前停食24 h,所有鱼用MS-222溶液(200 mg/L)麻醉后测量体质量和体长。生长相关指标包括每日单次摄食率(Single meal size, SMS,%·d-1)、日摄食率(Daily feed intake,DFI,%·d-1)、增重率(Weight gain rate,WGR,%)、特定生长率(Specific growth rate,SGR,%·d-1)、饲料系数(Feed conversion ratio,FCR,%)、肥满度(Condition factor,K,%)、体质量变异系数(Coefficient of variation,CV,%)和存活率(Survival rate,SUR,%),计算如下:
每日单次摄食率(SMS,%·d-1)=100×(TSFI/((IBM+FBW)/2))/d;
日摄食率(DFI,%·d-1)=100×(TFI/((IBM+FBW)/2))/d;
增重率(WGR)=(FBW-IBW)/IBW×100%;
特定生长率(SGR)=(ln(FBW)-ln(IBW))/d×100%;
饲料系数(FCR)=TFI/(FBW-IBW);
肥满度(K)=FBW/FBL3×100%;
体质量变异系数(CV)=SD/FBW×100%;
存活率(SUR)=Nt/N0×100%。
式中:FBW为末体质量(g);IBW为初始体质量(g);TSFI为每个时间点总摄食量(g);TFI为实验周期总摄食量(g);d为实验天数(d);FBL为末体长(叉长,cm);SD为末体质量标准差;N0和Nt分别为初始总尾数和终末总尾数。
1.3.2 胃排空实验 每次采样从每个围隔随机捞出3尾鱼,用MS-222溶液(200 mg/L)麻醉后称重,取出胃含物称量湿质量,105 ℃烘干后称量干质量(精确到0.01 g)。每个采样点在每个围隔所取胃含物质量的平均值作为该时刻每个重复的胃含物质量。采用3种最常用的数学模型即线性、指数和平方根模型[18]对胃含物湿质量和干质量数据进行拟合,对比拟合的相关系数平方值(R2) 、残差标准差(SDR)和残差平方和(RSS)选择最佳胃排空模型。 三种数学模型表达式如下:
线性模型:Y=A-B×t;
平方根模型:Y0.5=A-B×t;
指数模型:Y=A×e-B×t。
式中:Y为胃含物相对质量(g),即每100 g鱼体质量对应的胃含物质量;B为胃排空率(g/h);t为摄食后经历的时间(h),A为常数。
1.4 统计分析
采用SPSS Statistics 24软件对数据进行处理及分析。对投喂频率实验数据先进行正态性检验和方差齐性检验,满足正态分布和方差齐性后进行单因素方差分析(One-Way ANOVA),多重比较采用新复极差法(Duncan’s multiple range test),显著水平P=0.05,数据均采用平均值±标准差(Mean±SD)表示。对胃排空数据进行回归分析,得到相关参数,数据绘图采用GraphPad Prism 8。
2 结果
2.1 不同投喂频率下大西洋鲑幼鱼摄食情况
大西洋鲑幼鱼在不同投喂频率下的每日单次摄食率见图1(A)。投喂频率由1次/天增加至4次/天,大西洋鲑幼鱼每日单次摄食率降低,F1至F3组每日单次摄食率显著降低(P<0.05)。 F2、F3和F4各组内每日单次摄食率均无显著差异。大西洋鲑幼鱼在不同投喂频率下每日单次摄食率占日摄食率的百分比见表2。F2组每日两次摄食率分别占日摄食率的49.90%±1.42%和50.10%±1.42%,F3组每日三次摄食率分别占日摄食率的35.33%±2.45%、34.72%±2.99%和29.95%±1.66%,F4组每日四次摄食率分别占日摄食率的28.11%±3.36%、24.88%±6.47%、25.49%±0.99%和21.52%±3.76%。大西洋鲑幼鱼在不同投喂频率下的日摄食率见图1(B),F1组日摄食率显著低于其余处理组(P<0.05),CF组日摄食率显著低于F3组和F4组(P<0.05),而与F2组无显著差异。F2、F3和F4组日摄食率无显著差异。
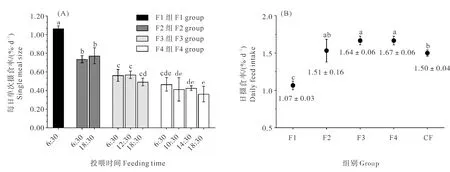
图1 大西洋鲑幼鱼在不同投喂频率下的每日单次摄食率(A)和日摄食率(B)

表2 大西洋鲑幼鱼在不同投喂频率下的每日单次摄食率占日摄食率的百分比
2.2 不同投喂频率下大西洋鲑幼鱼生长情况
大西洋鲑幼鱼在不同投喂频率下生长指标见表3。投喂频率显著影响大西洋鲑幼鱼的总摄食量、末体质量、末体长、增重率、特定生长率、饲料系数、存活率、肥满度和体质量变异系数(P<0.05)。F1组总摄食量显著低于其余处理组(P<0.05),CF组总摄食量显著低于F3和F4组(P<0.05),F2、F3和F4组无显著差异。F1和CF组末体质量、增重率、特定生长率显著低于F2、F3和F4组(P<0.05),而F2、F3和F4组无显著差异。F1、F2、F3和F4组饲料系数无显著差异而显著低于CF组(P<0.05)。F1组末体长显著低于其余处理组(P<0.05)。F1和CF组肥满度无显著差异而显著低于F2、F3和F4组(P<0.05)。所有处理组中,仅CF组出现少量死亡,存活率为95.55%±3.85%。CF组体质量变异系数显著高于F2、F3和F4组(P<0.05),F1、F2、F3和F4组体质量变异系数无显著差异。

表3 不同投喂频率下大西洋鲑幼鱼的生长性能
2.3 大西洋鲑幼鱼胃排空模型分析
大西洋鲑幼鱼摄食后胃含物质量随时间的变化见图2。摄食后胃含物湿质量先上升后下降,4~16 h迅速下降,16 h后下降缓慢。摄食后胃含物干质量持续下降,16 h内迅速下降,24 h基本排空。三种数学模型对胃含物质量的拟合结果见表4,胃排空拟合曲线见图3。通过对比R2、SDR和RSS,指数模型和平方根模型具有较高的R2,线性模型的R2最低(R<0.800)、SDR和RSS最高。相比于胃含物湿质量,三种模型对胃含物干质量的拟合度更高。用平方根模型对胃含物干质量数据拟合效果最好(Y0.5=1.686-0.051x,R2=0.887,P<0.001)。

表4 三种胃排空模型对胃含物数据的拟合结果

图2 大西洋鲑幼鱼胃含物变化
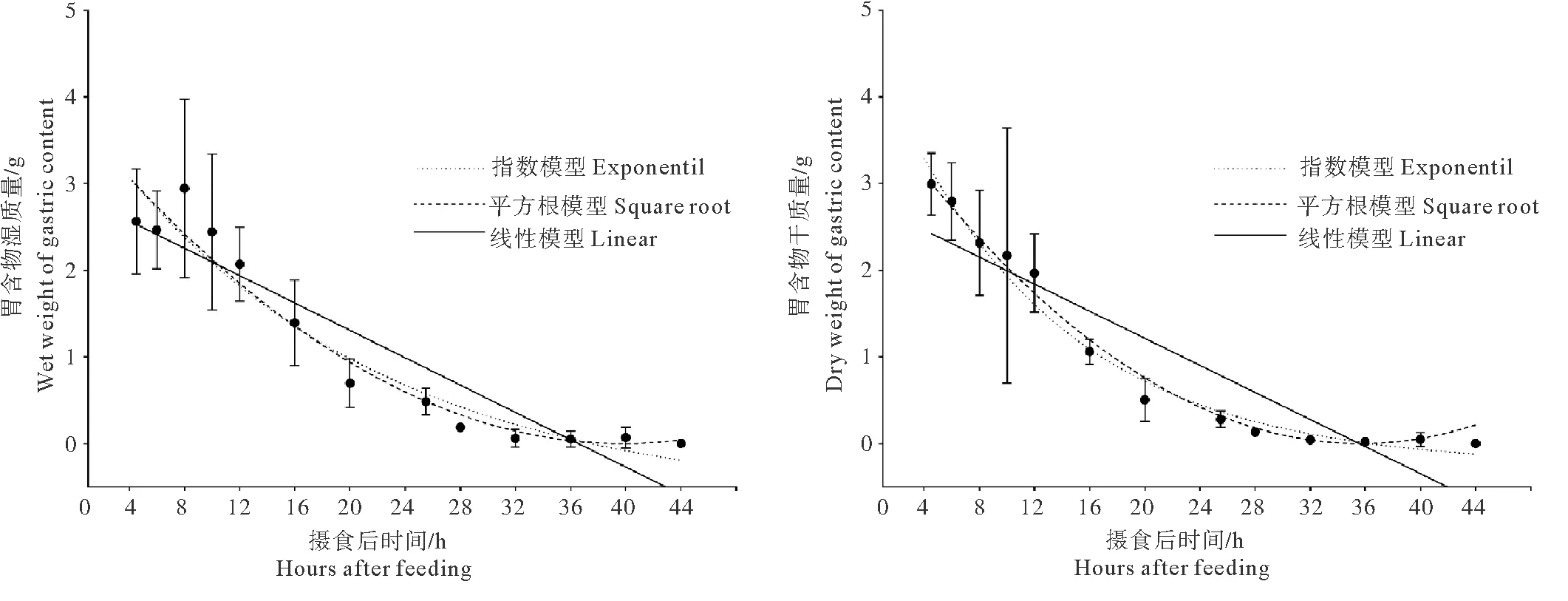
图3 大西洋鲑幼鱼胃排空曲线
投喂频率实验中,大西洋鲑幼鱼在投喂频率为4次/天(间隔4 h)、3次/天(间隔6 h)、2次/天(间隔12 h)和1次/天(间隔24 h)对应的单次摄食率分别占日摄食率的21.52%~28.11%、29.95%~35.33%、49.90%~50.10%和100.00%,与平方根模型(Y0.5=1.686-0.051x)计算出的胃排空结果较为一致(见表5)。

表5 大西洋鲑幼鱼在不同投喂间隔下的胃排空和单次摄食率占日摄食率的百分比
3 讨论
3.1 投喂频率对大西洋鲑幼鱼摄食的影响
明确养殖鱼类的摄食规律有助于建立精准的投喂策略,减少饲料浪费的同时保证鱼的生长[4,19]。本实验中,从F1到F2组,大西洋鲑幼鱼的总摄食量和日摄食率显著提高,但从F2到F4组,大西洋鲑幼鱼的总摄食量和日摄食率不再显著提高,这与刘淑兰等[16]和Wang等[19]研究结果一致。说明投喂频率达到2次/天以上,大西洋鲑幼鱼能摄入足够的饲料,继续增加投喂频率不再影响摄食量。
F2、F3和F4各组内大西洋鲑幼鱼每日单次摄食率无显著差异,即没有明显的日摄食高峰。有研究报道网箱养殖的大西洋鲑在早晨摄食最多[20-23],摄食量占日摄食总量的40%~70%。这可能与光照条件有关,在自然条件下,大西洋鲑的摄食窗口期主要集中在光照强度增强或减弱过程中[11],而本实验采用固定的光照强度和光照时间,大西洋鲑幼鱼可能因此表现出较稳定的日摄食节律,与大西洋黄盖鲽(Limandaferruginea)[24]的研究结果一致。
3.2 投喂频率对大西洋鲑幼鱼生长的影响
投喂频率对鱼类生长的改善主要通过提高鱼的摄食量[4]或饲料利用率[25]来实现。本研究发现,F2、F3和F4组大西洋鲑幼鱼总摄食量和日摄食率显著高于F1组(P<0.05),末体质量、增重率和特定生长率也显著高于F1组(P<0.05),说明随着投喂频率的提高,大西洋鲑幼鱼的摄食量增加,生长性能得到提高。在饲料转化方面,F1、F2、F3和F4组饲料系数均较低且无显著差异(1.10~1.14),表明在本实验条件下1~4次/天的投喂频率并未影响大西洋鲑幼鱼对饲料的转化,进一步说明投喂频率对大西洋鲑幼鱼生长性能的提高是通过增加其摄食量来实现,相似研究结果也见于杂交太阳鱼(Lepomiscyanellus♀×L.macrochirus♂)[19]、条石鲷(Oplegnathusfasciatus)[26]和不同规格的大西洋鲑[14-15]。
肥满度是衡量动物的生理或营养状况的形态生理指数[27],也是鱼类养殖管理中的重要指标[28]。在大杂交鲟幼鱼(Husodauricus♀×Acipenserschrenckii♂)[29]和杂交鲂幼鱼(MegalobramaterminalisRichard- son ♀×Erythroculterilishaeformis♂)[30]的研究中发现,低投喂频率下,鱼的摄食量不足,肥满度低;随着投喂频率的增加,鱼体肥满度显著提高并保持稳定。本研究也发现低投喂频率组(F1组)肥满度显著低于F2~F4组(P<0.05),同时F1组摄食量也显著低于F2~F4组,表明1次/天的投喂频率不能满足大西洋鲑幼鱼的生长需求,导致幼鱼的肥满度低。在本研究结果中还发现F1组末体长也显著低于F2~F4组(P<0.05),说明1次/天的投喂频率不仅制约了大西洋鲑幼鱼体质量的增长,还影响其体长的增长。
个体生长差异是影响养殖效益的重要因素[31]。研究表明,提高投喂频率可以缩小个体大小差异[19,26,32]。本研究中,F1、F2、F3和F4组体质量变异系数无显著变化,但随着投喂频率的增加大西洋鲑幼鱼体质量变异系数呈下降趋势,F2、F3和F4组体质量变异系数相比于F1组分别降低了19.91%、20.09%和31.21%,可能随着投喂次数的增加,更多劣势个体能摄入足够的食物,从而缩小了个体间生长差异[19,33]。
为评价自动投饵机连续投喂方式在大西洋鲑养殖生产中的使用效果,本实验设置了连续投喂组(CF组)。结果发现,虽然CF组的日投喂量为鱼体质量的2%,但总摄食量和日摄食率显著低于F3和F4组(P<0.05),表明在连续投喂状态下大西洋鲑幼鱼的摄食量并未因投喂时间的延长而进一步提高。因此,CF组末体质量、增重率和特定生长率均显著低于F3和F4组(P<0.05)。虽然CF组总摄食量与F2组无差异,但其末体质量、增重率和特定生长率均显著低于F2组(P<0.05),饲料系数和体质量变异系数显著高于F2组(P<0.05),这可能与投喂方式有关。相比于人工饱食投喂,大西洋鲑幼鱼在低投喂强度下需要更长的时间达到饱食,频繁的摄食活动增加了机体的能量消耗,导致饲料系数显著升高,生长性能下降[34]。虽然CF组末体长与F2、F3和F4组无显著差异,但CF组增重率低,故肥满度显著低于F2、F3和F4组(P<0.05)。所有处理组中,CF组体质量变异系数最高,并出现部分死亡现象,这可能由于大西洋鲑幼鱼在低投喂强度下争食激烈,且群体内的优势个体抑制了劣势个体的摄食,导致群体内个体分化严重[35-36]。综上,低投喂强度连续投喂方式不利于大西洋鲑幼鱼的生长。
3.3 大西洋鲑幼鱼胃排空模型
利用数学模型能准确描述鱼类胃排空过程,指数、线性和平方根模型使用最广泛,但最佳胃排空模型因鱼的规格、食物及环境等因素的变化而异[18]。Jobling[37]的研究表明,指数和平方根模型能准确描述鱼类摄食颗粒饲料后的胃排空过程,而线性模型适合描述鱼类摄食尺寸大、不易消化的食物后的胃排空过程。本实验大西洋鲑幼鱼摄食粒径3 mm的商品饲料,指数和平方根模型都有较高的R2值,但指数模型的SDR和RSS更高,随机误差更大,而平方根模型具有最低的SDR和RSS,拟合效果更好,这与大西洋鲑仔鱼(0.8~11.7 g)[38]、虹鳟(Salmogairdneri)[37]、溪红点鲑(Salvelinusfontinalis)[39]和罗非鱼(Oreochromisniloticus)[40]的最佳胃排空模型一致。鱼在摄食后,胃内饲料的消化需要水的参与,鱼会通过胃分泌和吞饮水分保证饲料的消化[41],采用胃含物湿质量拟合的胃排空模型会产生较大误差。黄铭等[42]研究发现,小规格虹鳟(32.94 g)胃含物水分在0~12 h内持续升高,大规格虹鳟(105.15 g)胃含物湿质量在0~12 h内未明显下降,采用几种胃排空模型对胃含物干质量的拟合度更高。本实验中,大西洋鲑摄食后胃含物湿质量先增加再减少,而胃含物干质量持续减少,平方根模型对胃含物干质量的拟合度最高,这与黄铭等[42]研究结果一致。
4 结语
在投喂频率为2~4次/天时,大西洋鲑幼鱼的日摄食率高并保持稳定,每日单次摄食率随投喂频率的增加而降低,生长和饲料转化保持稳定,个体差异小。故大西洋鲑幼鱼适宜的投喂频率为2~4次/天。在低强度连续投喂方式下,大西洋鲑幼鱼摄食时间长,抢食激烈,且长时间的摄食活动增加机体能量的消耗,导致个体差异大、生长和饲料转化率低。大西洋鲑幼鱼((204.1±16.4) g)胃排空时间为24 h,胃含物的含水量会影响胃排空模型的准确性,进行模型拟合时宜采用胃含物干质量,平方根模型是描述大西洋鲑幼鱼的最佳胃排空模型。
