虎杖化学成分及药理活性研究进展
2022-02-24梁春晓王珊珊陈淑静常艳旭
梁春晓,王珊珊,陈淑静,王 媛,李 晋,常艳旭
虎杖化学成分及药理活性研究进展
梁春晓,王珊珊,陈淑静,王 媛,李 晋,常艳旭*
天津中医药大学 组分中药国家重点实验室,天津 301617
虎杖et在中国已有数千年治疗和预防疾病的历史,可用于改善腹泻、咳嗽、黄疸、炎症、闭经、烧伤和高脂血等症状。虎杖化学成分包括醌类、二苯乙烯类、黄酮类、苯丙素类等化合物。现代药理学和临床研究表明,虎杖可用于治疗炎症、糖尿病、痛风、癌症、病毒性疾病、细菌感染性疾病、神经退行性疾病等,尤其对冠状病毒引起的呼吸性疾病具有良好抑制作用。系统地总结了近几年虎杖的国内外研究文献,从化学成分及其药理作用的角度展开了综述,为虎杖药用资源进一步开发和应用提供依据,也为虎杖在抗击新型冠状病毒肺炎疫情中的应用提供科学依据。
虎杖;蒽醌;二苯乙烯;虎杖苷;黄酮;苯丙素
虎杖为蓼科(Polygonaceae)草本植物虎杖Sieb. et Zucc.的干燥植物根茎和根[1],在全球广泛分布,在亚洲、北美洲都有分布,我国集中分布在江浙、川贵一带[2]。虎杖质地坚硬,口感微苦,具有散瘀、止咳、退黄、利尿等功效。《名医别录》记载道,虎杖味苦性寒,具有清热利湿、退黄散瘀之功效[3-5]。在祖国医学方剂中通常与其他药味按照“君臣佐使”的特点配合使用。虎杖作为君药在虎金颗粒中与郁金香配伍,可用于治疗慢性肝炎及肝硬化[6];作为使药在金欣口服液中与炙麻黄、苦杏仁、黄芩等中药配伍,可治疗小儿呼吸道合胞病毒肺炎[7];作为臣药在芪仙清鸣颗粒中与黄芪、淫羊藿、巴戟天等中药配伍,可治疗支气管哮喘[8]。目前已从虎杖中提取分离得到化合物超过89种,包括蒽醌苷及其苷元、二苯乙烯苷及其苷元等重要活性成分。实验与临床经验表明,虎杖可用于炎症、糖尿病、痛风、癌症、病毒性疾病、细菌感染性疾病、神经退行性疾病的治疗,尤其是对冠状病毒具有良好抑制作用。
面对2019年爆发的全球性蔓延的新型冠状病毒肺炎(corona virus disease 2019,COVID-19),中医药在抗击疫情过程中展现了其独特优势,实现了“一人一方”的精准治疗,对病程各个阶段进行辨证论治。中医认为COVID-19为“疫病”“湿瘟”,针对湿毒郁肺型患者,张伯礼院士在经验方宣肺败毒汤中添加了具有利湿之效的虎杖,极大降低患者复阳。《新型冠状病毒肺炎中医诊疗天津方案》中指出,对于湿蕴肺脾、湿邪困表的普通症,痰热壅肺的重症,内闭外脱的危重症以及恢复期的脾肾亏虚、气虚阴虚症状,推荐处方中均用到虎杖。自从严重急性呼吸综合征冠状病毒(severe acute respiratory syndrome coronavirus,SARS-CoV)发现以来,研究人员已通过体内外实验证实虎杖中多种化合物具有抑制SARS-CoV、中东呼吸综合征冠状病毒(middle east respiratory syndrome coronavirus,MERS-CoV)的作用[9],且利用分子对接技术预测可知,虎杖对与SARS-CoV具有同源相似性的SARS-CoV-2具有抑制作用[10-13]。由此可见,从中医临床经验方剂到计算机模拟都显示虎杖成分具有潜在的抗COVID-19活性,提示虎杖可能是具有治疗COVID-19作用的有效中药。本文从化学成分及药理作用的角度展开综述,为质量标志物的确定与进一步开发利用提供理论支持,也为虎杖在抗击COVID-19疫情中的应用提供科学依据。
1 化学成分
1.1 醌类
蒽醌类化合物含量高,种类多,作用广[16]。研究表明,虎杖中蒽醌类成分可以治疗细菌、真菌引起的疾病以及抑制肿瘤细胞生长。蒽醌苷主要包括大黄素甲醚-8β--葡萄糖苷(anthraglycoside A,1)[17]、大黄素-8β--葡萄糖苷(anthraglycoside B,2)[18]、大黄酚-8β-葡萄糖苷(chrysophanol-8β--glucoside,3)[19]、polyganin A[20](4)、polyganin B[20](5)。蒽醌苷元主要包括:羟基大黄素(citreorosein,6)[17]、大黄素-6-甲醚(physcion,7)[18]、大黄素(emodin,8)[18]、迷人醇(fallacinol,9)[18]、大黄素-8-甲醚(questin,10)[18]、芦荟大黄素(aloe-emodin,11)[16]、6-羟基芦荟大黄素-8-甲醚(questinol,12)[21]、大黄酸(rhein,13)[16]、大黄酚(chrysophanol,14)[2]、xanthorin[22](15)、isorhodoptilometrin[22](16)。
近年来萘醌类成分的降糖和抗补体作用得到广泛关注[23]。萘醌类成分主要包括2-甲氧基-6-乙酰基-7-甲基胡桃酮(2-methoxy-6-acetyl-7-methyljuglone,17)[21]、7-acetyl-2-methoxy-6-methyl-8-hydroxyl-1, 4-naphthoquinone[24](18)、6-acetyl-2-ethoxy-5-hydroxy-7-methyl-1,4-naphthoquinone[22](19)、6-acetyl-5,8-dihydroxy-2-methoxy-7-methyl-1,4-naphtho-quinone[22](20)、虎杖素C[22](21)、3-acetyl-5-hydroxy-7-methoxy-2-methyl-1,4-naphthoquinone[22](22)、虎杖素A(cuspidatumin A,23)[24]。
此外,有研究人员分离得到苯醌类化合物:叶绿醌B(phylloquinone B,24)[25]、叶绿醌C(phylloquinone C,25)[25]。化合物1~25结构见图1。
1.2 二苯乙烯类
研究表明,二苯乙烯及其苷类可用于炎症、病毒性疾病、癌症、高血糖、高脂血、心脏病、神经退行性疾病的治疗。主要有白藜芦醇[18](26)、虎杖苷(polydatin,27)[18]、piceatannol glucoside[26](28)、白藜芦醇-4′-葡萄糖苷(resveratroloside)[27](29)、白藜芦醇-4(2′-没食子酰基)吡喃葡糖苷[resveratrol4-(2′-galloyl)-glucopyranoside,30][28]、白藜芦醇-4(6′-没食子酰基)吡喃葡糖苷[resveratrol4-(6′-galloyl)-glucopyranoside,31][28]、以及5个反式二苯乙烯苷硫酸盐[29](32~36)和5个顺式二苯乙烯苷硫酸盐[29](37~41)等。化合物26~41结构见图2。
1.3 黄酮类
黄酮类化合物可以治疗由于氧化应激和炎症导致的神经退行性等疾病[30]。目前报道的虎杖中分离得到的黄酮类化合物主要包括芹菜素(apigenin,42)[16]、槲皮素(quercetin,43)[16]、山柰酚(kaempferol,44)[2]、槲皮素-3阿拉伯糖苷(querectin-3arabinoside,45)[24]、金丝桃苷(hyperoside,46)[22]、异槲皮苷(isoquercitrin,47)[22]、槲皮素-3--鼠李糖苷(quercetin-3-- Rhamnoside,48)[22]、瑞诺苷(reynoutrin,49)[22]、木犀草苷(luteolin-7glucoside,50)[22]、儿茶素[(+)-catechin,51][31]、表儿茶素(epicatechin,52)[2]、儿茶素-5--β--吡喃葡萄糖苷[(+)-catechin-5--β--glucopyranoside,53][32]、染料木素(genistein,54)[16]、橙皮素(hesperetin,55)[16]、芦丁(rutin,56)[16]。化合物42~56结构见图3。
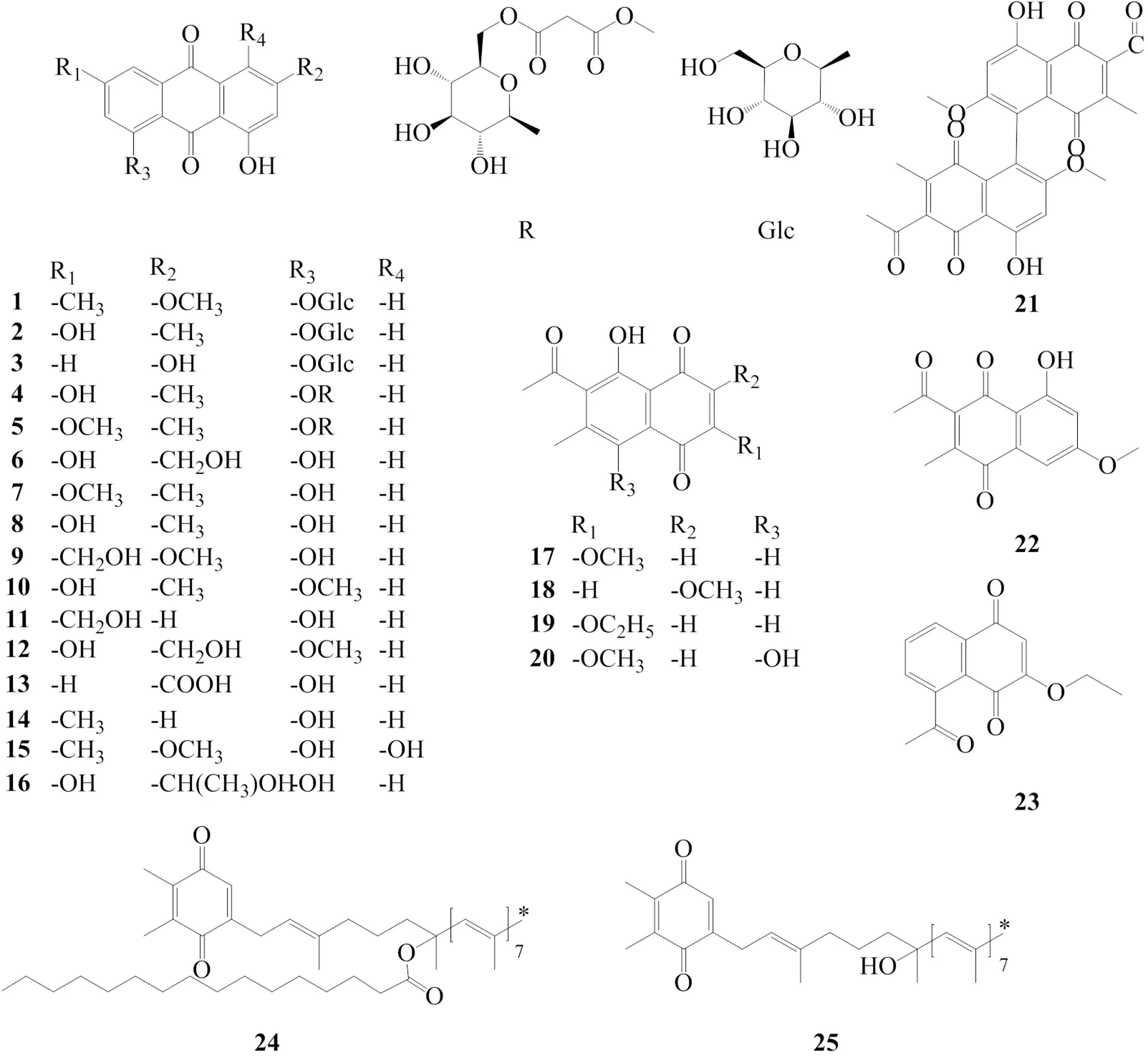
图1 虎杖中醌类化合物的化学结构
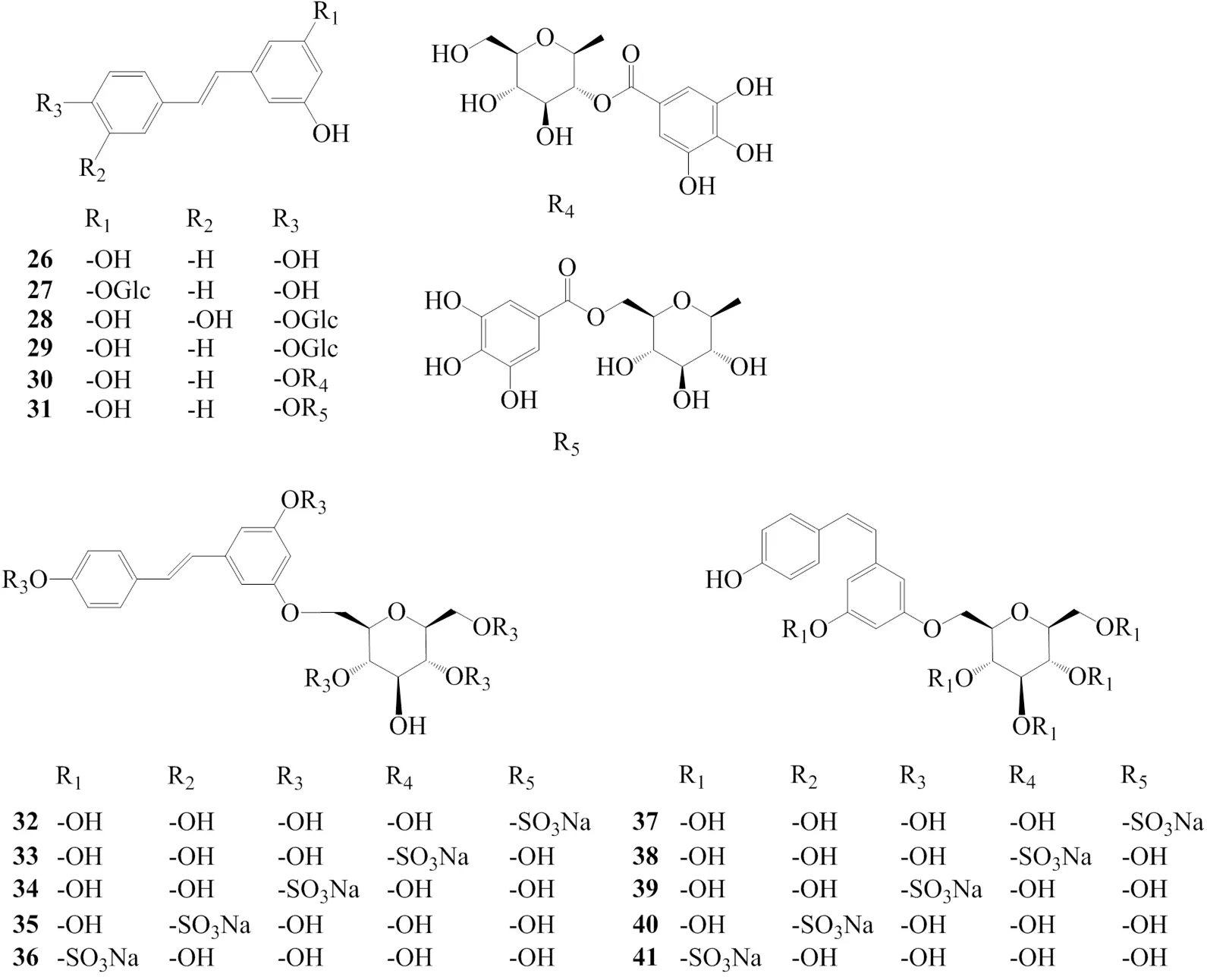
图2 虎杖中二苯乙烯类化合物的化学结构
1.4 苯丙素类
虎杖中苯丙素类成分药理活性众多,具有神经保护、抗氧化应激、促血管生成等作用。已分离得到苯丙酸类化合物:咖啡酸(caffeic acid,57)、阿魏酸(ferulic acid,58)、绿原酸(chlorogenic acid,59)[33];香豆素类化合物:香豆素(coumarin,60)[24]、7-羟基-4-甲氧基-5-甲基香豆素(7-hydroxy-4-methoxy-5-methylcoumarin,61)[21];异香豆素类化合物polyisocoumarin[34](62),以及Xiao等[32]分离得到木脂素类化合物sodium(−)-lyoniresinol-2a-sulfate(63)、sodium(+)-isolaricireinol-2a-sulfate(64)。化合物57~64结构见图4。
所有研究对象均晨起空腹采集静脉血3~4 mL,2 h内完成离心 (3 000 r/min,10 min),分离出血清,即时检测Cys-C和HCY水平,另外1管静脉血注入乙二胺四乙酸二钾抗凝管中,用于检测HbA1c的水平;取中段尿液10 mL,3 000 r/min离心10 min,并于室温2 h内检测UmALB。

图3 虎杖中黄酮类化合物的化学结构

图4 虎杖中苯丙素类化合物的化学结构
1.5 酚类和酚酸类
虎杖中酚类、酚酸类成分药理活性众多,具有神经保护、抗炎等作用。虎杖中酚类成分有tachioside[31](65)、isotachioside[31](66)、2,6-dimethoxy--hydroquinone-1--β--glucopyranoside[22](67)。决明松(torachrysone)[22](68)和2个决明松苷[23,35](69~70)属于萘酚类。酚酸类成分主要有原儿茶酸(protocatechuic acid,71)[24]、没食子酸(gallic acid,72)[31]、枸橼酸(citricn acid,73)[2]。化合物65~73结构见图5。
1.6 甾体类和萜类
甾体类、萜类化合物在治疗炎症、癌症等疾病中起到重要作用。孙印石等[16]在虎杖花甲醇提物的乙醚部分中分离得到甾体类成分β-谷甾醇(β-sitosterol,74),胡萝卜苷(daucosterol,75),金雪梅等[24]在根的乙醇提取物中得到三萜类成分齐墩果酸(oleanolic acid,76)。化合物74~76结构见图6。

图5 虎杖中酚类和酚酸类化合物的化学结构

图6 虎杖中甾体类和萜类化合物的化学结构
1.7 其他成分
孙印石等[16]在虎杖花的醇提物中分离得到苯乙酮类成分4-羟基苯乙酮(4-hydroxyacetophenone,77),另有研究人员在60%丙醇提取物中得到1-(3β--吡喃葡萄糖基-4,5-二羟基-苯基)-乙酮[31](78)。具有内酯环结构的化合物有黄葵内酯(ambrettolide,79)[24]、5,7-二羟基异苯唑呋喃(5,7-dihydroxyisobenzofuran,80)[17]。色原酮取代物2,5-dimethyl-7-hydro- xychromone[21](81),苯酞类成分5,7-二羟基1(3)-异苯并呋喃酮[17](82),近期分离得到苯酞苷类化合物polyphthaliside A[34](83)、polyphthaliside B[34](84),-甘露醇(-mannitol,86)[2],软脂酸(palmitic acid,87)、硬脂酸(stearic acid,88)、花生酸(arachidonic acid,89)[36]等一些常见的直链饱和脂肪酸[36]。化合物77~89结构见图7。
2 药理活性
虎杖有效性和安全性在数千年中医临床实践应用中得到了肯定,其提取物具有广泛药理活性。尽管多种化学成分结构已明确,药理活性研究也逐渐深入,但研究人员目前更加关注虎杖化学成分与药理活性之间的关系,明确与功效相关的化合物,以期为虎杖的临床应用提供科学依据。
2.1 抗病毒
2.1.1 抗冠状病毒 虎杖中多种成分已被证实具有显著抑制冠状病毒的作用。冠状病毒感染与4种结构蛋白有关,其中刺突蛋白(S-蛋白)和核衣壳蛋白(N-蛋白)在复制过程中发挥了重要作用。有研究表明白藜芦醇(250、125 μmol/L)能够显著抑制MERS-CoV引起的非洲绿猴肾细胞Vero E6死亡,抑制N-蛋白复制,抑制半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,Caspase-3)裂解,并且低浓度白藜芦醇连续给药能抑制细胞MERS-CoV感染,机制研究表明,白藜芦醇既可以激活细胞外调节蛋白激酶1/2(extracellular regulated protein kinase 1/2,ERK1/2)信号通路促进增殖,延长细胞存活时间;又可以下调成纤维细胞生长因子信号传导抑制细胞凋亡[9]。同源性模型研究显示,SARS-CoV-2与SARS-CoV具有同源相似性,其S-蛋白与血管紧张素转换酶2(angiotensin converting enzyme 2,ACE2)结合介导病毒进入细胞。通过3D微观立体结构(molsoft ICM-Pro)软件模拟,发现橙皮苷、芦丁均能靶向抑制S-蛋白与ACE2结合[10]。利用计算机辅助药物设计软件Molegro Virtual Docker 对S-蛋白与多种化合物对接发现,芹菜素具有潜在抗COVID-19活性[11]。3C样蛋白酶(3-chymotrypsin-like protease,3CLpro)是冠状病毒复制的关键酶,异槲皮苷通过与MERS-CoV的3CLpro色氨酸残基结合,抑制3CLpro活性,是潜在3CLpro抑制剂[12-13]。此外,大黄酸、芦荟大黄素也具有抑制COVID-19 3CLpro活性的作用[37]。

图7 虎杖中其他成分的化学结构
2.1.2 抗艾滋病毒 白藜芦醇通过调节DNA结合蛋白、高迁移率族蛋白B1和先天免疫应答来发挥抗病毒作用,通过干扰静息CD4+T细胞逆转录阶段,从而抑制人类免疫缺陷病毒(human immunodeficiency virus,HIV)在宿主细胞的复制过程[38]。Lin等[39]发现虎杖醇提物具有显著抗HIV病毒活性,进一步发现白藜芦醇、儿茶素、大黄素-8β--葡萄糖苷表现出相当强的抗HIV-1诱导的淋巴细胞病毒活性,EC50值分别为(4.37±1.96)、(14.4±1.34)、(11.29±6.26)µg/mL,治疗指数值分别为8.12、>13.89和>17.71。
2.1.3 抗肝炎病毒 虎杖中多种成分具有良好抑制乙型肝炎病毒(hepatitis B,HBV)的作用。白藜芦醇可明显降低rAAV8-1.3 HBV模型大鼠血清中乙肝表面抗原、乙肝病毒基因的表达,体外实验证明可以抑制肝星形细胞HSC-T6的增殖[40]。通过抑制实验发现芦荟大黄素与阳性药物拉米夫定具有几乎相等的抑制HBV复制效力,大黄酚抑制HBV复制的强度稍弱于芦荟大黄素[41]。绿原酸、咖啡酸能够体外阻滞HBV诱导的人肝癌细胞HepG 2.2.15模型中乙肝病毒基因复制,发挥抑制HBV活性[42]。
2.1.4 抗肠病毒 肠道病毒71(human enterovirus71,EV71)是一种非包膜的单链RNA病毒,可引起儿童手足口病。在EV71感染人横纹肌肉瘤(rhabdomyosarcoma,RD)细胞1.5 h后加入白藜芦醇,作用8 h后即可观察到显著抑制EV71的复制作用,并持续24 h,而虎杖苷抑制作用稍弱一些,仅在24 h时表现出显著抑制作用[43]。对同一模型研究发现,80 μmol/L槲皮素能够预防病毒感染并减少病毒吸附,同时通过抑制3CLpro的活性,阻断病毒复制早期阶段,降低EV71子代的产量,并以低毒性阻止EV71感染的RD细胞凋亡[44]。Zhong等[45]通过体外培养EV71感染的人肺成纤维细胞MRC5,发现29.6 μmol/L大黄素有极强病毒毒力抑制作用,使EV71毒力降低0.33倍,并且可以在基因以及蛋白表达水平展现出显著抑制作用,使病毒基因水平降低5.34倍,病毒蛋白表达降低30倍,进一步实验发现,大黄素通过缩短EV71感染诱导的MRC5细胞S期阻滞,抑制病毒复制。
2.1.5 抗其他病毒 二苯乙烯类与蒽醌类化合物可显著预防并治疗多种病毒感染的疾病[41,46-47]。白藜芦醇可以显著抑制多种病毒的感染,包括单纯疱疹病毒1和2、乳头瘤病毒、呼吸道病毒和流感病毒等[48-49]。用80 μmol/L白藜芦醇处理寨卡病毒(Zika virus,ZIKV)感染的细胞,发现病毒滴度和ZIKV mRNA复制降低了90%以上,若以同等剂量预处理病毒,则可将低30%以上,表明白藜芦醇可直接杀灭病毒并抑制寨卡病毒复制[50]。芦荟大黄素通过上调半乳凝素-3参与免疫系统中细胞生长过程,抑制甲型H7N1型流感病毒[51]。虎杖提取物可以抑制柯萨奇B3病毒在小鼠体内复制,延长小鼠存活时间,降低小鼠心肌酶含量,改善心肌病变,生成自身干扰素[52]。
2.2 抗炎
虎杖可用于炎症治疗,其中发挥作用的主要是蒽醌类、黄酮类、苯丙素类成分。由炎症紊乱导致的溃疡性结肠炎,以持续性便血和腹泻为主要症状,研究中常用葡聚糖硫酸钠盐(dextran sulfate sodium salt,DSS)诱导小鼠形成溃疡性结肠炎,因与人类临床症状相似,为良好的实验模型[53]。通过对DDS模型小鼠给予胡萝卜苷治疗,发现胡萝卜苷可以抑制小鼠体质量下降和疾病活动指数下降,同时抑制了结肠距离缩短,减少了上皮内层损伤[54],此外,它还降低了活性氧(reactive oxygen species,ROS)生成、巨噬细胞RAW264.7细胞浸润以及炎症因子的表达,如肿瘤坏死因子-α、白细胞介素-6(interleukin-6,IL-6)和IL-1β,从而产生抗炎作用。绿原酸亦具有抗炎作用,通过对C57BL/6小鼠应用DSS模型研究发现,绿原酸可减轻DSS诱导的黏膜损伤,抑制DSS诱导的氧化应激,降低一系列炎症相关蛋白(ERK1/2、p-ERK、p38、p-p38、JNK和p-JNK)的表达,抑制结肠细胞凋亡,调控机制与MAPK/ERK/JNK信号通路有关[55]。20 μg/mL大黄素能够降低RAW264.7细胞中核因子-κB(nuclear factor kappa-B,NF-κB)激活程度,较好地调节炎性因子表达,达到良好抗炎效果[56]。
2.3 抗氧化
抗氧化剂在衰老引起的疾病治疗中起着关键作用。给予肺纤维化大鼠20 mg/kg大黄素后,肺损伤得到良好缓解,对其机制探究表明,大黄素可以提高大鼠体内谷胱甘肽(glutathione,GSH)、超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)等抗氧化剂的水平,并且大大增强核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)在细胞核中的积累,同时诱导Nrf2抗氧化剂血红素加氧酶1(heme oxygenase-1,HO-1)的增加,提示其通过参与Nrf2信号通路从而对纤维化肺损伤起到抗氧化作用[57]。槲皮素可以显著缓解氧化损伤[58]。槲皮素通过诱导ERKs磷酸化基因表达,阻断Caspase-3级联激活,升高线粒体膜电位,进而减轻过氧化氢诱导的RAW264.7细胞凋亡[59]。槲皮素还可以通过诱导Nrf2/GCL/GSH抗氧化剂信号传导途径来减轻川楝素诱导的肝脏氧化损伤,预防性给药能够在体内和体外逆转Nrf2和GCLC/GCLM表达的下降[60]。绿原酸预处理可减轻过氧化氢所致的肠道线粒体损伤,增强线粒体抗氧化活性,调节呼吸复合物活性,使膜电位升高,改善结肠炎大鼠中线粒体结构[61]。白藜芦醇能通过降低丙二醛水平,提高GSH-Px、SOD水平,防止小鼠认知障碍和脑线粒体DNA缺失,清除自由基并调节脑内自由基的活性,预防衰老所致的神经退行性疾病[62]。
2.4 抗癌
近年来,虎杖提取物抗癌作用引起人们广泛关注[63-64]。大黄酸在体内、体外均具有抗癌作用,在体外可通过诱导肝癌细胞HepG2和宫颈癌细胞HeLa中的β-连环蛋白(β-catenin)的降解从而抑制癌细胞生长,进一步研究证明大黄酸诱导β-catenin降解与肝糖合成酶激酶3的调节有关[65]。胡萝卜苷能够降低2种肝癌细胞中β-catenin和p-β-catenin的水平,通过Wnt/β-catenin途径降低癌细胞的迁移、侵袭能力[66]。此外,虎杖苷对非小细胞肺癌(non-small cell lung carcinoma,NSCLC)具有治疗作用,研究表明,50 μmol/L虎杖苷能够显著抑制具有显著降低NSCLC细胞中核苷酸结合寡聚化结构域样受体蛋白3(NOD-like receptor protein 3,NLRP3)炎症小体的作用,抑制两种肺癌细胞中炎性小体NLRP3、接头蛋白ASC、pro-Caspase-1和Caspase-1的表达,通过NF-κB途径抑制癌细胞增殖和迁移,从而发挥抗癌活性[67]。大黄素和芦荟大黄素能够通过不同机制靶向下调雌激素受体α(estrogen receptor alpha,ERα)蛋白水平,抑制ERα转录激活,从而抑制乳腺癌细胞的增殖[63]。
2.5 抗菌
白藜芦醇是一种广谱抗菌化合物。采用纸片扩散法和肉汤微量稀释法,发现白藜芦醇对11种革兰阳性菌具有抑制作用,其中白藜芦醇对蜡样芽孢杆菌抑制作用最强(MIC 50 g/mL),其次是金黄色葡萄球菌(MIC 100~200 g/mL)和粪肠球菌(MIC 100 g/mL),进一步实验发现其通过抑制细菌生长周期发挥抗菌作用[68]。此外,白藜芦醇还具有很好的抑制革兰阴性菌的作用,如布氏弓形菌、嗜低温弓形菌[69]。蒽醌类成分也具有良好的抑制细菌功能。通过探究虎杖乙醚提取物对耐甲氧西林金黄色葡萄球菌(methicillin-resistant staphylococcus aureus,MRSA)的影响时发现,大黄素通过破坏细菌细胞膜结构,导致胞内成分的丢失,实现抑制MRSA活性的作用[70]。α-毒素是分泌的一种重要外毒素。分子动力学模拟发现,芦荟大黄素与α-毒素的活性部位(赖氨酸110、酪氨酸112和蛋氨酸113残基)结合,抑制α-毒素的溶血活性,动物实验发现,芦荟大黄素能够降低感染肺炎小鼠的肺损伤程度,并且死亡率大大降低,因此芦荟大黄素对的体内外毒性都有一定的抑制作用[71]。
2.6 抗糖尿病
糖尿病病程长,需长期控制,并伴随多个组织损伤和功能障碍,导致其他并发症。研究表明,白藜芦醇与白藜芦醇-4′葡萄糖苷均具有下调餐后血糖水平的功能,可有效预防并治疗糖尿病,但白藜芦醇-4′葡萄糖苷较低浓度即可产生抑制α-葡萄糖苷酶活性的作用,作用强于白藜芦醇,此外,将化合物与酶的分子对接表明其主要催化位点为天冬氨酸214和谷氨酸276,结构中间二苯酚的羟基可以与酶形成强氢键,并且具有可逆性[71]。大黄素可以改善2型糖尿病大鼠血糖、血脂和葡萄糖代谢异常,通过miR-20b/SMAD7轴作用于TGF-β/SMADs途径来改善大鼠成肌细胞葡萄糖代谢[72]。通过牛血清蛋白测定发现,25 µmol/L芦荟大黄素能够显著降低白蛋白糖基化,并通过细胞摄取实验发现,芦荟大黄素能够较好的透过细胞膜,是一种潜在的具有较高口服生物利用度的抗糖尿病药物[73]。槲皮素和白藜芦醇联合使用可以使1型糖尿病大鼠血糖降低,尿糖增加,恢复肌糖原和肝糖原水平,有良好抗糖尿病作用[74]。
2.7 抗痛风
近几年发现,虎杖苷、白黎芦醇等是虎杖发挥其抗痛风作用的重要物质基础[75-77]。对草酸钾诱导的高尿酸血症小鼠给予20、40 mg/kg白藜芦醇和虎杖苷ig给药7 d,可显著降低其血清尿酸水平,下调葡萄糖转运体9、上调肾脏有机阴离子转运体1水平至正常值,实现肾保护作用[78-80]。此外,白藜芦醇可以上调去乙酰化酶1促进痛风患者自噬来改善痛风炎症,通过检测急性痛风、间歇性痛风患者和正常人的血液样品对比发现,400 μmol/L白藜芦醇可以改善炎症相关因子IL-1β的释放,对和mRNA表达有调节作用,并且促进痛风患者外周血单核细胞中尿酸钠诱导的自噬的发生[81]。
2.8 神经保护
近年来,虎杖对神经系统的影响被相继研究报道。淀粉样蛋白-β(amyloid β-protein,Aβ)在体内和体外都会对神经造成不利影响,导致神经退行性疾病发病,其发病机制众多,如ROS的产生和小胶质细胞BV-2的增殖[79];α-突触核蛋白(α-synuclein,αS)和Aβ的原纤维失稳和纤维形成[80]。研究表明,橙皮素通过调节Aβ小鼠模型中的Nrf2/TLR4/NF-κB信号传导发挥神经保护作用,橙皮素能显著减轻海马、皮层和体外小鼠海马神经元细胞中乳过氧化物酶、Nrf2/HO-1和ROS的表达,通过抑制胶质纤维酸性蛋白和离子钙结合衔接分子1的表达逆转Aβ诱导的BV-2细胞活化,同时减缓小鼠病理学状态[79]。100 μmol/L原儿茶酸可以抑制Aβ和αS纤维形成和原纤维失稳过程,另外,1 μmol/L原儿茶酸可以预防Aβ和αS对神经细胞的毒性[80]。缺氧缺糖会导致神经元受损,进而导致神经性疾病和脑损伤。研究表明,12.5、50 μg/mL虎杖苷能有效减缓缺氧缺糖所致的大脑皮层神经元损伤,改善认知功能障碍[81]。胡萝卜苷能够显著降低缺糖缺氧/再灌注模型中大脑皮层神经元的损伤和凋亡,促进生长因子IGF1的表达,调节控制凋亡的蛋白(Bcl-2/Bax)表达处于平衡状态,发挥神经保护功能[82]。
2.9 雌激素样作用
虎杖提取物中表现出雌激素作用的是部分蒽醌类成分[83-84]。研究发现大黄素、大黄酚、大黄素-8β--吡喃葡萄糖苷以及芦荟大黄素均可以抑制人乳腺癌细胞的增殖[84],另有学者通过转基因酵母检测亦证实大黄素具有雌激素活性,进一步实验发现未结合的羟基是强活性的关键部位[36]。这些化合物与人类受体有亲和力,可用于激素替代治疗。
2.10 血管生成作用
虎杖对组织中的血管生成表现出截然相反的作用。一方面大黄素[64,85]、大黄酸[86]可以抑制肿瘤中血管生成,减少营养物质输送,抑制肿瘤生长。另一方面,阿魏酸、芦丁、染料木素可以促进血管生成,进而促进创伤愈合,用于治疗糖尿病患者因血管生成障碍所导致的进一步感染和溃疡甚至坏疽。给予糖尿病大鼠阿魏酸可使羟脯氨酸和己糖胺含量明显升高,能有效抑制脂质过氧化,提高一氧化氮、SOD、GSH含量,同时升高血清锌、铜含量,促进血管生成[87]。此外,阿魏酸血管生成作用与对内皮细胞的调节有关,研究发现,阿魏酸通过促进丝裂原活化蛋白激酶、磷脂酰肌醇3-激酶和缺氧诱导因子-1信号转录,增加人脐静脉内皮细胞中血管内皮生长因子和血小板衍生生长因子的表达,以一种新的方式促进血管生成[88]。芦丁可以显著增加心脏毛细血管密度[89]。染料木素对血管生成具有双重作用,较高浓度(25~100 µmol/L)时可抑制血管生成,而低浓度(0.001~1 µmol/L)时则起到促进作用[90]。
2.11 其他
沈路路[23]研究发现,虎杖中迷人醇可以显著抑制补体激活途径,具有抗补体活性。白藜芦醇在极低剂量(2~0.5 mmol/L)下就可以产生抑制肠道α-葡萄糖苷酶活性的作用,在给药2 h内,迅速减缓葡萄糖进入脂肪细胞,抑制前体脂肪细胞中脂质的生成,其能够沿着肠道脂肪组织轴改变葡萄糖供应,具有抗肥胖作用[91]。此外化合物还具有抗氧化和调节血脂的作用,能显著地减少患动脉粥样硬化的几率[92]。异槲皮素对骨生成有促进作用,在0.01~1 μmol/L内显著促进了细胞增殖和矿物质沉积,提高了碱性磷酸酶活性,同时成骨转录因子Runx2、骨唾液酸蛋白和跨膜糖蛋白A-TF6的表达水平也被上调[93]。
3 毒性研究
对虎杖成分进行体外神经毒性实验发现[1],质量浓度为300、400 μg/mL虎杖水溶性成分对神经细胞分别产生一般毒性和神经毒性。李凤新[52]进行急性毒性实验发现,未测出小鼠LD50,大鼠长期毒性实验表明蒽醌类提取物对雄性大鼠肝脏有一定损伤,但停药即可逆转并恢复正常。提示虎杖蒽醌类提取物经长期大量使用会产生毒性,造成肝脏损伤,但产生的毒性反应具有可逆性。
4 结语与展望
中药虎杖资源丰富,分布范围广,具有丰富的功效及广泛的临床应用[94]。本综述就虎杖现有化合物及其药理作用做了较为全面总结,其中蒽醌类、二苯乙烯类、黄酮类、苯丙素类成分为虎杖发挥药理作用的主要药效物质基础,用于炎症、糖尿病、痛风、癌症、病毒性疾病、细菌感染性疾病、神经退行性疾病的治疗。特别是对于呼吸系统疾病,如支气管哮喘、呼吸道合胞病毒引起的肺炎等,已有中成药应用于临床治疗。虎杖在呼吸性疾病传统方剂中的应用经验也为此次抗击新型冠状病毒肺炎提供了新的思路,张伯礼院士在一线抗击疫情时,将虎杖添加到宣肺败毒汤中,极大减少患者复阳概率与轻症患者转重概率。这提示虎杖是一种有前景的药物,具有二次开发利用价值。
目前国内外学者对虎杖中化学成分及其药理活性已有较多认识,但是就研究现状来看也存在一些问题:主要化学成分量效关系尚不明确,动物长期毒性研究尚少,与功效相关的质量标志物研究报导尚少,在中药大品种中贡献需要进一步挖掘,药理实验方面活性评价较多但机制研究较少。在进一步研究中应以中医理论为指导,结合现代分析手段,应用代谢组学、分子药理学、生物芯片等先进技术,更全面精确地探究其药效物质基础发挥药理活性的机制,筛选与传统功效相对应的质量标志物并建立合理的质量标准,优化中成药质量控制方案,为虎杖资源开发利用及相关中药复方制剂的生产与临床应用提供科学依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 尹春春. 早期神经毒性体外评价方法的建立及槟榔和虎杖的神经毒性评价 [D].镇江: 江苏大学, 2017.
[2] 俸灵林. 虎杖的化学成分及其质量研究 [D]. 沈阳: 沈阳药科大学, 2003.
[3] 中国药典[S]. 一部. 2020: 217-218.
[4] Shan B, Cai Y Z, Brooks J D,. Antibacterial properties ofroots and their major bioactive constituents [J]., 2008, 109(3): 530-537.
[5] 时圣明, 潘明佳, 王文倩, 等. 虎杖的化学成分及药理作用研究进展 [J]. 药物评价研究, 2016, 39(2): 317-321.
[6] 施旭光. 虎金颗粒抗免疫性肝纤维化作用的实验研究 [D]. 广州: 广州中医药大学, 2005.
[7] 张沛, 夏正坤, 高春林. 金欣口服液对呼吸道合胞病毒感染大鼠JAK/STAT信号通路P-STAT1、P-STAT2调控的研究 [J]. 中华中医药杂志, 2016, 31(2): 455-458.
[8] 张蓓. 基于UPLC-ESI-Q-TOF-MS的芪仙清鸣颗粒的物质基础研究 [D]. 上海: 中国医药工业研究总院, 2018.
[9] Lin S C, Ho C T, Chuo W H,. Effective inhibition of MERS-CoV infection by resveratrol [J]., 2017, 17(1): 144.
[10] Wu C R, Liu Y, Yang Y Y,. Analysis of therapeutic targets for SARS-CoV-2 and discovery of potential drugs by computational methods [J]., 2020, 10(5): 766-788.
[11] Adem S, Eyupoglu V, Sarfraz I,. Identification of Potent COVID-19 Main Protease (Mpro) Inhibitors from Natural Polyphenols: An in Silico Strategy Unveils a Hope against CORONA [J].s, 2020, doi: 10.20944/preprints202003.0333.v1.
[12] Memish Z A, Perlman S, van Kerkhove M D,. Middle East respiratory syndrome [J]., 2020, 395(10229): 1063-1077.
[13] Jo S, Kim H, Kim S,. Characteristics of flavonoids as potent MERS-CoV 3C-like protease inhibitors [J]., 2019, 94(6): 2023-2030.
[14] 李明韩. 虎杖散贴膏治疗腰椎间盘突出症的临床疗效观察 [J]. 世界最新医学信息文摘, 2019, 19(93): 21-22.
[15] Arichi, Kimura, Okuda,. Effects of Stilbene Components of the Roots of Polygonum cuspidatum SIEB. et ZUCC. on Lipid Metabolism [J]., 1982, 30(5): 1766-1770.
[16] 孙印石, 王建华. 虎杖花的化学成分研究 [J]. 中草药, 2015, 46(15): 2219-2222.
[17] 刘晓秋, 于黎明, 吴立军. 虎杖化学成分研究(I) [J]. 中国中药杂志, 2003, 28(1): 47-49.
[18] 华燕, 周建于, 倪伟, 等. 虎杖的化学成分研究 [J]. 天然产物研究与开发, 2001, 13(6): 16-18.
[19] Feng J F, Ren H Z, Gou Q F,. Comparative analysis of the major constituents in three related polygonaceous medicinal plants using pressurized liquid extraction and HPLC-ESI/MS [J]., 2016, 8(7): 1557-1564.
[20] Zhang H, Zhang Q W, Wang L,. Two new anthraquinone malonylglucosides from[J]., 2012, 26(14): 1323-1327.
[21] Kimura Y, Kozawa M, Baba K,. New constitutents of roots of[J]., 1983, 48(7): 164-168.
[22] 马培. 虎杖生药学研究 [D]. 北京: 北京协和医学院, 2013.
[23] 沈路路. 虎杖的抗补体活性成分研究 [D]. 上海: 复旦大学, 2013.
[24] 金雪梅, 金光洙. 虎杖的化学成分研究 [J]. 中草药, 2007, 38(10): 1446-1448.
[25] 梁永峰. 陇东虎杖化学成分研究 [J]. 安徽农业科学, 2008, 36(29): 12736-12737.
[26] Fan P H, Hostettmann K, Lou H X. Allelochemicals of the invasive neophyteSieb. & Zucc. (Polygonaceae) [J]., 2010, 20(3): 223-227.
[27] Peng W, Qin R X, Li X L,. Botany, phytochemistry, pharmacology, and potential application ofSieb.et Zucc.: A review [J]., 2013, 148(3): 729-745.
[28] Hegde V R, Pu H Y, Patel M,. Two new bacterial DNA primase inhibitors from the plant[J]., 2004, 14(9): 2275-2277.
[29] Xiao K, Xuan L, Xu Y,. Stilbene glycoside sulfates from[J]., 2000, 63(10): 1373-1376.
[30] 王欣, 覃瑶, 孙建彬, 等. 虎杖叶的化学成分、药理活性、临床应用及质量控制研究进展 [J]. 亚太传统医药, 2019, 15(10): 196-200.
[31] 肖凯, 宣利江, 徐亚明, 等. 虎杖的化学成分研究 [J]. 中国药学杂志, 2003, 38(1): 12-14.
[32] Xiao K, Xuan L J, Xu Y M,. Constituents from[J]., 2002, 50(5): 605-608.
[33] Vechar A S, Kuznyetsova Z P, Chekalinskaya I I. Study of phenolcarboxylic acids ofspecies [J]., 1980, 6: 71-4.
[34] Jiang J S, Li F S, Feng Z M,. New phenolic glycosides from[J]., 2020, 22(1): 17-23.
[35] Tang D, Zhu J X, Wu A G,. Pre-column incubation followed by fast liquid chromatography analysis for rapid screening of natural methylglyoxal scavengers directly from herbal medicines: Case study of[J]., 2013, 1286: 102-110.
[36] 张彩宁. 中药虎杖雌激素活性成分及其物质基础研究 [D]. 北京: 中国科学院研究生院(大连化学物理研究所), 2006.
[37] Chandel V, Raj S, Rathi B,. In silico identification of potent COVID-19 main protease inhibitors from FDA approved antiviral compounds and active phytochemicals through molecular docking: A drug repurposing approach [J]., 2020, doi: 10.20944/preprints202003.0349.v1.
[38] Zainal N, Chang C P, Cheng Y L,. Resveratrol treatment reveals a novel role for HMGB1 in regulation of the type 1 interferon response in dengue virus infection [J]., 2017, 7: 42998.
[39] Lin H W, Sun M X, Wang Y H,. Anti-HIV activities of the compounds isolated fromand[J]., 2010, 76(9): 889-892.
[40] 罗宏伟, 张四喜. 白藜芦醇抗乙型肝炎病毒及肝炎所致纤维化的初步研究 [J]. 中国生化药物杂志, 2016, 36(12): 29-32.
[41] Parvez M K, Al-Dosari M S, Alam P,. The anti-hepatitis B virus therapeutic potential of anthraquinones derived from[J]., 2019, 33(11): 2960-2970.
[42] Wang G F, Shi L P, Ren Y D,. Anti-hepatitis B virus activity of chlorogenic acid, quinic acid and caffeic acidand[J]., 2009, 83(2): 186-190.
[43] Zhang L, Li Y Y, Gu Z W,. Resveratrol inhibits71 replication and pro-inflammatory cytokine secretion in rhabdosarcoma cells through blocking IKKs/NF-κB signaling pathway [J]., 2015, 10(2): e0116879.
[44] Yao C G, Xi C L, Hu K H,. Inhibition of71 replication and viral 3C protease by quercetin [J]., 2018, 15(1): 116.
[45] Zhong T, Zhang L Y, Wang Z Y,. Rheum emodin inhibits Enterovirus 71 viral replication and affects the host cell cycle environment [J]., 2017, 38(3): 392-401.
[46] Wang C Y, Zhang D L, Ma H M,. Neuroprotective effects of emodin-8--beta--glucosideand[J]., 2007, 577(1/2/3): 58-63.
[47] Clouser C L, Chauhan J, Bess M A,. Anti-HIV-1 activity of resveratrol derivatives and synergistic inhibition of HIV-1 by the combination of resveratrol and decitabine [J]., 2012, 22(21): 6642-6646.
[48] Docherty J J, Sweet T J, Bailey E,. Resveratrol inhibition of varicella-zoster virus replication[J]., 2006, 72(3): 171-177.
[49] Campagna M, Rivas C. Antiviral activity of resveratrol [J]., 2010, 38(Pt 1): 50-53.
[50] Mohd A, Zainal N, Tan K K,. Resveratrol affects Zika virus replication[J]., 2019, 9(1): 14336.
[51] Li S W, Yang T C, Lai C C,. Antiviral activity of-emodin against influenza A virus via galectin-3 up-regulation [J]., 2014, 738: 125-132.
[52] 李凤新. 虎杖提取物抗病毒物质基础、药理作用及代谢研究 [D]. 长春: 吉林大学, 2009.
[53] 陈素傲, 金世柱. 葡聚糖硫酸钠诱导鼠溃疡性结肠炎模型研究进展 [J]. 中国比较医学杂志, 2020, 30(4): 142-146.
[54] Jang J, Kim S M, Yee,. Daucosterol suppresses dextran sulfate sodium (DSS)-induced colitis in mice [J]., 2019, 72: 124-130.
[55] Gao W Y, Wang C H, Yu L,. Chlorogenic acid attenuates dextran sodium sulfate-induced ulcerative colitis in mice through MAPK/ERK/JNK pathway [J]., 2019, 2019: 6769789.
[56] Li H L, Chen H L, Li H,. Regulatory effects of emodin on NF-kappaB activation and inflammatory cytokine expression in RAW 264.7 macrophages [J]., 2005, 16(1): 41-47.
[57] Tian S L, Yang Y, Liu X L,. Emodin attenuates bleomycin-induced pulmonary fibrosis via anti-inflammatory and anti-oxidative activities in rats [J]., 2018, 24: 1-10.
[58] 王中旺, 许梦川, 杨雯茜, 等. 槲皮素对2型糖尿病患者机体铁代谢的影响 [J]. 河北师范大学学报: 自然科学版, 2017, 41(3): 272-276.
[59] Chow J M, Shen S C, Huan S K,. Quercetin, but not rutin and quercitrin, prevention of H2O2-induced apoptosis via anti-oxidant activity and heme oxygenase 1 gene expression in macrophages [J]., 2005, 69(12): 1839-1851.
[60] Jin Y, Huang Z L, Li L,. Quercetin attenuates toosendanin-induced hepatotoxicity through inducing the Nrf2/GCL/GSH antioxidant signaling pathway [J]., 2019, 40(1): 75-85.
[61] Zhou Y, Zhou L L, Ruan Z,. Chlorogenic acid ameliorates intestinal mitochondrial injury by increasing antioxidant effects and activity of respiratory complexes [J]., 2016, 80(5): 962-971.
[62] Liu G S, Zhang Z S, Yang B,. Resveratrol attenuates oxidative damage and ameliorates cognitive impairment in the brain of senescence-accelerated mice [J]., 2012, 91(17/18): 872-877.
[63] Huang P H, Huang C Y, Chen M C,. Emodin and-emodin suppress breast cancer cell proliferation through ER α inhibition [J]., 2013, 2013: 376123.
[64] Shi G H, Zhou L. Emodin suppresses angiogenesis and metastasis in anaplastic thyroid cancer by affecting TRAF6‑mediated pathwaysand[J]., 2018, 18(6): 5191-5197.
[65] Liu S, Wang J, Shao T,. The natural agent Rhein induces β-catenin degradation and tumour growth arrest [J]., 2018, 22(1): 589-599.
[66] Zeng J Q, Liu X, Li X F,. Daucosterol inhibits the proliferation, migration, and invasion of hepatocellular carcinoma cells via Wnt/β-catenin signaling [J]., 2017, 22(6): E862.
[67] Zou J, Yang Y, Yang Y,. Polydatin suppresses proliferation and metastasis of non-small cell lung cancer cells by inhibiting NLRP3 inflammasome activation via NF-κB pathway [J]., 2018, 108: 130-136.
[68] Paulo L, Ferreira S, Gallardo E,. Antimicrobial activity and effects of resveratrol on human pathogenic bacteria [J]., 2010, 26(8): 1533-1538.
[69] Ferreira S, Silva F, Queiroz J A,. Resveratrol againstand: Activity and effect on cellular functions [J]., 2014, 180: 62-68.
[70] Zhao X H, Tao J H, Zhang T,. Resveratroloside alleviates postprandial hyperglycemia in diabetic mice by competitively inhibiting α-glucosidase [J]., 2019, 67(10): 2886-2893.
[71] Jiang L X, Yi T, Shen Z Y,.-emodin attenuatespathogenicity by interfering with the oligomerization of α-toxin [J]., 2019, 9: 157.
[72] Xiao D, Hu Y Y, Fu Y J,. Emodin improves glucose metabolism by targeting microRNA-20b in insulin-resistant skeletal muscle [J]., 2019, 59: 152758.
[73] Froldi G, Baronchelli F, Marin E,. Antiglycation activity and HT-29 cellular uptake of Aloe-emodin, aloin, andleaf extracts [J]., 2019, 24(11): E2128.
[74] Rhee Y, Rahman M, Kim S J,. Synergistic antidiabetic activity of quercetin and resveratrol in animal model of type-1 diabetes [J]., 2015, 490-491.
[75] 侯建平, 王亚军, 严亚峰, 等. 虎杖提取物抗动物高尿酸血症的实验研究 [J]. 西部中医药, 2012, 25(5): 21-24.
[76] 韩英, 程耀科, 陈玉娟, 等. 复方虎杖颗粒对高尿酸血症患者血尿酸、血脂及血液流变学的影响 [J]. 实用药物与临床, 2013, 16(6): 478-480.
[77] 吴杲, 吴汉斌, 蒋红. 虎杖苷的降尿酸作用及其机制研究 [J]. 药学学报, 2014, 49(12): 1739-1742.
[78] Shi Y W, Wang C P, Liu L,. Antihyperuricemic and nephroprotective effects of resveratrol and its analogues in hyperuricemic mice [J]., 2012, 56(9): 1433-1444.
[79] Ikram M, Muhammad T, Rehman S U,. Hesperetin confers neuroprotection by regulating Nrf2/TLR4/NF-κB signaling in an Aβ mouse model [J]., 2019, 56(9): 6293-6309.
[80] Hornedo-Ortega R, Álvarez-Fernández M A, Cerezo A B,. Protocatechuic acid: Inhibition of fibril formation, destabilization of preformed fibrils of amyloid-β and α-synuclein, and neuroprotection [J]., 2016, 64(41): 7722-7732.
[81] Li R P, Wang Z Z, Sun M X,. Polydatin protects learning and memory impairments in a rat model of vascular dementia [J]., 2012, 19(8/9): 677-681.
[82] Jiang L H, Yuan X L, Yang N Y,. Daucosterol protects neurons against oxygen-glucose deprivation/reperfusion-mediated injury by activating IGF1 signaling pathway [J]., 2015, 152: 45-52.
[83] Zhang C N, Wang X M, Zhang X Z,. Bioassay-guided separation of citreorosein and other oestrogenic compounds from[J]., 2009, 23(5): 740-741.
[84] Matsuda H, Shimoda H, Morikawa T,. Phytoestrogens from the roots of(Polygonaceae): Structure-requirement of hydroxyanthraquinones for estrogenic activity [J]., 2001, 11(14): 1839-1842.
[85] Qu W, Wang Y, Wu Q,. Emodin inhibits HMGB1-induced tumor angiogenesis in human osteosarcoma by regulating SIRT1 [J]., 2015, 8(9): 15054-15064.
[86] Fernand V E, Losso J N, Truax R E,. Rhein inhibits angiogenesis and the viability of hormone-dependent and-independent cancer cells under normoxic or hypoxic conditions[J]., 2011, 192(3): 220-232.
[87] Ghaisas M M, Kshirsagar S B, Sahane R S. Evaluation of wound healing activity of ferulic acid in diabetic rats [J]., 2014, 11(5): 523-532.
[88] Lin C M, Chiu J H, Wu I H,. Ferulic acid augments angiogenesis via VEGF, PDGF and HIF-1 alpha [J]., 2010, 21(7): 627-633.
[89] Huang R, Shi Z D, Chen L,. Rutin alleviates diabetic cardiomyopathy and improves cardiac function in diabetic ApoEknockout mice [J]., 2017, 814: 151-160.
[90] Berndt S, Issa M E, Carpentier G,. A bivalent role of genistein in sprouting angiogenesis [J]., 2018, 84(9/10): 653-661.
[91] Carpéné C, Les F, Cásedas G,. Resveratrol anti-obesity effects: Rapid inhibition of adipocyte glucose utilization [J]., 2019, 8(3): E74.
[92] 李朋, 陈萍, 张浩. 虎杖中白藜芦醇及其甲基化衍生物对高脂血症小鼠降血脂和抗氧化作用的研究 [J]. 华西药学杂志, 2016, 31(4): 374-377.
[93] Li J, Wang X X, Wang Y Z,. Isoquercitrin, a flavonoid glucoside, exerts a positive effect on osteogenesisand[J]., 2019, 297: 85-94.
[94] 杨谦, 张晓燕. 中药虎杖的临床应用 [J]. 中医临床研究, 2011, 3(11): 51.
Research development on chemical composition and pharmacology ofet
LIANG Chun-xiao, WANG Shan-shan, CHEN Shu-jing, WANG Yuan, LI Jin, CHANG Yan-xu
State Key Laboratory of Component-based Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
Huzhang (et) has been widely used to treat and prevent diseases in China for thousands of years. The therapeutic application ofetis used for ameliorating diarrhea, cough, jaundice, inflammation, amenorrhea, burn and hyperlipemia,. Chemical compounds isolated and identified from this plant included quinones, stilbenes, flavonoids, and phenylpropanoids,. Recent pharmacological and clinical research experiments showed thatetcould be used for the treatment of diseases such as inflammation, diabetes, gout, cancer, viral diseases, bacterial infectious diseases, neurodegenerative diseases and other diseases. In particular, it has a good inhibitory effect on respiratory diseases caused by coronavirus. This article systematically summarizes the domestic and foreign research literatures ofetin recent years, and reviews from the perspective of chemical components corresponding to the pharmacological effects, provides a basis for the further development and application ofetmedicinal resources, and also provides a scientific basis for the application ofetin combating the new coronavirus pneumonia.
et; anthraquinone; stilbenes; polydatin; flavonoids; phenylpropanoids
R282
A
0253 - 2670(2022)04 - 1264 - 13
10.7501/j.issn.0253-2670.2022.04.034
2021-08-09
国家重点研发计划(2020YFA0708004);国家重点研发计划(2019YFC1711000);天津市科技计划项目(21ZYJDJC00080)
梁春晓(1997—),女,硕士研究生,主要从事中药质量标准研究。E-mail: cx_pepper@163.com
常艳旭(1981—),男,研究员,博士生导师,主要从事中药质量评价新技术与新方法研究。E-mail: tcmcyx@126.com
[责任编辑 时圣明]
