多探针多模态PET/MR成像在高学历早发型阿尔兹海默病患者中应用价值
2022-02-24徐晓君阮伟伟盖永康柳轻瑶兰晓莉
徐晓君, 阮伟伟, 刘 芳, 盖永康, 柳轻瑶, 孙 逊, 兰晓莉
1.华中科技大学同济医学院附属协和医院 核医学科,湖北 武汉 430022;2.湖北省分子影像重点实验室,湖北 武汉 430022
阿尔茨海默病(Alzheimer′s disease,AD)是常见的认知障碍疾病[1-8]。早发型阿尔茨海默病(early-onset Alzheimer′s disease,EOAD)和迟发型阿尔茨海默病(late-onset Alzheimer′s disease,LOAD)是AD的两种主要形式。EOAD是在65岁之前发生的AD,占所有AD的5%~10%[2-3]。与LOAD比较,EOAD通常侵袭性更强、病程更短、预后更差,因此,早期、准确诊断对EOAD的治疗及预后至关重要。细胞外β-淀粉样蛋白(amyloid β-protein,Aβ)斑块和由tau蛋白过度磷酸化引起的神经原纤维缠结(neurofibrillary tangles,NFT)是AD的主要病理特征[4]。EOAD比LOAD表现出更多的Aβ和NFT;且与Aβ比较,NFT与病情的严重程度更加一致[4-5]。EOAD还比LOAD表现出更广泛的皮质萎缩、灌注不足、代谢低下及tau沉积[3,9-11]。神经影像学技术(PET和MR)的发展实现了在体可视化,可检测脑部糖代谢、淀粉样斑块沉积、tau蛋白负荷及皮层萎缩等,从而辅助AD的早期诊断、鉴别诊断及病情评估[3-4,6-8]。本研究旨在探讨多探针多模态PET/MR成像在高学历EOAD患者中的应用价值。现报道如下。
1 对象与方法
1.1 研究对象 选取华中科技大学同济医学院附属协和医院2021年收治的2例LOAD患者(LOAD组)和4例EOAD患者(EOAD组)为研究对象。(1)EOAD组中:患者1,男性,46岁发病,简易精神状态量表(mini-mental state examination,MMSE)评分26分,硕士学历;患者2,女性,55岁发病,MMSE评分6分,大专学历;患者3,男性,61岁发病,MMSE评分24分,初中学历;患者4,男性,59岁发病,MMSE评分25分,小学学历。(2)LOAD组中:患者5,女性,67岁发病,MMSE评分25分,高中学历;患者6,男性,65岁,MMSE评分26分,大专学历。以患者1为主要研究对象。本研究经医院伦理委员会批准。6例患者均符合国家老年和阿尔茨海默病协会(National Institute on Aging and Alzheimer′s Disease,NIA-AA)关于AD的诊断标准[7]。本研究获得华中科技大学同济医学院附属协和医院伦理委员会批准(2019-S1208)。6例患者及其家属均在检查前签署知情同意书。
1.2 PET/MR成像 6例患者均完成18F-FDG、11C-PIB、18F-APN-1607 PET/MR(美国GE公司SIGNATM3.0 T TOF-PET/MR)。18F-FDG、11C-PIB、18F-APN-1607 PET/MR扫描隔天进行,显像剂均由本院PET中心自行制备,放化纯>95%。由美国GE公司MINItrace回旋加速器生产18F和11C,18F-FDG自动化合成模块购自北京派特生物技术有限公司,PIB前体购自中国江苏华益科技有限公司,APN-1607前体由苏州新旭医药有限公司提供。PET/MR扫描前需停用神经系统相关药物12 h以上,18F-FDG PET扫描前患者禁食6 h以上,血糖水平≤200 mg/L。3种显像剂注射剂量均为3.7~5.5 MBq/kg,注射后于安静、避光的环境中休息60 min,然后行同步PET/MR采集,PET扫描时长为20 min。PET/MR成像扫描参数设置参考《一体化PET/MR颅脑成像检查规范(2017版)》[12]。18F-FDG和18F-APN-1607 PET采用容积扫描,视野40 cm×40 cm,矩阵192×192,采用区域分割结合图谱配准法行衰减校正,采用有序子集最大期望值迭代法重建,迭代次数8,子集数32。11C-PIB PET重建的迭代次数3,子集数28。同步采集三维容积T1加权成像(three-dimensional volume T1-weighted imaging,3D T1WI)。图像数据处理均由SPM12(http://www.gin.cnrs.fr/en/tools/aal-aal2/)和MATLAB 2020b(Mathworks,Natick,MA,USA)完成。首先,使用SPM12将PET成像匹配到3D T1成像上,然后基于来自自动解剖标记图集(http://www.gin.cnrs.fr/en/tools/aal-aal2/)的图集模板将全脑分成70个脑区,并得到各脑区的二值掩模,利用该二值掩模与MNI空间中的PET图像分别进行运算,提取各脑区的标准摄取值(standardized uptake value,SUVmean),计算标准摄取值比值(standardized uptake value ratio,SUVR)。
2 结果
2.1 患者1病例信息 患者男性,52岁,右利手,因进行性记忆力下降6年就诊,以短期记忆为主,反复重复语言及行为,生活尚能自理。既往身体健康,无脑部及其他疾病病史。无吸烟及嗜酒史,已婚。受教育程度为硕士学历(19年),工作稳定。无痴呆或其他神经疾病阳性家族史。实验室检查未见异常。神经系统评估显示反应迟钝,语利,运动系统无异常征象。神经心理学测试中,MMSE评分26分,受损认知域为回忆、视空间;蒙特利尔认知评估(Montreal cognitive assess-ment,MoCA)评分19分,受损认知域为回忆、视空间及语言流畅性。画钟试验(clock drawing task,CDT)评分3分,日常生活能力(activity of daily living,ADL)评分20分,波士顿命名测验(Boston naming test,BNT)-30评分29分。载脂蛋白E(apolipoprotein E,ApoE)多态性检测为ApoE3/E4杂合子基因型。
2.2 患者1影像学特征 脑MRI扫描见双侧顶叶皮质萎缩(图1a),无局灶性改变或其他异常。18F-FDG PET成像见后顶叶、后扣带回、顶颞叶交界区葡萄糖代谢减低(图1b~1d)。Neuro Q定量分析发现,后颞叶皮层(左:-7.9 334,右:-5.1 107)、后扣带回(左:-4.4 764,右:-3.3 261)、顶下小叶(左:-2.8 194,右:-2.2 354)、AVC(左:-7.0 990,右:-5.3 042)低代谢(图1e)。11C-PIB PET显示大脑皮层Aβ弥散广泛沉积,其中,以额叶、扣带回、颞叶距状裂及周围皮质、颞横回、颞上中下回、顶叶缘上回、顶叶角回较为明显(图2a~2c)。18F-APN-1607 PET成像显示大脑皮层广泛的tau蛋白沉积,尤其是在后联合皮层。SPM分析显示,后扣带回、顶上/下小叶、顶叶楔前叶、顶叶角回、顶叶缘上回、颞上/中/下回、颞叶梭状回、枕叶、枕叶舌回、枕叶楔叶SUVR明显增高,均>1.5(图2d~2f)。
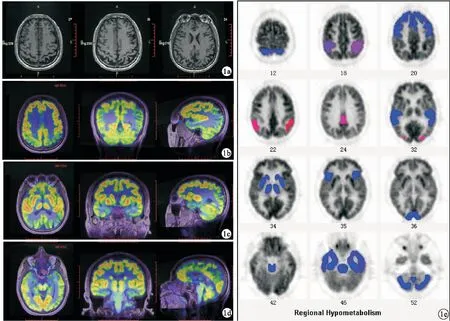
图1 患者1影像学图片(a.T1横断面连续序列,显示双侧顶叶皮质萎缩;b~d.18F-FDG PET/MR融合图像,从左到右分别为横断面、冠状面及矢状面,显示后顶叶、后扣带回、顶颞叶交界区葡萄糖代谢减低;e.Neuro Q定量分析的低代谢区域,颜色越接近红色表现代谢越低,越接近蓝色的区域表现代谢正常)

图2 患者1影像学图片(a~c.11C-PIB PET/MR融合图像,从左到右分别为横断面、冠状面及矢状面,显示额叶、后扣带回皮质及外侧颞叶有弥散Aβ沉积;d~f.18F-APN-1607 PET/MR融合图像,从左到右分别为横断面、冠状面及矢状面,显示大脑皮层中广泛tau蛋白沉积,尤其是在后联合皮层中)
2.3 6例患者PET/MR结果比较
2.3.1 根据发病年龄进行比较 将患者1(46岁发病)与患者5(67岁发病)、患者6(65岁发病)进行比较,3例患者MMSE评分、教育程度相似。结果显示,患者1顶叶、楔前叶、顶叶角回、颞叶外侧区、枕叶区域的FDG摄取低于患者5和患者6(图3a);Aβ成像中,与患者6比较,患者1在主要大脑皮层区域,包括额叶、顶叶、后扣带回、楔前叶、顶叶角回、颞叶外侧区、海马、楔叶、枕叶的SUVR均较高,但与患者5比较,结果存在不一致(图3b);tau成像中,除海马区外,患者1在主要脑区(额叶、顶叶、后扣带回、楔前叶、顶叶角回、颞叶外侧区、楔叶、枕叶)的SUVR均高于患者5和患者6(图3c)。
2.3.2 根据教育程度进行比较 将患者1(硕士学历)与患者3(初中学历)、患者4(小学学历)进行比较,3例患者发病年龄、MMSE评分相似。结果显示,患者1顶叶、后扣带回、楔前叶、顶叶角回、颞叶外侧区、枕叶区域的FDG摄取低于患者3和患者4(图3d);Aβ成像和tau成像中,患者1大部分关键脑区(额叶、顶叶、楔前叶、顶叶角回、颞叶外侧区、楔叶、枕叶)的SUVR均高于患者3和患者4(图3e~3f)。
2.3.3 根据MMSE评分进行比较 将患者1(MMSE评分26分)与患者2(MMSE评分6分)进行比较,2例患者发病年龄、教育程度相似。结果显示,与患者2比较,患者1在顶叶、后扣带回、楔前叶、海马、枕叶区域的FDG摄取更低(图3d);除后扣带回外,患者1其余关键脑区(额叶、顶叶、楔前叶、顶叶角回、颞叶外侧区、海马、楔叶、枕叶)的Aβ沉积均高于患者2(图3e);tau显像中,患者2在颞叶外侧区和海马的SUVR高于患者1,在其余关键脑区(额叶、后扣带回、顶叶、楔前叶、顶叶角回、楔叶、枕叶)中,患者1SUVR与患者2相似或更高(图3f)。

图3 6例患者PET结果比较(a~c.患者1与患者5、患者6的18F-FDG、11C-PIB、18F-APN-1607 PET/MR SUVR对比直方图;d~f.患者1与患者3、患者4、患者2的18F-FDG、11C-PIB、18F-APN-1607 PET/MR SUVR对比直方图)
3 讨论
PET成像可跟踪AD的病理生理变化并实现体内可视化,是目前无创检测AD神经病理学的最佳手段之一[3-4,6-8]。NIA-AA明确提出,无论认知症状如何,只根据异常的Aβ和tau蛋白沉积即可明确诊断AD[7]。
年龄是AD的主要危险因素,并被用作分类标志[2,13]。EOAD和LOAD的认知差异在神经影像学中有着特征性表现。有研究显示,EOAD在脑功能连接中比LOAD表现出更严重的灌注不足、低代谢、皮质萎缩,以大脑后部区域最为显著[9-11]。患者1的MR表现为双侧顶叶萎缩,18F-FDG低代谢区域包含双侧顶叶、外侧颞叶区及后扣带回,与既往研究[11]较为一致,即EOAD表现出比LOAD更严重的顶叶受累。低代谢模式与不同认知领域受损的特定区域之间具有较好相关性[14]。本研究中,患者1主要存在短期记忆下降及视空间定位功能受损,对应的低代谢脑区为后顶叶、后扣带回及顶颞叶交界区,相关性良好。
年龄与tau蛋白沉积存在明显负相关,这使得年轻AD患者的tau负担大于LOAD患者[15]。多项研究证明,年轻AD患者可能表现出更广泛而严重的皮质tau摄取及更大的tau病理,且以后脑区域为主[5-6,9-10,15-16]。本研究中,患者1的tau沉积也以后联合皮层更为显著。这反映了年龄较小的AD患者病程更具侵袭性,因此,积累tau的速度更快,而AD发展较晚可能取决于多种病理机制[9,16]。
与tau相反,年龄与Aβ摄取无明显关系,可能原因为Aβ沉积在疾病早期就达到了一个平台期[17]。多项研究支持EOAD的Aβ沉积较LOAD更高,尤其在双侧丘脑及基底节区[3-4,11,18]。但Rabinovici等[19]却发现,PET上总Aβ负荷在EOAD组和LOAD组之间无明显差异,这可能是受到研究群体及方法学的异质性影响。
与Aβ相比,tau被认为与神经元丢失和突触功能障碍更直接相关,即与AD认知障碍关系更为密切,根据tau聚集模式估计的Braak分期与AD认知受损程度呈正相关[6,20]。本研究中,患者1的神经影像学提示患者有较明显的病理蛋白沉积,病情较为严重,但该患者的MMSE评分为26分,考虑与其学历较高(硕士学历)有关。有研究证实,教育是健康老龄化和AD中回顾性元记忆准确性的重要预测因素,较高水平的教育与较低的AD风险相关[21]。此外,一项纵向随访研究也显示,教育程度是EOAD疾病进展的独立预测因素[22]。Clarfield[23]发现了一种现象:AD的神经病理负担并不总是与认知障碍程度相关,在保持相同的临床状态下,患病前教育水平较高的患者比教育水平较低的患者具有更严重的神经病理学变化。其原因为教育水平高的患者大脑中具有更大的“认知储备”[23],即高教育水平的患者可能具有更多的突触密度或神经元,以及更高的损伤阈值,这样就有更长的时间来补偿神经病理损害的影响,延迟AD临床症状的出现,而当损伤达到晚期、无法再进行补偿时,患者才被诊断为AD,此时,患者的病理学积累更深入,认知恶化的速度更快。“认知储备”假说已经在基于临床和基于人群的研究中得到验证[22-25]。本研究的患者1也支持“认知储备”假说,当高学历掩盖了认知障碍的症状时,tau PET成像能更真实地反映神经病理学,从而反映AD真正的严重程度。
本研究局限性在于:样本量少,结果缺乏客观和准确性;患者1虽无明确家族痴呆史,但未行全基因测试,缺乏关于基因突变的信息,尚不能完全排除基因突变的可能性。
综上所述,多探针多模态PET/MR成像可作为高学历EOAD诊断及病情评估的有力工具。高教育水平可能会掩盖EOAD患者的临床症状,而tau PET成像能够更加真实地反映疾病的严重程度,对患者的病情作出更加客观的评估。
