新规程施行后的冷沉淀凝血因子质检结果分析
2022-02-23安蓬蓬李浩泷纪蓉蓉刘军
安蓬蓬,李浩泷,纪蓉蓉,刘军
(天津市血液中心,天津 300110)
冷沉淀凝血因子是采用特定的方法将保存期内的新鲜冰冻血浆在1~6℃融化后,分离出大部分的血浆,并将剩余的冷不溶解物质在1 h内速冻呈固态的成分血[1]。冷沉淀凝血因子含有丰富的凝血因子Ⅷ、血管性血友病因子(vWF)以及纤维蛋白原(FIB),临床上广泛应用于甲型血友病、血管性血友病以及纤维蛋白原缺乏等疾病的治疗[2]。《血站技术操作规程(2019版)》对冷沉淀凝血因子的制备方法(离心法)做了新的规定,为保障冷沉淀凝血因子的质量,笔者随即对我单位自2019年9月1日起制备的冷沉淀凝血因子进行抽检和结果分析,报告如下。
1 材料与方法
1.1 材料 2019年9月1日起,我单位成分科按《血站技术操作规程》(2019版)制备的冷沉淀凝血因子中,随机抽检480袋,均由采血时间≤13 min的400 mL全血于6 h内分离出的新鲜冰冻血浆制备,外观正常,均进行容量检测,其中48袋另外检测纤维蛋白原含量、Ⅷ因子含量和无菌试验;汇总2018年9月至2019年8月之间,我单位质管科的48袋冷沉淀凝血因子的质检记录,统计纤维蛋白原含量、Ⅷ因子含量。
1.2 仪器 电子天平(北京赛多利斯科学仪器有限公司);CS-2000i全自动凝血分析仪(上海希森美康医用电子有限公司);BacT/ALERT 3D全自动细菌分枝杆菌培养检测系统(生物梅里埃美国股份有限公司)。
1.3 试剂 活化部分凝血活酶时间试剂盒(批号:557295A);纤维蛋白原测定试剂(批号:547578);正常范围定值质控血浆(批号:507765A);因子Ⅷ活性测定试剂盒 (批号:547689A);缓冲液 (批号:554667);氯化钙溶液(批号:563802);清洗液(批号:A9082),以上试剂均为Siemens Healthcare Diagnostics Products GmbH生产。
1.4 冷沉淀凝血因子制备方法(离心法) 取出待制备冷沉淀的新鲜冰冻血浆,在1~6℃水浴装置中融化;当血浆基本融化时,在2~6℃的环境下重离心;将大部分上层血浆移至空袋,制成去冷沉淀的冰冻血浆;将留下的40~50 mL血浆与沉淀物混合,制成冷沉淀凝血因子;冷沉淀凝血因子在制备后1 h内完成速冻[3]。
1.5 冷沉淀凝血因子质检方法 用电子天平称量冷沉淀凝血因子重量并计算血容量;Ⅷ因子含量和纤维蛋白原含量用全自动凝血分析仪检测;无菌试验由全自动细菌分枝杆菌培养检测系统检测。
1.6 统计学 处理方法应用SPSS 24.0统计软件进行统计分析。计算样本中容量、纤维蛋白原含量、Ⅷ因子含量的总体水平95%置信区间(95%CI),分别与GB18469-2012《全血及成分血质量要求》中标准值进行比较;按新、旧规程制备的两组冷沉淀凝血因子的数据间比较采用t检验。
2 结果
2.1 见表1—2。

表1 按新规程制备的冷沉淀凝血因子质检结果
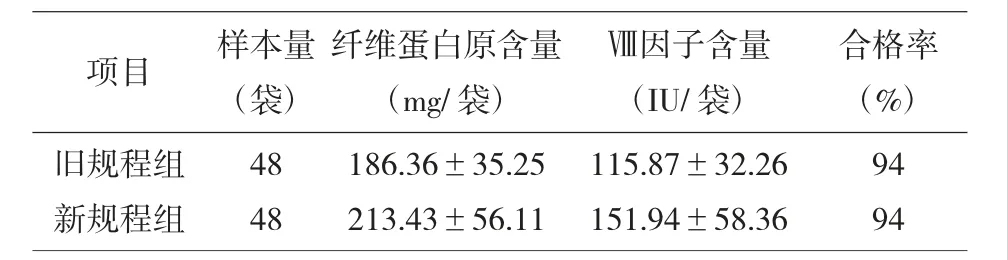
表2 两组冷沉淀凝血因子的纤维蛋白原含量和Ⅷ因子含量比较
2.2 新规程组480袋冷沉淀凝血因子中,容量检测合格率为98%,低于40 mL的有7袋,高于50 mL的有5袋;48袋冷沉淀凝血因子中,纤维蛋白原含量、Ⅷ因子含量,检测合格率94%;不合格3袋,不合格原因一袋为纤维蛋白原含量偏低(127.70 mg),两袋为Ⅷ因子含量偏低(67.60 IU、72.10 IU)。旧规程组48袋冷沉淀凝血因子中,纤维蛋白原含量、Ⅷ因子含量,检测合格率94%;不合格3袋,不合格原因一袋为纤维蛋白原含量偏低(114.60 mg),两袋为Ⅷ因子含量偏低(57.80 IU、56.30 IU)。
3 讨论
《血站技术操作规程》(2019版)将离心法制备冷沉淀凝血因子时,冷沉淀凝血因子中的血浆容量由原来的20~30 mL[4]变为40~50 mL[3],与虹吸法制备冷沉淀凝血因子时,冷沉淀凝血因子中的血浆容量进行了统一[3]。我单位使用离心法和全自动血液成分分离机制备冷沉淀凝血因子,自2019年9月1日起,成分科及时对全自动血液成分分离机的设置参数进行了修改,以确保冷沉淀凝血因子的血浆容量与新规程要求一致。
GB18469-2012对冷沉淀凝血因子的质控项目和要求见表1。其中容量要求为标示量(mL)±10%,没有给出确切范围,因此我单位冷沉淀凝血因子的容量一直以《血站技术操作规程》中的相关规定为标准。新规程规定冷沉淀凝血因子的血浆容量为40~50 mL,未算上其中沉淀物的体积,我单位制备的冷沉淀凝血因子容量总体水平95%CI为39.36~50.10 mL,基本符合要求;尽管如此,由于GB18469-2012中对冷沉淀凝血因子的纤维蛋白原含量、Ⅷ因子含量的要求均与容量有关,而且,冷沉淀凝血因子在临床上特别适用于难以给予大量的FFP(防止发生循环超负荷)来提供足量的凝血因子的患者,更多的是配合性输注[5],因此,建议成分科从分离机参数设置及工作人员的标准操作方面进一步要求细化,确保冷沉淀凝血因子的容量在合格范围。
《血站技术操作规程(2019版)》在6.2.5.1中指出,血液抽检结果分析时,对由于献血者个体差异引起的,且不影响血液安全性的指标,如果检查符合率≥75%,可认为血液采集、制备和储存等过程受控。个体因素对冷沉淀凝血因子质量的影响需引起重视,在随机抽检的新规程组48袋冷沉淀凝血因子中,有一袋纤维蛋白原含量偏低。纤维蛋白原性质较稳定,只要样本不与玻璃表面接触,纤维蛋白原被激活变为纤维蛋白的可能性很小,同时,纤维蛋白原含量与献血者性别、年龄等个体因素有关,有研究表明[6],在所调查的献血人群中,纤维蛋白原含量在女性中高于男性,>30岁组明显高于<30岁组。Ⅷ因子是不稳定凝血因子,在献血员个体因素方面,除与纤维蛋白原有上述相同分布规律外,相较于其他三种血型,B型冷沉淀凝血因子中Ⅷ因子含量最高[6];除外个体因素,由于Ⅷ因子在体外半衰期较短,活性易丧失,制备冷沉淀凝血因子过程中任何一个环节的误差均会影响Ⅷ因子含量:400 mL全血采集时间控制在13 min内,采集后储存于冷藏环境中;我单位在6 h内完成血浆分离并速冻;制备冷沉淀凝血因子时,新鲜冰冻血浆在1~6℃水浴装置中融化,在2~6℃环境下重离心,冷沉淀凝血因子在制备后1 h内完成速冻,在60 min内将中心温度降至-30℃以下。由此可见,整个制备过程中的时间和温度是影响冷沉淀凝血因子质量的关键因素,建议优化工作流程,尽量缩短制备时间,同时进一步严格控制储存、运输及分离的温度,以及速冻、融化的温度,以确保冷沉淀凝血因子质量符合临床需要。最后,本研究中使用的CS-2000i全自动凝血分析仪准确性、精密性良好,对冷沉淀制品中纤维蛋白原含量与Ⅷ因子含量的检测结果可靠[7];在质量抽检时,也应严控冷沉淀凝血因子的融化、取样时间;检测纤维蛋白原含量与Ⅷ因子含量的试剂在使用前应在室温平衡30 min,缓冲液、氯化钙溶液和清洗液开瓶后使用时间不得超过8周,使用新批号的试剂时需重新定标等。进一步规范试验操作,避免因此造成的检测误差。
在两组冷沉淀凝血因子的纤维蛋白原含量与Ⅷ因子含量比较中,与旧规程组相比,新规程组的纤维蛋白原含量和Ⅷ因子含量的标准差均较高,这与新规程提高了冷沉淀凝血因子的血浆容量有关;与旧规程组相比,新规程组的Ⅷ因子含量较高,一方面由于Ⅷ因子不稳定且与献血员个体因素密切相关,另一方面,也与新规程施行后,我单位的冷沉淀凝血因子制备流程更优化,人员操作更规范有关。
为了保证冷沉淀凝血因子的质量,工作人员在制备过程中应严格遵守操作规程,不断提高技术水平;同时,质控人员在检测时应更加细致操作,以避免误差。通过对480袋冷沉淀凝血因子进行质量抽检,我中心按《血站技术操作规程(2019版)》制备的冷沉淀凝血因子符合GB18469-2012《全血及成分血质量要求》的相关规定,冷沉淀凝血因子质量安全有效。
