紫檀芪对脓毒症大鼠炎性反应与心脏动作电位的抑制与调节作用
2022-02-23肖语童肖如红
肖语童,肖如红
(1.岳阳市一人民医院电生理科,湖南 岳阳 414000;2.岳阳市一人民医院麻醉科,湖南 岳阳 414000)
脓毒症是一种是由感染引起的全身炎性反应综合征,可发展为感染性休克和多器官功能障碍综合征,可危及生命。炎性细胞的活化和大量炎性介质的产生导致脓毒症发病过程中多器官的损伤,功能障碍甚至衰竭[1]。具体来说,各种研究表明脓毒症患者的不良症状与心肌功能障碍的发生密切相关,其中约50%的脓毒症患者表现出心肌功能障碍[2]。此外,同时患有脓毒症和心功能不全的患者死亡率从20%~30%显著增加到70%~90%[3]。因此,针对心功能不全和心脏损伤可能是预防和治疗脓毒症的一种新策略。
紫檀芪(PTS)是一种与白藜芦醇结构类似的抗毒性物质,主要存在于蓝莓、葡萄和花生等植物中。近年来报道表明,PTS具有多种生物活性,包括抗炎、抗氧化、抗衰老和抗病毒活性等[4]。此外,PTS还能介导细胞周期、凋亡和增殖[5]。然而,PTS在脓毒症中的作用,尤其是PTS控制交感神经过度刺激对脓毒症期间心脏动作电位的影响尚未见报道。为此,本研究拟探讨PTS在脓毒症致大鼠心肌损伤中的作用,并初步探讨其可能作用机制。
1 资料与方法
1.1实验动物及材料:无特异性病原体(SPF)雄性Sprague-Dawley大鼠,体重200~250 g,购自中科院上海实验动物中心(合格证书编号:44002100014706),饲养于中南大学实验动物中心,大鼠可以自由获取食物和水,并在室温和50%~65%相对湿度下保持12 h的光/暗循环。PTS(纯度99%)购自上海义森生物科技有限公司;TNF-α、IL-6、IgE测定试剂盒(ELISA)购自美国Pierce公司;CK-MB测定试剂盒(ELISA)购自美国Abcam公司。本次研究经过本院医学伦理委员会同意。
1.2脓毒症模型及分组:大鼠被随机分成三组(n=10):假手术组、脓毒症组和PTS组。脓毒症组和PTS组大鼠均行盲肠结扎穿刺术诱导盲肠坏死脓毒症模型[6]。大鼠禁食12 h后腹腔注射1%戊巴比妥钠(50 mg/kg)用于手术前麻醉,常规消毒后沿腹中线做2 cm切口,在盲肠总长度一半的距离处,用18号注射针头在肠系膜缘和系膜对侧缘方向各穿孔1次,然后轻轻按压盲肠,肠内容物被轻轻压入腹腔,恢复盲肠正常解剖部位,逐层缝合切口,立即皮下注射无菌生理盐水(3 ml/100 g)以补偿体液流失。假手术组大鼠进腹定位盲肠后,但未穿孔盲肠。
手术前30 min,PTS组大鼠接受PTS腹腔注射(25 mg/kg)1次,假手术组和脓毒症组大鼠腹腔注射等量的无菌生理盐水,每6小时监测一次,连续观察24 h。24 h后通过腹腔注射戊巴比妥对所有存活大鼠实施安乐死,随后采集血液,分离和冷冻血清,并固定左心室标本进行下一步检测。
1.3心室动作电位持续时间检查:使用1%戊巴比妥钠(50 mg/kg)麻醉大鼠。打开胸腔取出心脏,用Langendorff灌注液(NaCl 118.5 mmol/L,KCl 4.7 mmol/L,CaCl22.5 mmol/L,NaHCO325 mmol/L,MgSO41.2 mmol/L,KH2PO41.2 mmol/L,葡萄糖11 g,pH=7.4)进行心脏灌注。以1.5 ml/min的速度灌注心脏30 min,吸附电极分别贴于大鼠心房和心室表面。应用锦江电子LEAD-2000电生理仪(四川锦江电子科技有限公司)记录心房和心室局部组织的动作电位持续时间,记录心脏灌注指标,包括心率、心房、心室动作电位时间。在此过程中,温度控制在37℃以下,并使用5%CO2和95%O2的混合气体持续通气。
1.4组织病理学观察和心肌损伤评分(MDS):标本从左心室长轴垂直心尖连续切割。然后,将组织固定于4%多聚甲醛溶液中,对每个组织样本进行石蜡包埋,5 μm切片后使用苏木精/伊红染色,乙醇梯度脱水封闭后进行组织病理学观察。心肌损伤的严重程度根据半定量量表进行评估和分级,包括水肿、中性粒细胞浸润、出血和肌原纤维分布[7]。由两位对分组情况不详的病理学专家进行描述,严重程度表示为MDS。
1.5检测大鼠血清中TNF-α、IL-6、CK-MB以及IgE含量:按照相应ELISA检测试剂盒的操作说明分别检测血清中TNF-α、IL-6、CK-MB以及IgE含量。

2 结果
2.1各组大鼠一般情况:在CLP手术后6~8 h,存活大鼠均出现不同程度的脓毒症症状,如活动障碍、毛发竖立、呼吸短促、结膜下渗出和腹泻等。假手术组大鼠只表现出活动和进食减少,在6~12 h内恢复。假手术组大鼠全部存活,脓毒症组和PTS组分别有7只和8只存活至CLP术后24 h。
2.2心肌组织病理学观察及心肌损伤评分(MDS)半定量分析:对三组大鼠心肌组织进行病理学检测,假手术组大鼠心肌组织经苏木精/伊红染色后肌肉组织呈多边形粉红色纤维,肌肉纤维排列整齐紧凑,少有炎性细胞浸润。CLP术后24 h,脓毒症组大鼠心肌组织在镜下出现明显改变,肌肉组织排列紊乱,伴有大量炎性细胞浸润,细胞间隙增宽。PTS治疗可部分改善CLP后导致的病理改变,肌肉纤维排列相对规律,细胞间水肿和出血减轻,炎性细胞浸润明显减少。见图1A。半定量分析各组MDS结果表明,脓毒症组MDS评分高于假手术组,而PTS治疗后显著降低MDS评分,差异有统计学意义(P<0.05)。见图1B。
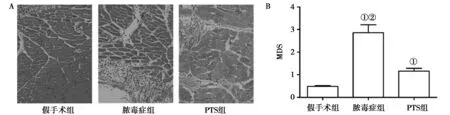
注:与假手术组比较,①P<0.05,与PTS组比较,②P<0.05图1 各组大鼠心肌组织病理学表现及MDS评分
2.3PTS对脓毒症大鼠心肌动作电位的影响:各组大鼠心电图数据,见图2A。脓毒症组大鼠心率较假手术组显著降低,差异有统计学意义(P<0.05),PTS对心率有改善作用,与脓毒症组相比,PTS组心率明显上升,差异有统计学意义(P<0.05)。见图2B。假手术组心房和心室动作电位时间明显短于脓毒症组,差异有统计学意义(P<0.05)。见图2C。PTS组心房和心室动作电位时间均明显长于CLP组,差异有统计学意义(P<0.05)。见图2D。然而,P、PR和QRS电位时间在PTS治疗前后无明显改变。
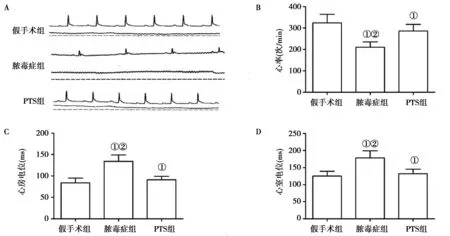
注:与假手术组比较,①P<0.05,与PTS组比较,②P<0.05图2 各组大鼠心电图、心率、心肌心房及心室组织动作电位时间指数比较
2.4PTS可显著降低CLP诱导的血清TNF-α、IL-6、CK-MB以及IgE水平:与假手术组大鼠相比,脓毒症组大鼠CLP术后24 h血清中TNF-α、IL-6、CK-MB以及IgE的含量显著升高,差异有统计学意义(P<0.05),而PTS治疗后血清中TNF-α、IL-6、CK-MB以及IgE的含量均明显降低,差异有统计学意义(P<0.05)。见图3。
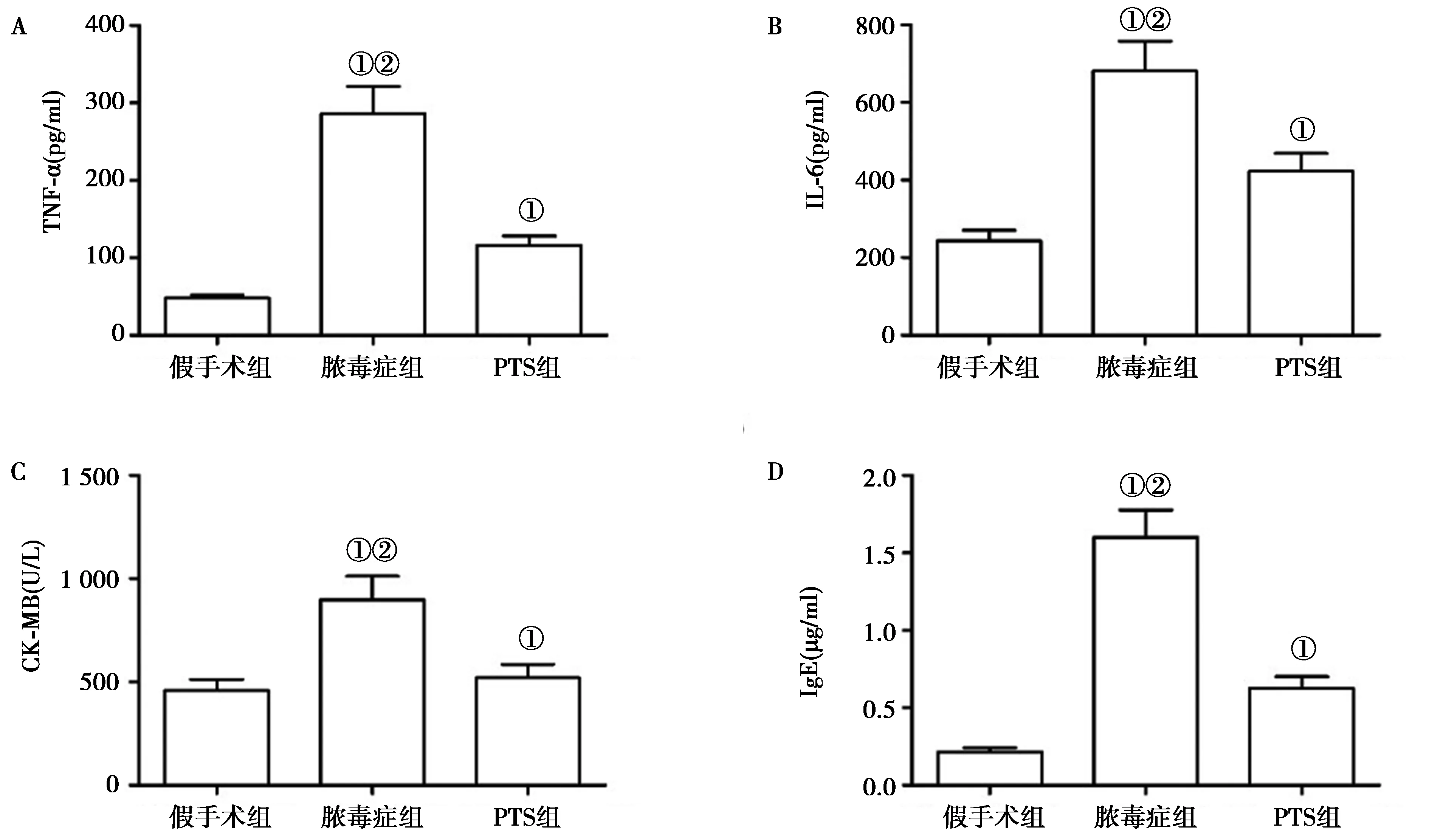
注:与假手术组相比,①P<0.05,与PTS组相比,②P<0.05图3 ELISA法测定各组大鼠血清TNF-α、IL-6、CK-MB及IgE含量
3 讨论
严重的脓毒症/感染性休克严重威胁着人们的生命和健康,仍然是一种死亡率高、病理生理学复杂的临床疾病。本研究建立大鼠脓毒症模型,观察PTS对脓毒症大鼠心肌功能的影响,结果表明PTS可减轻炎性反应以及调节心肌动作电位,从而表明,PTS可通过抑制脓毒症模型大鼠的炎性反应和调节心脏动作电位来抑制脓毒症。
CLP作为当前公认的大鼠脓毒症的金标准模型制作方法[8],脓毒症早期,机体内出现大量复杂的炎性因子,这些因子相互作用形成炎性反应瀑布效应,导致各种组织器官的损伤和功能障碍[9]。在本研究中,脓毒症模型表现出多种特征,包括动物行为、存活率、生理生化指标、器官超微结构和细胞因子水平,表明本研究CLP脓毒症模型的建立是成功的,与已发表论文的动物模型在细胞因子水平、脏器功能失调、超微结构和动物行为等方面是一致的[10]。具体而言,脓毒症组血清TNF-α和IL-6水平显著高于假手术组,这与临床和实验研究中脓毒症的促炎细胞因子风暴表型一致。当前对PTS的抗炎作用已有较为深入的研究[4],但PTS是否通过抗炎作用从而保护脓毒症大鼠心肌功能尚未见报道。在本研究中,PTS可降低全身促炎细胞因子的表达,同时在显微镜下观察到PTS可明显抑制炎性细胞在肌肉组织中浸润。此外,CLP术后大鼠心肌结构逐渐被破坏,并观察到不可逆的结构变化,同时伴随着血清中CK-MB的含量增高,CK-MB能特异反映心肌损伤,这与镜下观察到的心肌组织改变相吻合,PTS作用后可显著下调血清中CK-MB水平。
本研究发现脓毒症组血清IgE水平明显高于假手术组,与以往研究中IgE也参与炎性反应一致[11],说明脓毒症的炎性反应涉及多种炎性细胞和细胞成分,在不同的环节发挥着重要的作用。以往的研究中没有观察到IgE的原因可能有以下几点:一方面,IgE水平很低,常规方法很难检测到;另一方面,IgE在脓毒症中的作用往往被忽视。如当细菌和病毒侵入支气管上皮细胞造成损伤时,上皮细胞可产生IL-33,作用于肥大细胞、嗜酸性粒细胞、嗜碱性粒细胞和Th2细胞,促进其增殖和成熟,这些细胞产生更多的炎性因子,从而增加IgE的表达。胃肠黏膜也可能表现出IgE的增加,导致炎性反应的发生、发展和恶化。目前的研究结果表明,血清IgE水平可引起不同组织器官的炎性免疫反应,不仅是I型超敏反应,而且是免疫抑制性脓毒症所致心肌损伤的一个独立指标[12]。因此,IgE也可以作为脓毒症的一个新的生物标志物。在本研究中,PTS治疗后,明显缓解心肌损伤,同时脓毒症期间上调的IgE水平也得以下调。
在本研究中,脓毒症组的心率、心房和心室动作电位均出现明显异常,炎性反应与抗炎之间的不平衡,免疫功能紊乱,胆碱能抗炎系统激活,迷走神经传入感觉,炎性反应信号从中枢传递到脑干,在中枢神经系统中进一步处理,动作电位通过传出迷走神经传出,传出迷走神经对紊乱状态进行炎性反应调节,从而降低心率,延长心房和心室动作电位时间。而PTS可明显缓解迷走神经的抗炎作用,从而调节心率和房室动作电位异常。
总之,PTS通过抑制脓毒症模型大鼠的炎性反应和调节心脏动作电位来抑制脓毒症,从而证实了PTS在脓毒症中的心肌保护作用及其可能相关机制,为脓毒症的防治提供了新的思路。
