全模型迭代重建技术在脑部CT图像中的应用研究
2022-02-23付永春陈红燕陈绪珠
付永春,江 滨,陈红燕,陈绪珠
(1.首都医科大学附属北京天坛医院放射科,北京 100070;2.北京市神经外科研究所神经流行病学室,北京 100070)
0 引言
CT是临床上常用的影像学检查手段,对诸多疾病均具有较高的诊断价值[1-2]。目前,我国脑梗死的发病率居全球第一,已成为健康的第一杀手,该病具有高发病率、高致残率、高复发率和高致死率的特点,而急性脑梗死的诊断主要依靠脑部CT检查[3]。随着CT检查频率持续增加,随之带来的是患者辐射剂量的增加和致癌风险的提高,这些与健康密切相关的问题越来越受到公众的普遍关注[4]。因此,如何优化CT检查的扫描方案,在不影响图像质量的前提下,尽量降低患者的辐射剂量已成为当前学者重点关注的问题。
全模型迭代重建(iterative model reconstruction,IMR)技术可显著降低图像噪声,提高图像的低对比分辨力,尤其在细小病灶的检出方面具有显著优势[3]。与混合迭代重建iDose4技术及传统滤波反投影(filtered back projection,FBP)技术相比,IMR技术在降低图像噪声、提高图像质量等方面效果显著[4-5]。IMR-1(level 1)、IMR-2(level 2)和IMR-3(level 3)3种IMR方式的图像质量在理论上均明显优于低剂量和标准剂量的FBP和iDose4。近几年也有相关报道[5],但对于脑部CT图像质量的研究较少,探讨IMR密度分辨力以及针对诊断任务评判图像质量已成为当前临床研究的热点。本研究旨在探究不同级别IMR技术对脑部CT图像质量和噪声的影响,找到在同等摄影条件下能够取得脑部扫描最佳图像质量的迭代重建级别,为临床提供高质量的图像。
1 资料与方法
1.1 一般资料
回顾性分析2020年1—4月在首都医科大学附属北京天坛医院就诊的接受脑部CT平扫的36例患者的临床资料,其中男17例、女19例,年龄21~90岁,平均年龄(48.39±21.16)岁。纳入标准:临床表现为头晕、头痛、晕厥等的患者。排除标准:CT诊断为颅内肿瘤、脑出血、脑萎缩及其他原因导致脑组织结构严重变形的患者;颅内有金属植入物者;如运动等其他原因造成的CT图像有严重伪影的患者。
1.2 仪器与方法
采用Philips Brilliance 256 iCT螺旋CT扫描仪。扫描参数:管电压120kV,管电流310mAs,层厚5 mm,矩阵512×512,扫描野根据患者头型进行具体选择。扫描结束后分别进行FBP(重建滤过器:Standard)、iDose4和IMR-1(level 1)、IMR-2(level 2)、IMR-3(level 3)薄层重建,重建层厚和层间距均为1 mm,窗宽均为100 HU,窗位均为35 HU。
1.3 图像质量评价
1.3.1 客观评价
在上述5组重建图像上的脑灰质和脑白质较好的区域放置形状和大小一致的3处感兴趣区(region of interest,ROI),测量其CT值及标准差(SD值),每个ROI测量3次,以SD值为图像噪声,取其平均值为最后结果,并分别计算各图像的信噪比(signal-tonoise ratio,SNR)和对比噪声比(contrast-to-noise ratio,CNR)。
1.3.2 主观评价
由2位具有10 a以上神经系统影像诊断经验的主治医师采用盲法对图像进行分析,并进行主观评价。评定标准:(1)1分,好:脑灰、白质显示好且界限分明,灰质核团与周围组织结构对比度好,图像噪声微小,图像质量佳。(2)2分,较好:脑灰、白质显示较好且界限较清晰分明,灰质核团与周围组织结构对比度一般,图像噪声较小,图像质量较好。(3)3分,差:脑灰、白质显示欠清且界限不清,灰质核团与周围组织结构对比度欠佳,图像噪声较大,图像质量一般,但不影响诊断。(4)4分,无法诊断:脑灰、白质界限无法分辨,灰质核团与周围组织结构对比度差,图像噪声大,图像质量差,无法诊断。取2位医师评分的均值进行分析。
1.4 统计学方法
采用IBM SPSS Statistics 21.0统计分析软件进行数据分析。符合正态分布的计量资料采用表示。以FBP重建图像为参考标准,采用单因素方差分析比较各重建图像的客观评价及主观评分的差异,两两比较采用LSD-t(方差齐)或Dunnett’s T3(方差不齐)方法。以Kappa检验分析2名医师评估图像质量主观评分的一致性:Kappa值≤0.40为一致性较差,0.40<Kappa值≤0.75为一致性中等,Kappa值>0.75为一致性较好。P<0.05为差异有统计学意义。
2 结果
2.1 图像质量客观评价
各重建组ROI的CT值及SD值显示正态分布特征,方差不齐(P<0.05)。其中单因素方差分析显示各重建组测量点CT值差异无统计学意义(F=1.01,P=0.41),对SD值进行Dunnett’s T3两两比较,结果显示IMR-1、IMR-2和IMR-3组间差异均具有统计学意义(P均<0.05),并且随着降噪级别的改变,SD值呈逐渐降低趋势。同时,SNR也呈现正态分布,方差不齐(P均<0.05)。其中,单因素方差分析显示各组测量点SNR差异无统计学意义(F=0.99,P=0.42)。Dunnett’s T3两两比较iDose4与IMR之间差异具有统计学意义(P均<0.05),且与降噪级别成正比关系。5组重建图像SD值差异有统计学意义(F=237.13,P<0.01),CT值及SNR差异均无统计学意义(P均>0.05),见表1。IMR图像质量评分总体优于FBP和iDose4,可以显著降低图像噪声和提高SNR,从而提高图像质量。IMR组各层级小组(IMR-1、IMR-2和IMR-3)间测量 结果:(1)3组中IMR-1的脑灰、白质的SD值最小,SNR和CNR最高。3组SD值差异具有统计学意义(F=98.75,P<0.05)。两两比较,IMR-1与IMR-2间差异具有统计学意义(Z=5.61,P<0.05),IMR-1与IMR-3间差异具有统计学意义(Z=8.34,P<0.05),IMR-2与IMR-3间差异具有统计学意义(Z=13.82,P<0.05)。(2)用SNR评价图像质量,结果显示IMR-1的SNR最大,IMR-3的SNR最小。3个层级组间比较,差异有统计学意义(F=13.58,P<0.05)。再进一步两两比较,IMR-1与IMR-2比较(Z=5.86,P<0.05),IMR-1与IMR-3比较(Z=8.22,P<0.05),IMR-2与IMR-3比较(Z=13.079,P<0.05),差异均具有统计学意义。(3)3组间的CNR比较显示,IMR-1与IMR-2比较(Z=8.26,P<0.05),IMR-1与IMR-3比较(Z=8.12,P<0.05),IMR-2与IMR-3比较(Z=13.77,P<0.05),差异均具有统计学意义。综合比较显示,IMR-1重建图像效果最佳。详见表2。
表1 各重建组CT值、SD值和SNR比较结果
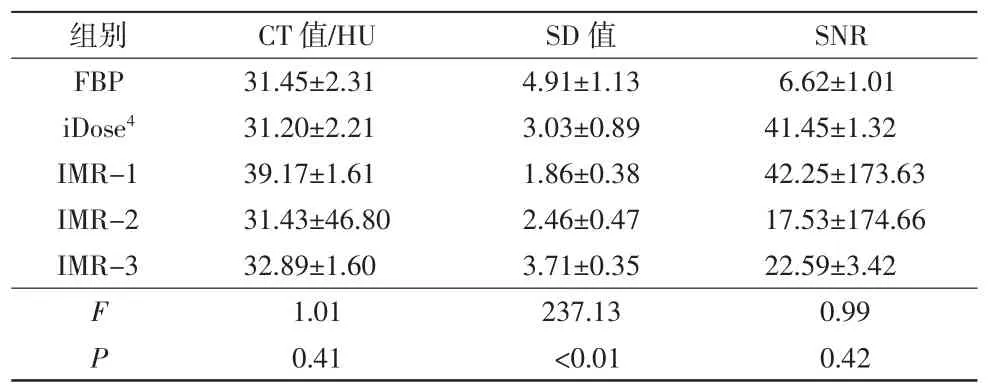
表1 各重建组CT值、SD值和SNR比较结果
组别 CT值/HU SD值 SNR FBP 31.45±2.31 4.91±1.13 6.62±1.01 iDose4 31.20±2.21 3.03±0.89 41.45±1.32 IMR-1 39.17±1.61 1.86±0.38 42.25±173.63 IMR-2 31.43±46.80 2.46±0.47 17.53±174.66 IMR-3 32.89±1.60 3.71±0.35 22.59±3.42 F 1.01 237.13 0.99 P 0.41 <0.01 0.42
表2 IMR组各层级组间的图像质量比较结果
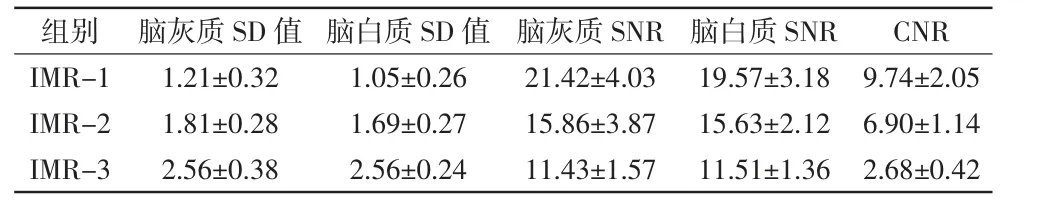
表2 IMR组各层级组间的图像质量比较结果
组别 脑灰质SD值 脑白质SD值 脑灰质SNR脑白质SNR CNR IMR-1 1.21±0.32 1.05±0.26 21.42±4.03 19.57±3.18 9.74±2.05 IMR-2 1.81±0.28 1.69±0.27 15.86±3.87 15.63±2.12 6.90±1.14 IMR-3 2.56±0.38 2.56±0.24 11.43±1.57 11.51±1.36 2.68±0.42
2.2 图像质量主观评价
2名医师对FBP、iDose4、IMR-1、IMR-2、IMR-3 5组重建图像质量的主观评价一致性中等至较好(Kappa值分别为0.611、0.916、0.889、0.679、0.512,P均<0.001)。5组重建图像质量主观评分差异有统计学意义(F=289.68,P<0.01),见表3。与常规FBP和iDose4重建图像相比,IMR-1图像质量更佳,如图1所示。通过主观评分显示,经过IMR重建的图像质量优于FBP和iDose4。通过各组数据两两主、客观比较显示:IMR与FBP、iDose4相比,可显著降低脑组织的图像噪声,提高图像质量,以IMR-1效果最佳。
3 讨论
随着计算机技术的迅速发展,迭代重建技术已被广泛应用于临床,尤其在头颈部成像方面效果显著[6-7]。IMR可显著降低脑灰、白质和脑组织的图像噪声,提高图像质量[8-9]。可根据患者的个体差异及所患疾病的特点,采用适合于个体的最优化组合参数,兼顾患者的防护准则,重建出更加符合临床疾病诊断需求的图像。传统的重建技术FBP重建速度虽然快,但是计算误差也相对较大,很大程度上阻碍了辐射剂量的降低。因其未考虑系统统计噪声模型,FBP技术具有一定的局限性,难以去除各种低光子形成的伪影,如条带状伪影或偏心性伪影等。iDose4技术是在FBP技术扫描的基础上,在投影数据空间和图像数据空间进行迭代重建的数据处理方法[10-11],其降低噪声的作用优于FBP技术[12]。综合统计显示,IMR噪声模型的数学算法更复杂且更准确[13-14]。在头颈部CT检查中,IMR技术的绝对噪声水平较FBP技术及iDose4更低。Niesten等[15]发现IMR技术在降低头颈部图像的噪声、辐射方面均优于FBP技术和iDose4重建,与本文结果一致。CT图像层厚与噪声呈负相关,即层厚越薄图像越能显示更多病灶细节,层厚较厚图像易遗漏病灶。相对而言,薄层图像噪声会降低其图像质量,掩盖病灶。而显微CT的IMR技术摆脱了薄层图像与图像噪声的线性关系,有效降低了薄层图像噪声对图像质量的影响。IMR技术为脑部CT提供了独特的优势,与FBP技术相比,IMR图像的噪声能降低到56%,实现最大的降噪百分比[16]。IMR技术在降低噪声和减少伪影的同时提高了低对比度组织的检出率[17-18]。同时,IMR技术能显著提升图像的空间、密度及软组织分辨力,降低辐射剂量,提高重建速度[19-20]。IMR技术在提升图像质量的同时节省了时间成本和人力成本。
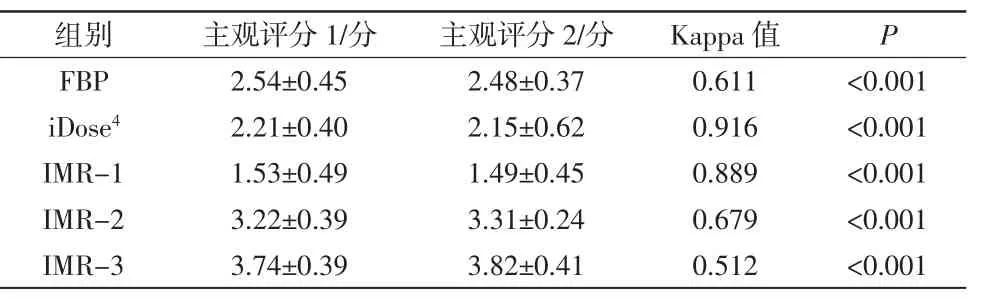
表3 各重建组图像质量主观评分对比分析结果
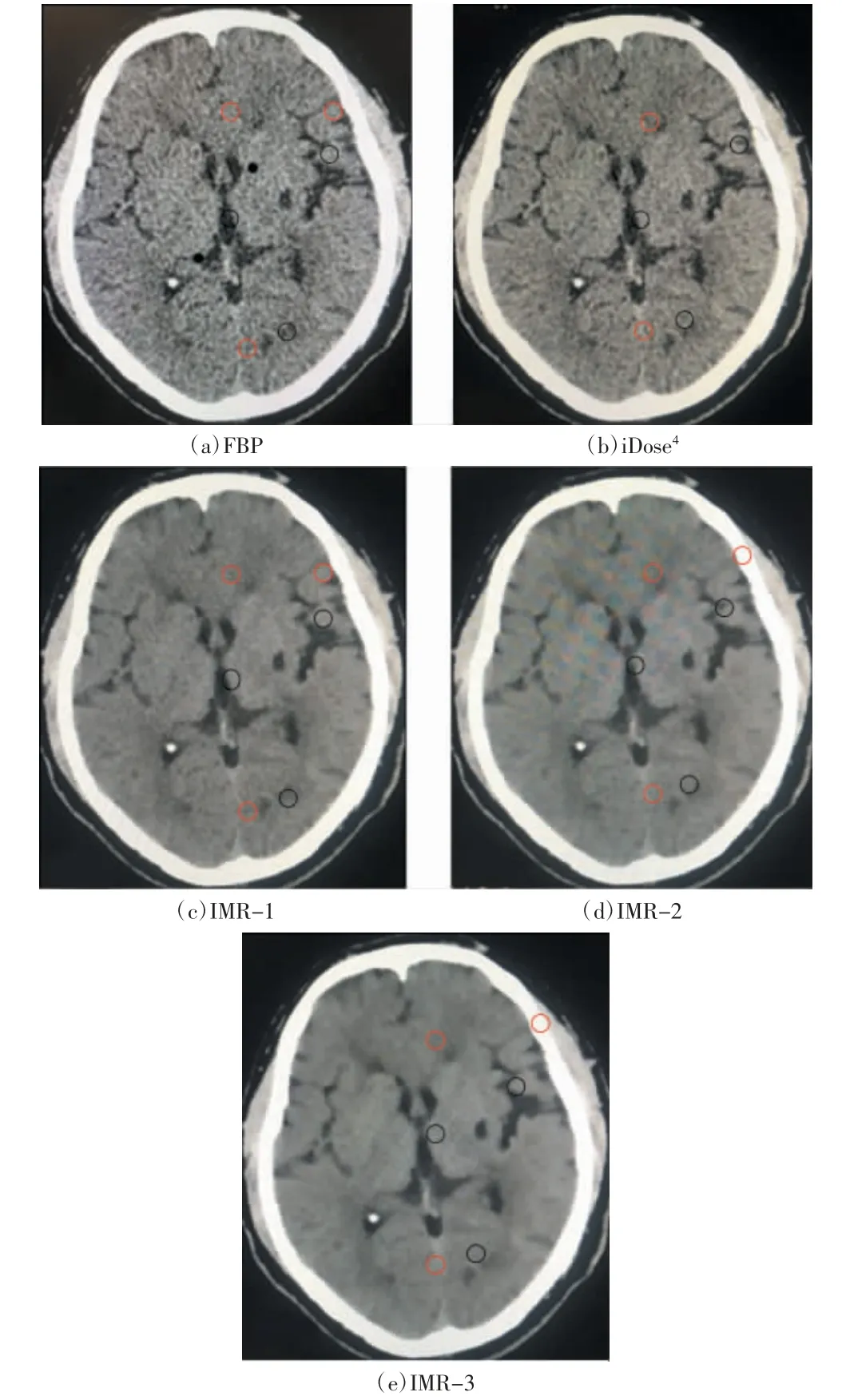
图1 5组重建图像
IMR技术根据降噪阈值及优化算法不同,设置3个级别(IMR-1、IMR-2与IMR-3)。级别越高,噪声降低越明显,图像SNR和CNR越高。本研究结果显示:在相同的扫描条件下,IMR-1及IMR-2图像噪声均低于iDose4和FBP重建图像。在不改变扫描设置的条件下,IMR技术使得原始数据随着重建算法、重建层厚和重建级别的变化,能提供给阅片医师诊断时更丰富的影像参数对比,从而提高鉴别诊断的能力,减少漏诊率。
本研究表明,在3组IMR算法的比较中,随着IMR不同级别间的切换,图像的SD值呈现逐渐增加、SNR逐渐降低的趋势,图像质量的主观评分也呈一致性提高,与文献[21-22]的研究结果一致。IMR-2和IMR-3组虽然图像噪声与iDose4和FBP重建图像相近,但是图像显示有失真,存在“蜡样”伪影,与樊荣荣等[23]的研究结果一致。IMR技术通过有效降低图像噪声和增加低密度组织的对比度,能清晰显示病变内不同强化程度的组织结构,为临床提供更多的诊断信息。通过主、客观数据分析,在所有的主观评估特征中,IMR技术均优于FBP和iDose4。客观评价结果显示,IMR-1、IMR-2的图像噪声显著低于iDose4,IMR、iDose4及FBP所重建图像的空间分辨力几乎相同。5组两两相比较IMR-1(level 1)显示最佳,可显著降低脑组织的图像噪声,提高图像质量;病灶的检出率更高,同时薄层图像也可以很好地应用于日常临床诊断。但本研究也存在一些不足:样本量较小,没有对辐射剂量的影响进行对照研究。
总之,IMR技术能够在不改变扫描设置的情况下,大幅降低图像噪声,提高SNR和CNR,其中IMR-1级别的重建图像效果最佳。根据临床诊断需要将IMR-l同图像层厚进行相应匹配设置,应用在临床诊断中,可以得到质量更好的脑部CT扫描重建图像,同时拓展了临床医师的诊断思路,并提高了对微小病灶的检出率,值得推广。
