多脏器联合超声对机械通气患者撤机的预测价值研究
2022-02-23钱志伟郑丽环靳孟孟
钱志伟,郑丽环,靳孟孟
(邯郸市第一医院,河北邯郸 056000)
0 引言
机械通气能改善肺通气功能、提供氧合和呼吸支持,在挽救危重患者中发挥着重要的作用[1]。但当患者机械通气的病因得到控制时,须及时撤机。机械通气时间过长会造成呼吸机相关性肺炎、呼吸机相关性肺损伤和膈肌功能障碍等,同时患者死亡率也会上升[2]。而过早的撤机会因再次插管、机械通气,同样造成患者死亡率增高。近年来的研究证实,肺部超声、心脏超声、膈肌超声可预测撤机结果[3-5],而危重患者是一类特殊群体,其心肺、膈肌可能同时受累,因此单一脏器超声检测预测撤机结果可能存在偏差。本研究旨在评估多脏器联合超声对机械通气患者撤机结果的预测价值。
1 资料与方法
1.1 资料
选取2019年6月至2020年6月收治于邯郸市第一医院重症医学科且机械通气时间超过48 h的患者。共入组62例机械通气患者,其中男性39例、女性23例,平均年龄(65.98±9.35)岁;重症肺炎患者16例,外科术后患者15例,心力衰竭患者12例,多脏器功能衰竭患者10例,其他患者9例。本研究经医院伦理委员会批准,并获得患者或家属的书面知情同意。
入选标准:年龄≥18岁;机械通气时间>48 h;导致机械通气的病因得到控制;通过撤机筛查[6]。其中,通过撤机筛查应满足以下条件:(1)氧合指标:氧分压[pa(O2)]>50 mmHg(1 mmHg=133.32 Pa),吸入气中的氧气体积分数(FiO2)≤0.4,呼气末正压(positive endexpiratorypressure,PEEP)≤5cmH2O(1cmH2O=98.06Pa),pa(O2)/FiO2≥200;(2)血流动力学稳定,没有使用或使用低剂量血管活性药物[多巴胺或多巴酚丁胺<5 μg/(kg·min)或去甲肾上腺素<0.05 μg/(kg·min)];(3)有自主呼吸的能力和足够的咳嗽、咳痰能力;(4)体温<37.3°C。
排除标准:孕妇;气管切开;胸腔积液、气胸或纵隔气肿、胸腔闭式引流;因手术或外伤,胸部无法获得超声切面;任何神经肌肉疾病、膈肌麻痹、颈髓损伤病史;在研究前48 h内使用神经肌肉阻滞剂的患者。
1.2 方法
超声采用索诺声M-Turb型彩色多普勒超声诊断仪,配备心脏相控阵探头、腹部凸阵探头及浅表高频探头。肺部超声、心脏超声、膈肌超声数据在自主呼吸试验(spontaneous breathing trial,SBT)开始前30 min进行采集,每个部位测量3次取平均值。超声测量由1名具有超声资质的医生完成。
1.2.1 肺部超声
患者采用平卧位,超声使用B模式下2~4 MHz的凸探头,对两侧肺共8个区域进行超声检测,8个区域包括两侧前胸壁和侧胸壁的上下2个部分。肺部超声评分(lung ultrasound score,LUS):(1)正常通气区(N):肺滑动征伴A线或少于2个单独的B线;(2)中度肺通气减少区(B1):多发、典型的B线;(3)重度肺通气减少区(B2):多发融合的B线;(4)肺实变区(C):组织影像伴典型的支气管充气征。N为0分,B1为1分,B2为2分,C为3分,每个区域以最严重的表现评分,8个区域评分的总和为LUS,总分在0~24分(如图1所示)。
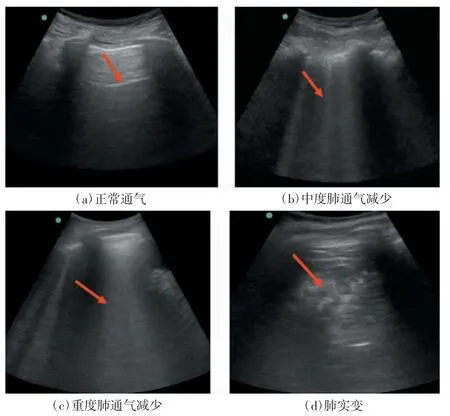
图1 LUS评分标准
1.2.2 心脏超声
患者取平卧位或左侧卧位,超声显示四腔心、五腔心、左心长轴、大动脉根部短轴、剑突下等常规切面,排除有心脏结构性病变的患者;在心尖四腔心切面下通过左房室瓣血流多普勒模式测量舒张早期左房室瓣血流速度E(如图2所示);后切换为组织多普勒模式,于左房室瓣环处测量舒张早期左房室瓣环运动速度e′(如图3所示),计算E/e′。

图2 血流多普勒模式下测量舒张早期左房室瓣血流速度
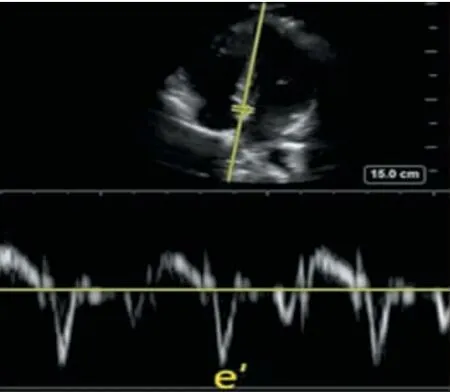
图3 组织多普勒模式下测量舒张早期左房室瓣环运动速度
1.2.3 膈肌超声
患者半卧位(床头抬高30°~45°),用3~5 MHz US探头M模式测量右侧膈肌运动,记录膈肌位移。探头放于右腋前线或锁骨中线与肋缘交界处,探头标志朝向外下方,在2D模式下找到需要测量的膈肌,选择M模式,将采样线垂直于膈肌,在平静呼气末与最大吸气末标记膈肌上下移动位置,两点垂直距离即为膈肌位移(diaphragmatic displacement,DD),其测量方法如图4所示。同时记录患者呼吸频率(respiratory rate,RR),根据测量结果计算膈肌呼吸浅快指数(diaphragmatic rapid shallow breathing index,DRSBI),DRSBI=RR/DD。

图4 DD测量方法
1.3 观察指标
对符合上述入组标准的患者进行SBT。SBT采用T管进行持续吸氧,维持120 min,SBT结束后呼吸平稳、生命体征稳定的患者,予以撤机拔管。撤机成功指撤机拔管后自主呼吸时间超过48 h,撤机失败指SBT失败或撤机拔管后48 h内再次插管或使用无创呼吸机。患者符合下列任何一项情况则认为撤机失败:(1)呼吸频率>35次/min或<8次/min;(2)血氧饱和度(SaO2)<90%;(3)心率>140次/min或变化>20%,出现新发的心律失常;(4)收缩压>180 mmHg或<90 mmHg;(5)呼吸困难、烦躁、大汗或明显焦虑。
临床数据包括患者的一般情况:年龄、性别、基础疾病、急性生理和慢性健康状况评分Ⅱ(acute physiologyandchronichealthevaluationⅡ,APACHEⅡ)评分等,以及SBT 120 min或SBT失败时患者的心率、呼吸频率等相关参数。
1.4 统计学方法
应用SPSS 26.0统计软件对数据进行统计学分析。计数资料用%表示,采用χ2检验;计量资料以表示,采用t检验。应用ROC曲线评价LUS、E/e′、DRSBI对撤机失败的预测价值,并根据最佳临界值计算敏感度和特异度。
2 结果
2.1 2组患者一般资料及超声指标的比较结果
62例机械通气患者中,撤机成功49例(成功组),撤机失败13例(失败组)。2组患者的年龄、性别、APACHEⅡ评分、基础疾病、机械通气原因差异无统计学意义(P>0.05),2组患者的心率比较差异有统计学意义(P<0.01)。
失败组LUS[(13.23±4.23)分]明显高于成功组LUS[(7.32±2.59)分],P<0.001;失败组E/e′(13.84±1.66)明显高于成功组(10.67±1.29),P<0.001;失败组DRSBI(1.75±0.26)明显高于成功组(1.43±0.25),P<0.001。详见表1。
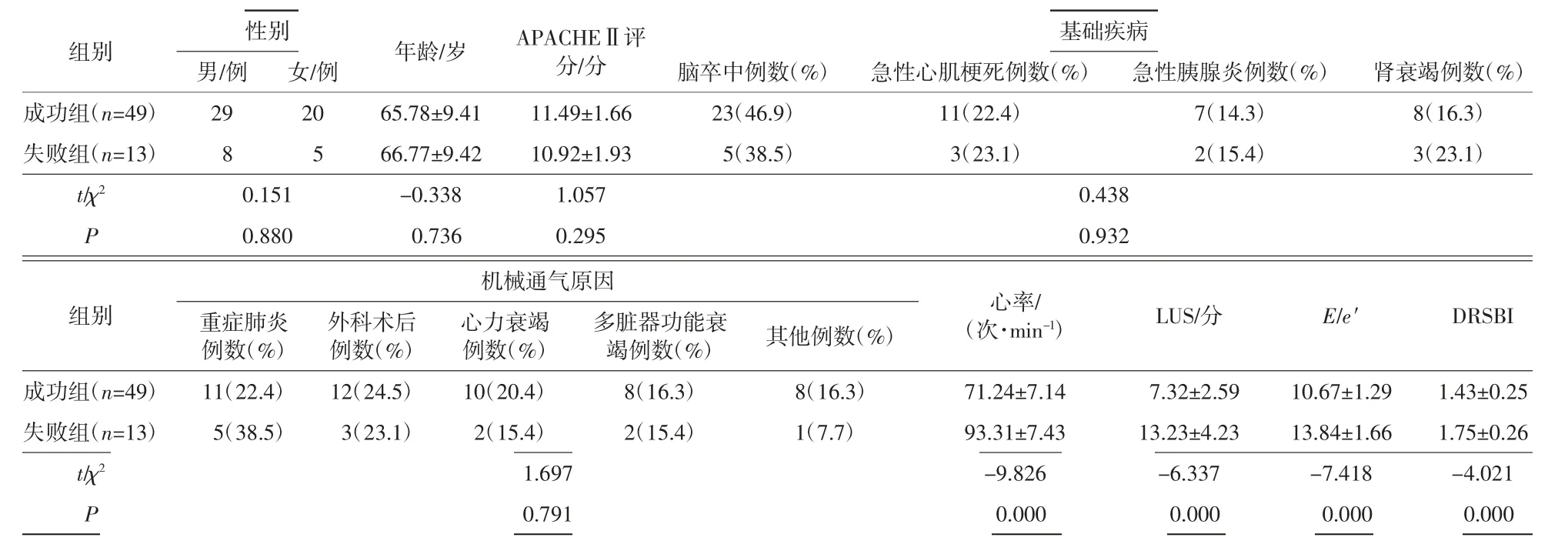
表1 成功组与失败组一般资料及超声指标的比较
2.2 LUS、E/e′、DRSBI对撤机失败的预测价值
LUS≥8.5分时预测撤机失败,敏感度为84.6%、特异度为83.7%,AUC值为0.88;E/e′≥12.7时预测撤机失败,敏感度为84.6%、特异度为91.8%,AUC值为0.93;DRSBI≥1.5时预测撤机失败,敏感度为76.9%、特异度为75.5%,AUC值为0.82;LUS≥8.5分、E/e′≥12.7且DRSBI≥1.5时预测撤机失败,敏感度为100%、特异度为89.8%,AUC值为0.98,高于单个脏器超声检测指标。详见表2、如图5所示。
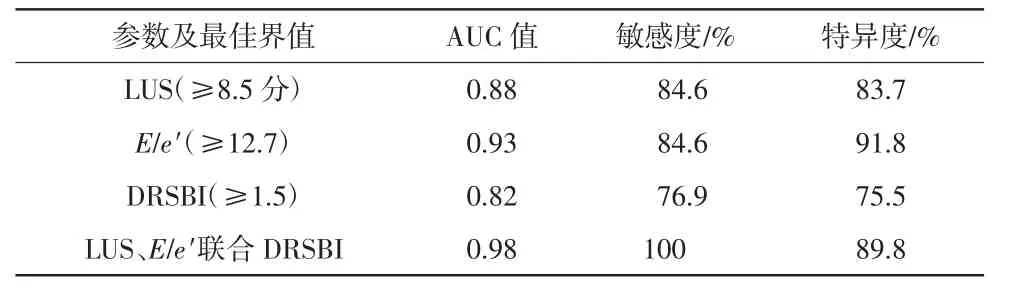
表2 LUS、E/e′、DRSBI及三者联合对撤机失败的预测价值
3 讨论
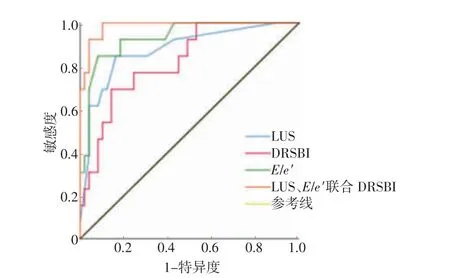
图5 E/e'、LUS、DRSBI及三者联合预测撤机失败的ROC曲线
机械通气患者即使采用SBT指导撤机,仍有15%左右的患者撤机失败,需再次机械通气。在撤机过程中最大难点是缺少1个或多个指标来预测撤机成功[7]。随着超声技术的成熟,因超声具有便于携带、操作方便、实时、无创、无辐射等优势,其应用越来越广泛[8]。而有研究证实肺部超声、心脏超声、膈肌超声对指导撤机有重要意义[9-11],但这些研究仅局限于其中单一脏器。本实验是对心肺、膈肌进行联合超声检测,这是一个新的尝试。超声给ICU医师在撤机前提供了一个对患者各个脏器功能进行评估的机会,这有可能会发现一些影响撤机的因素,并针对潜在的危险因素及时处理,从而提高撤机成功率。
肺功能障碍是撤机失败的常见原因,表现为呼吸系统顺应性下降造成肺泡塌陷,引起肺通气减少,从而导致撤机失败。此前临床上多应用胸部X射线片、肺部CT、纤维支气管镜评估患者的气道及肺功能,以此来指导撤机,但因上述检查有辐射、有创、重复性差等原因限制了其应用。LUS通过量化肺通气减少程度,实现由影像向具体数值的转变,以此来评估肺通气情况更直接。郭宏斌等[12]通过临床研究发现,在诊断肺水肿的敏感度、特异度、准确率中,肺部超声明显高于胸部X射线检查。本研究发现,失败组的LUS明显高于成功组,差异具有统计学意义,这可能是因为LUS可监测肺通气的不足,在一定程度上反映了肺功能障碍的程度。本研究中分析ROC曲线发现,LUS最佳截断值≥8.5分时,预测撤机失败的AUC值为0.88,此时需要进一步评估患者能否成功撤机;同时本实验也发现有部分LUS≥8.5分的撤机成功,这表明撤机过程是复杂的。
心脏舒张功能障碍也会导致撤机失败[4],e′的降低和E/e′比值的升高是舒张储备功能受损的最显著的标志[13]。本研究发现,失败组的E/e′明显高于成功组。分析ROC曲线发现,E/e′对撤机失败有预测价值,最佳截断值≥12.7时,预测撤机失败的AUC值为0.93,此时需在SBT前进行干预来提高撤机的成功率。LUS与E/e′结合发现,E/e′与LUS同时增高时,可明确LUS增高与心功能有关,而不是炎性渗出或实变。心肺超声联合检测的价值在于临床医生将其临床评估扩展到心肺系统,同时可以明确病因。
膈肌是主要的呼吸肌,长时间的机械通气会导致膈肌萎缩和收缩功能障碍,即机械通气诱发的膈肌功能障碍[1]。部分患者在机械通气不足24 h时引发膈肌功能障碍[14]。在一项研究中发现[15],在无神经肌肉或膈肌疾病的危重患者中,膈肌功能障碍的发生率为29%。膈肌功能障碍会造成撤机困难,增加死亡率[16],因此及时准确地评估膈肌功能对于撤机至关重要。膈肌超声可根据DD对膈肌功能进行定性和定量评估。膈肌超声测量DD是预测撤机的一种有效方法[17]。Mowafy等[18]的研究利用DD代替呼吸浅快指数(rapid shallow breathing index,RSBI)中的潮气量,得出一个新的参数DRSBI;与传统的RSBI相比,发现DRSBI在预测撤机结果方面比RSBI更准确。因其兼顾了呼吸肌和呼吸负荷的因素,更符合撤机过程中的病理、生理改变。本研究发现在失败组中,DRSBI预测撤机失败的AUC值为0.82,最佳截断值DRSBI≥1.5,敏感度为76.9%、特异度为75.5%,提示DRSBI对撤机结果有重要的预测价值,与Mowafy等[18]的研究一致。
本研究数据显示,LUS≥8.5分、E/e′≥12.7且DRSBI≥1.5预测撤机失败,其AUC值达0.98,敏感度为100%、特异度为89.8%,高于单个脏器超声检测指标。多脏器联合超声能更精准地预测撤机失败,避免盲目撤机。心肺、膈肌超声联合检测的价值在于临床医生将其临床评估扩展到多脏器系统,对病情能更全面地掌控,同时也可以发现导致撤机失败的病因,更有针对性地进行治疗,从而提高撤机成功率。
本研究尚存在一些不足:(1)膈肌超声只测量了右侧膈肌,没有测量左侧膈肌;(2)心脏超声只关注了舒张功能,没有考虑收缩功能;(3)纳入患者缺乏慢性阻塞性肺疾病患者;(4)样本量小,还需要进一步扩大样本量来进一步论证。
综上所述,多脏器联合超声检测有助于对撤机失败进行预判,可及时帮助临床医生制订合理的撤机计划,提高撤机成功率,值得在临床上推广。
