南极大磷虾共附生细菌多样性及其防御功能研究
2022-02-23杨珍珠何建国郭长军马凌波
杨珍珠,赵 明,迟 海,何建国,郭长军,何 建,马凌波,
(1.中国水产科学研究院东海水产研究所,上海 200090;2.上海理工大学健康科学与工程学院,上海 200093;3.中山大学,广东省海洋资源与近岸工程重点实验室,广州 440105)
南极大磷虾(Euphausiasuperba)是鲸、鱼、海豹等南大洋脊椎动物和哺乳动物的主要食物来源,在南大洋生态系统和食物链中处于核心地位,是地球上生物量最大、繁衍最成功的关键物种[1-2]。南极大磷虾生活环境独特,其体表、消化道等器官中定植了大量的共附生微生物[3],这些共附生微生物可能与其宿主代谢、免疫、环境适应、防御等重要生命活动密切相关[4-6],这也使得南极极端海洋微生物成为一个天然资源库而被关注。然而目前对南极大磷虾的研究还主要集中在捕捞、贮藏和产品加工等[7-8],对于南极大磷虾共附生细菌的物种多样性以及其可能的生物学功能少见报道。因此,分析南极大磷虾中微生物的菌群结构和物种多样性,掌握微生物的适应、防御功能作用,能为发掘南极大磷虾微生物资源提供新思路。
群落结构是指一个生物环境内相互之间具有直接或间接关系的所有生物组成状况,群落结构决定生态功能的特性,生态环境的变化会间接引起群落结构的变化,通过分析目标环境微生物群落的菌群结构,能够为发现新的重要微生物功能类群提供可靠依据[9]。赵文静等[10]采用宏基因组测序技术分析南极鱼皮肤微生物的多样性,初步了解南极鱼皮肤微生物的种类及菌群结构;张丽珉等[11]利用16SrRNA技术研究了南极罗斯海区域可培养土壤微生物的多样性,为开发利用南极微生物资源奠定了基础。通过宏基因组技术分析南极海域特殊条件下的细菌组成特征,可以进一步体现细菌群落完整性,实现对特殊条件下细菌群落结构和基因功能的分析[12]。
本研究以南极大磷虾为原材料,采用宏基因组测序技术分析南极大磷虾不同组织中的微生物多样性,并通过细菌纯培养技术获得可培养菌株,对其进行抑菌活性以及氟化钠耐受性分析,研究南极大磷虾中细菌的防御功能,从而探索南极大磷虾与其相关功能微生物的相互作用关系,以期为发掘特殊环境微生物新物种和南极大磷虾资源综合利用提供基础数据。
1 材料和方法
1.1 材料与菌株
南极大磷虾由南极考察队提供,平均体长25~35 mm,平均体质量0.8~2.5 g,捕捞后以50 cm×10 cm×5 cm的规格进行船上冻结,运输后于-80℃条件下实验室备用。
单增李斯特菌LFM2813(Listeria monocytogenesLFM2813)、金黄色葡萄球菌LFM3263(StaphylococcusaureusLFM3263)、蜡样芽孢杆菌LFM2805(BacilluscereusLFM2805)、大肠埃希氏菌LFM3704(EscherichiacoliLFM3704)、副溶血性弧菌ATCC17802(VibrioparahemolyticusATCC17802)由中国水产科学研究院东海水产研究所保存。
1.2 培养基与试剂
实验所需培养基和试剂如下:Luria-Bertani(LB)培养基;2216E培养基(青岛科技工业园海博生物技术有限公司);脑心浸液培养基(Brain Heart Infusion,BHI)(美国BD公司);胰蛋白胨大豆肉汤培养基(TSB)(北京索莱宝公司);细菌基因组提取试剂盒Taq酶(日本Takara公司);营养肉汤(NB)培养基、氯化钠、甘油(国药集团化学试剂有限公司);氟化钠(NaF)[生工(上海)生物工程股份有限公司]。
1.3 主要仪器与设备
实验所需主要仪器与设备如下:YXQ-LS-50SII立式灭菌锅(上海博讯实业有限公司医疗器械厂);HH.B11.500-BS-Ⅱ恒温培养箱(上海跃进医疗机械厂);超净工作台SEX-TJ(上海整新电子设备);TG16WS高速离心机(长沙湘智离心机仪器有限公司);普通PCR仪(美国Thermo公司);XY300C电子天平(常州市幸运电子设备有限公司);Miseq高通量测序仪(美国Illumina公司)。
1.4 实验方法
1.4.1 宏基因组测序
任意选取15~30只、总重25 g的南极大磷虾,解冻后无菌条件下解剖获得眼柄(Et)、胃(St)、尾部(Ti)及肠道(Mi)组织。液氮速冻后置于-80℃保存至DNA提取。DNA提取使用DNeasy PowerSoil Kit(100)(QIAGEN,Hilden,Germany),提取方法参考试剂盒说明书。使用细菌16S rDNA的V3V4通用引物343F(5′-TACGGRAGGCAGCAG-3′)和798R(5′-AGGGTATCTAATCCT-3′)进行PCR扩增。PCR产物使用磁珠纯化后作为模板进行二次扩增,随后再使用磁珠纯化,纯化产物使用Qubit进行定量,根据PCR产物浓度进行等量混样后使用Illumina MiSeq测序平台进行测序。
1.4.2 数据处理
测序原始数据使用Trimmomatic软件进行去接头和质量过滤,去除长度小于50 bp的序列,使用Flash软件进行连接处理和拼接得到拼接序列,采用split_libraries软件进一步质控,去除拼接序列中含有N碱基、单碱基重复大于8以及长度小于200 bp的序列得到合格序列,采用UCHIME软件去除合格序列中的嵌合体得到优质序列。所得序列与数据库比对注释确定物种信息并统计相应丰度。使用单因素方差分析(ANOVA)对样本不同分组的丰富度进行统计分析。
细菌相对丰度表示在细菌群落中某一菌群的丰度与所有菌群丰度之和的比值,用以反映某种菌群在整个细菌群落中所占的比例。
1.4.3 菌株培养
无菌操作称取25 g解剖获得的南极大磷虾组织样品(眼柄、胃、尾部、肠道),加入225 mL无菌生理盐水,静置30 min后进行梯度稀释,取100 μL的样品分别涂布于LB、2216E、TSB、NB固体培养基上,30℃培养48 h,培养结束后将生长于培养基中的单菌落接种在LB液体培养基中,30℃培养48 h后在13%(v/v)甘油中保存备用。
1.4.4 抑菌活性及稳定性的鉴定
以单增李斯特菌LFM2813、金黄色葡萄球菌LFM3263、蜡样芽孢杆菌LFM2805、大肠埃希氏菌LFM3704、副溶血性弧菌ATCC17802为指示菌株,以从南极大磷虾中分离的细菌为指标菌,参考迟海等[13]方法,通过琼脂扩散法筛选出具有抑菌活性的菌株并测其经过高温和酶处理后的抑菌情况。
1.4.5 细菌基因组DNA的提取、PCR扩增及菌种鉴定
细菌基因组DNA的提取按照试剂盒提供的方法进行。PCR扩增以目标细菌的基因组DNA为模板,使用Taq酶与上游引物12F:5′-AGGGTTGCGCTCGTTG-3′和下游引物15R:5′-TACGGGAGGCAGCCAG-3′建立50μL扩增体系。扩增程序为:94℃预变性2 min,进入PCR循环阶段后,94℃变性30 s,50℃退火30 s,72℃延伸1 min,共30个循环;72℃延伸5 min,4℃保存。取20μL PCR扩增产物送样测序。
1.4.6 对NaF耐受能力鉴定
参考CUI等[14]方法测定从南极大磷虾中筛选的指标菌对NaF的耐受能力。将指标菌分别接种于含有0.5%、1%、2%、3%和5%NaF的LB固体培养基中,以接种在不添加NaF的LB培养基上的指标菌为空白对照,30℃培养48 h后,观察指标菌的生长情况。
2 结果与分析
2.1 宏基因组测序
本实验分别将南极大磷虾4个组织部位进行组内划分,每个组织再分成5组,共获取20个不同南极大磷虾组织样本。宏基因组测序结果经质控之后的合格序列数据量分布在88 682~95 870之间,经过去除嵌合体得到的优质序列数据量分布在65 536~84 145之间,优质序列的平均长度分布在411.31~415.88 bp,各样本可操作分类单元(OTU)个数分布在4 274~6 816之间。此外,南极大磷虾组织样本通过单因素方差分析发现OTU有显著性差异的个数为3 617个,在属水平上有显著性差异的个数为293个,在门水平上有显著性差异的个数为18个。
2.2 南极大磷虾共附生细菌群落结构分布
图1是南极大磷虾不同组织部位的微生物群落在门水平上的相对丰度,结果表明,细菌群落相对丰度较大的主要有4大类:变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)和放线菌门(Actinobacteria)。其中,在南极大磷虾眼柄、尾部和肠道中,变形菌门的群落相对丰度最高,分别占各组织细菌总量的41.4%、35.8%、59.5%,而在南极大磷虾胃部,厚壁菌门的相对丰度最高,占细菌总量的32.2%。
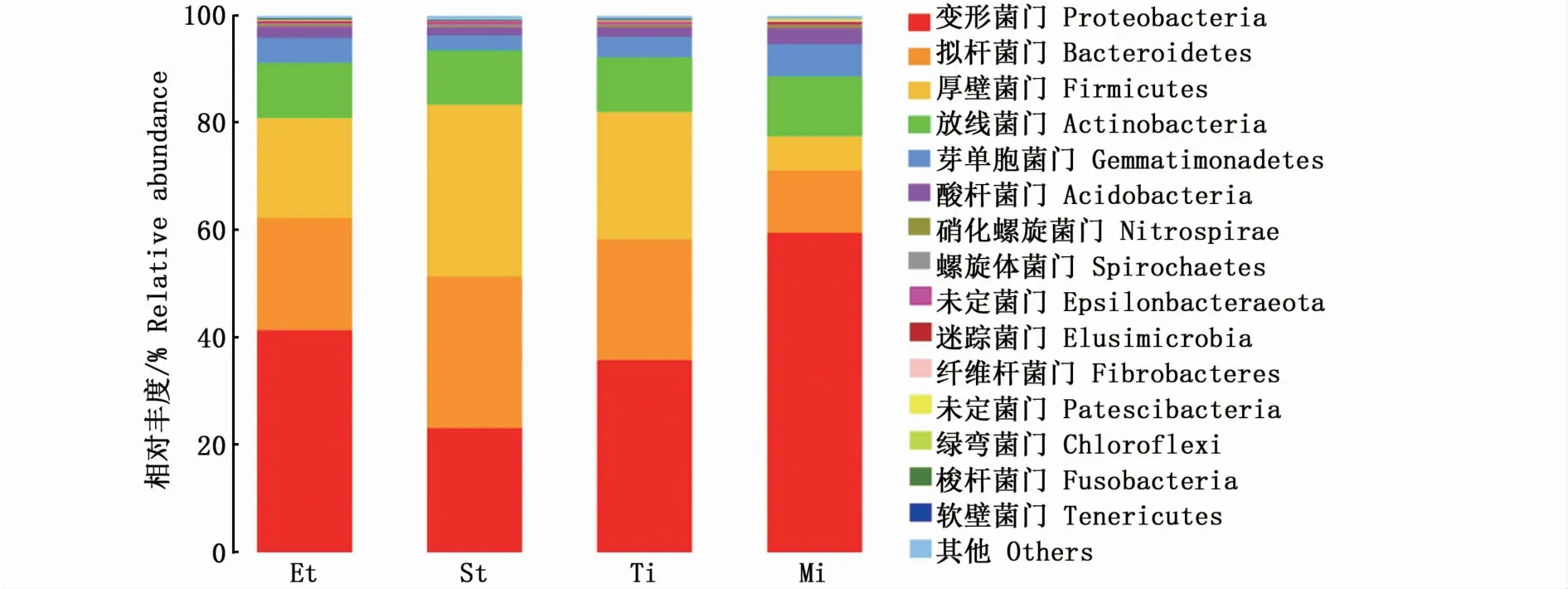
图1 门水平上南极大磷虾中不同部位微生物菌群的相对丰度Fig.1 Relative abundance of bacteria in the level of door from different parts of E.superba
热图可将高丰度和低丰度的物种分块聚集,通过颜色的变化与相似程度反映不同样品在分类水平上群落组成的相似性和差异性[15],颜色越红表示菌门在样本中的相对丰度越高,颜色越蓝表示菌门在样本中的相对丰度越低。由图2可见,南极大磷虾肠道组织含有较大的红色区域,说明肠道中含有较多的高丰度细菌,而南极大磷虾胃部含有较大的蓝色区域,说明胃部组织含有较多低丰度细菌,从整体上看,南极大磷虾肠道和胃部细菌群落的丰度差异较大。
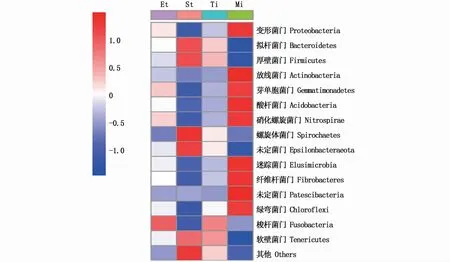
图2 门水平上南极大磷虾中不同部位微生物的物种丰度热图Fig.2 Relative abundance heatmap of bacteria in the level of door from different parts of E.superba
2.3 南极大磷虾微生物多样性分析
表1为南极大磷虾不同部位所得到的微生物物种数、Chao指数和Shannon指数信息。Chao指数反映整个群落的丰富度(不考虑群落中每个物种的丰度),Shannon指数反映样品的均一性[16]。结果表明,南极大磷虾眼柄和尾部微生物物种多样性较高,观察到的物种数分别为6 842.1和6 938.7,南极大磷虾胃部和肠道物种多样性较低,观察到的物种数分别为5 099.0和5 229.2。南极大磷虾眼柄和尾部的Chao指数明显高于胃部和肠道,说明南极大磷虾眼柄和尾部群落丰度明显高于胃部和肠道。南极大磷虾尾部的Shannon指数最高,说明尾部的微生物菌群均一性最好。

表1 南极大磷虾不同部位微生物的多样性指数Tab.1 Diversity index of bacteria from different parts of E.superba
图3和图4为南极大磷虾不同部位不同分组的微生物二维和三维的PCA分析,结果表明,南极大磷虾肠道和胃部的同一组样品距离较近,分组效果较好,而眼柄和尾部同一组样品较分散,分组效果较差。南极大磷虾胃部和肠道整体分布相差较远,因此肠道和胃部的微生物组成差异较大,这与前述物种丰度热图分析结果相一致。南极大磷虾肠道和眼柄样品分布较近,说明南极大磷虾肠道和眼柄微生物组成较相似。
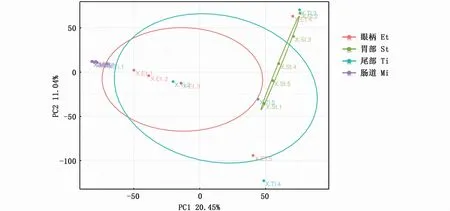
图3 南极大磷虾不同部位微生物的PCA(2D)分析Fig.3 PCA(2D)analysis of bacteria from different parts of E.superba
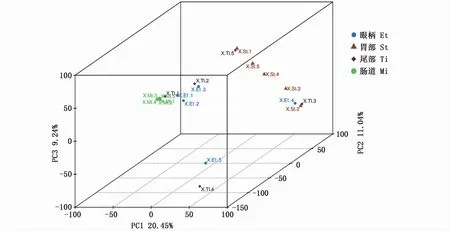
图4 南极磷虾不同部位微生物的PCA(3D)分析Fig.4 PCA(3D)analysis of bacteria from different parts of E.superba
2.4 有抑菌活性细菌的筛选、鉴定及抑菌稳定性测定
通过直接培养南极大磷虾组织,从4种培养基中共获得60株细菌,将全部细菌作为指标菌,筛选可以抑制革兰氏阳性菌[单增李斯特菌(Lis.monocytogenes)、金黄色葡萄球菌(S.aureus)、蜡样芽孢杆菌(B.cereus)]和革兰氏阴性菌[大肠埃希 氏 菌(E.coli)、副 溶 血 性 弧 菌(V.parahemolyticus)]的菌株。其中只有一株细菌对上述革兰氏阳性菌有明显的抑菌作用,经16S rDNA测序和NCBI数据库进行比对,该细菌鉴定为马胃葡萄球菌(S.equorum)。
微生物可以产生许多种抑菌物质,如抗生素、过氧化氢、酸和细菌素等。实验室筛选的马胃葡萄球菌所产的抑菌物质具有热稳定性强和易被蛋白酶分解的特点,在经过热处理后对单增李斯特菌、金黄色葡萄球菌和蜡样芽孢杆菌仍具有抑菌活性,而在经过蛋白酶处理后对上述细菌全部失活(表2)。这一结果说明,马胃葡萄球菌产生的抑菌物质具有细菌素的基本特征。

表2 不同处理后马胃葡萄球菌抑菌产物的抑菌稳定性Tab.2 Antibacterial stability of antibacterial substance produced by S.equorum under different treatments
2.5 对NaF耐受能力的测定
为了验证南极大磷虾细菌对NaF耐受能力,将所筛选的60株细菌均培养于含有不同NaF的LB培养基上,结果显示,17株细菌可以在含有0.5%NaF的培养基上生长,6株细菌可以在含有1%NaF的培养基上生长,高于1%含量NaF的培养基(2%~5%)均未发现细菌生长。将具有耐受NaF细菌进行分子鉴定,在1%NaF培养基耐受下生长的细菌与0.5%NaF条件下耐受细菌一致,高浓度NaF条件下的细菌为嗜冷杆菌属(Psychrobacterspp.)、鞘 脂 菌 属(Sphingobiumspp.)、微小杆菌属(Exiguobacteriumspp.)和马赛菌属(Massiliaspp.)。
3 讨论
南极大磷虾是南极海域生物量最大的物种之一,对维持海域生态平衡和保持食物链完整起到重要作用[17]。同时,南极大磷虾共附生微生物也是潜在的可利用资源之一。然而南极海域生态环境特殊,大部分细菌具有高压、低温和寡营养的生长特点[18],这也为实验室内纯培养和微生物物种多样性分析增加了难度。本研究利用宏基因组测序技术,实现了对不可培养及低丰度细菌的分析,完整地体现了南极大磷虾共附生细菌的特征。结果发现,在南极大磷虾的眼柄、尾部中,群落相对丰度最高的均为变形菌门,这可能是南极大磷虾体表定植了大量适应外界环境的变形菌门的嗜冷菌属细菌,迟海等[19]报道的不同贮藏温度下南极大磷虾体内多为嗜冷微生物的结果也证明了这一点。南极大磷虾肠道中相对丰度最高的为变形菌门,但是南极大磷虾胃部相对丰度最高的是厚壁菌门,且通过多样性分析发现南极大磷虾肠道组织和胃部组织微生物组成差异较大,说明消化道不同部位的菌群结构也有显著差异,这可能是由于大部分厚壁菌门可以适应酸性等极端环境,并适合在胃部环境中生长。
南极大磷虾生活海域海水的含氟量约为1.25 mg·kg-1,而南极大磷虾整虾中氟含量极高,其值在1 142~2 400 mg·kg-1,甲壳氟含量约为4 000~8 000 mg·kg-1,肌肉氟含量约为250 mg·kg-1[20-22]。氟含量过高通常会对生物体造成危害,而南极大磷虾仍能正常生长,这可能是由于南极大磷虾在脱壳过程中需要氟的作用。潘建明等[23]在研究氟在南极大磷虾生长中的迁移变化规律时发现,南极大磷虾的虾壳具有富集氟的作用,在脱壳过程中氟会通过某种方式回归到海洋环境中,虾肉中的氟可能在即将脱壳时短时间转移至新生虾壳中,因此活的南极大磷虾肌肉中氟含量很低。此外,南极大磷虾共附生微生物也可能对其体内高含量的氟起到一定的防御作用。本实验中,从南极大磷虾分离的细菌可在0.5%~1%(相当于5 000~10 000 mg·kg-1)的NaF下耐受生长,这说明南极大磷虾共附生微生物可能在氟的刺激下合成了次生拮抗物等化学防御物质,建立了机体防御屏障,从而维持宿主健康,这与CUI等[14]对南极大磷虾功能微生物的研究结果一致。
南极大磷虾共附生微生物还能产生有抑菌活性的物质,这些抑菌物质能抑制或杀灭致病菌,并防止其在宿主体内定植,从而达到维持宿主机体健康的目的。本研究分离得到的一株产细菌素的马胃葡萄球菌,具有广谱抑菌特性,且抑菌产物耐高温,具有易被蛋白酶水解的细菌素特性。目前,对于马胃葡萄球菌细菌素的研究只局限于对单增李斯特菌的抑菌应用,对其特性研究尚未深入[24]。此外,关于南极大磷虾中可产细菌素的共附生微生物的研究也还未见报道。本研究中马胃葡萄球菌属于南极大磷虾胃部的优势菌群,这说明南极生物中胃肠道共附生微生物可作为新型活性物质的资源之一,该结果可为南极大磷虾的进一步加工利用提供新的方向。
