半夏连作对根际土壤微生物群落的影响研究
2022-02-23刘诗蓉王红兰蒋舜媛蒋桂华
刘诗蓉,王红兰,孙 辉,杨 萍,蒋舜媛,蒋桂华
半夏连作对根际土壤微生物群落的影响研究
刘诗蓉1, 2,王红兰2*,孙 辉3,杨 萍2,蒋舜媛2,蒋桂华1*
1. 成都中医药大学药学院,四川 成都 611137 2. 四川省中医药科学院,四川 成都 610041 3. 四川大学环境科学与工程系,四川 成都 610065
探明半夏连作对根际土壤微生物群落的影响规律,以指导半夏连续高产栽培。采用 PacBio Sequel测序手段对正茬(CK)、连作一茬(A)、二茬(B)和三茬(C)半夏不同生长时期根际土壤微生物进行测序,对比分析其微生物群落结构和多样性差异。随着连茬次数的增加,潜在致病细菌如果胶杆菌、真菌如子囊菌门Ascomycota菌群、镰刀菌属真菌和瓜亡革菌等丰度增加,球黑孢霉随着连茬次数的增加逐渐成为优势菌群,有益真菌如球囊菌门Glomeromycota菌群丰度减少;随着连茬次数增加,半夏根际土壤中细菌和真菌多样性均降低;根际土壤pH值随着半夏生长周期的延长波动变化,可能导致根际细菌和真菌多样性和功能类群变化,从而使一些致病菌在半夏块茎膨大期和成熟期形成优势种群。随着半夏连茬次数的增加,根际土壤有益微生物丰度减少、有害微生物丰度增加,根际土壤微生物群落多样性降低,根际土壤pH值波动变化,是半夏连作障碍形成的重要原因。
半夏;连作障碍;根际土壤;PacBio Sequel测序;微生物多样性;群落结构
大宗中药材半夏为天南星科植物半夏(Thunb.) Breit.的干燥块茎,始载于《神农本草经》[1],具有燥湿化痰、降逆止呕、消痞散结等功效[2]。随着半夏市场需求增加引发的供需矛盾日益尖锐,人工栽培半夏已经成为必然趋势。四川盆地是半夏传统道地产区,课题组前期在盆地丘陵区的田间试验初步结果显示半夏同一地块连作第2~5年产量分别比第1年下降21.5%、36.7%、55.4%、68.6%,产量降低量达到显著性水平(未发表数据),主要表现为随着连茬次数增加半夏植株生长不良、珠芽繁育系数降低和病虫害日益严重。
很多农作物和经济植物种植过程中均存在连茬效应。关于植物栽培连作障碍主要诱因,国内外相关研究学者认为主要有土壤理化性质恶化[3]、土壤微生物群落结构和功能类群的变化[4]以及植物根系分泌物的化感作用[5]等。许多植物连作后土壤pH下降,土壤中矿质养分有效性降低,对土壤微生物功能类群产生重要影响,最终反映至土壤生物活性[6]。亦有研究表明,连茬使土壤微生物群落真菌化趋向日益明显[7],如地黄长期连作后根际土壤细菌种类减少、群落结构趋于简单[8],有益类群退化、有害类群丰富度增加[9]。事实上,连茬效应很可能是多种机制综合作用的结果。三七、百合、丹参、半夏、地黄等连茬效应在栽培中非常明显,这些药材产业化栽培中每茬不得不换地进行轮作,不利于基地建设和基础设施改善,因此连作障碍成为制约很多药材进行产业化栽培的最主要因素之一。
土壤微生物群落结构和功能类群的变化为半夏连作障碍形成的重要原因,有关半夏栽培过程中根际微生物多样性变化的研究也有部分报道。研究表明,连作使半夏根际土壤细菌和放线菌数量、微生物总数降低,真菌数量增加,即土壤由“细菌型”向“真菌型”转换,且真菌多样性显著低于未耕作土壤[10-13]。然而由于手段受限,对半夏连作后何种细菌或真菌发生何种变化尚不清楚。因此,本研究采用PacBio Sequel微生物3代测序手段,研究不同连作茬数下半夏根际土壤真菌及细菌的动态变化,并对门及种水平的细菌及真菌群落结构进行分析,结合根际土壤pH的动态变化,阐明连作条件对半夏根际土壤的微生物群落结构的影响,以期揭示半夏连作障碍机制,为缓解半夏连作障碍提供理论依据和技术支撑。
1 材料与试验地
1.1 材料
供试半夏种茎来自于重庆市大足县,经四川省中医药科学院中药资源与种植研究所周毅研究员鉴定为天南星科植物半夏(Thunb.) Breit.的新鲜根茎。
1.2 试验地概况
田间试验设在四川省内江市中区四川天贝生态农业中药材试验基地(E104°85′12′′,N29°49′68′′)进行。该基地为亚热带湿润季风气候,冬暖夏热,雨量适中,年相对湿度约80%,年均降雨量约920 mm。该区域地形以低山丘陵为主,基地东南、西南面有低山环绕。试验地土壤为紫红色砂质泥岩母质发育的中性至石灰性紫色土,为壤质土,其砂粒(0.05~2 mm)、粉粒(0.002~0.05 mm)及黏粒(<0.002 mm)[14]质量分数分别为21%、51%和28%。试验开展前,在同一块地划分的不同小区连续栽种半夏,形成不同连作茬数的处理样地,并按生态种植模式进行试验栽培管理[15]。
2 方法
2.1 样品处理
试验设正茬(CK)、连作一茬(A)、二茬(B)和三茬(C)4个处理。试验小区布置采用随机区组设计,每一处理设置3个重复,小区面积为3 m×1.2 m=3.6 m2。种茎通过筛分,选用直径1.0~1.5 cm半夏块茎作为试验用种茎,种茎在播种前用恶霉灵、春雷霉素和霜霉威盐按一定比例加水稀释成一定浓度,浸种30 min,晾干,并于播种前将同浓度药液喷淋于土壤表层深翻进行土壤消毒。半夏于2019年9月3日播种,覆土深度为8 cm。整个试验过程田间管理措施均保持一致。
2.2 样品采集
分别于播种后30 d(半夏出苗期)、60 d(半夏块茎膨大期)和90 d(成熟期)采集各小区半夏植株。按“S”布点法采样,先去掉0~2 cm表土,轻轻抖掉根系外围土,再用毛刷轻刷黏附在根表面的土壤作为根际土壤。4个处理(CK、A、B、C)共采集12组样品,分别标记为CK30、CK60、CK90、A30、A60、A90、B30、B60、B90、C30、C60、C90。每次土壤样品采集后,立即分为2部分,一份将每个处理3个重复的样品混合均匀,立即置于液氮罐中带回实验室,于−80 ℃保存,用PacBio Sequel进行根际土壤微生物群落测序分析;另一份土样自然风干,并剔除石砾、根系等杂物,磨细,过2 mm(10目)筛后测定土壤pH值。
2.3 土壤DNA提取与PCR扩增
取0.25 g土壤样品,按试剂盒(PowerSoil® DNA Isolation kit)操作流程,提取土壤总DNA,细菌16S rRNA V1~V9区全长引物27F(5’-A GRGTTTGATYNTGGCTCAG-3’)/1492R(5’-TASGGHTACCTTGTTASGACTT-3’),真菌ITS rRNA全长引物ITS1(5’-CTTGGTCATTTAGAGGAAGTAA-3’)ITS4(5’-TCCTCCGCTTATTGATATGC-3’)通过上述引物分别合成带有Barcode的特异引物,进行PCR扩增。反应体系:10 μL的KOD FX Neo Buffer(2×),4 μL的dNTP(2 mmol/L),0.4 μL的KOD FX Neo(TOYOBO公司),5 ng的DNA模版,1 μL的正向引物(10 μmol/L),1 μL的反向引物(10 μmol/L),然后用ddH2O补足10 μL。程序如下:95 ℃预变性5 min,95 ℃变性30 s,50 ℃退火30 s,72 ℃延伸1 min,30个循环,72 ℃延伸5 min。
2.4 文库构建与测序
对上述进行PCR扩增的产物进行纯化、定量和均一化形成测序文库(SMRT Bell),建好的文库先进行文库质检,质检合格的文库用PacBio Sequel进行测序。
2.5 数据分析
对原始下机subreads进行校正得到CCS(circular consensus sequencing)序列(SMRT Link,version 8.0),使用lima(v1.7.0)软件,通过barcode序列识别不同样品的CCS序列并去除嵌合体,得到高质量的CCS序列,使用cutadapt v2.7(错误率0.2)识别正向引物与反向引物,丢弃不包含引物的CCS序列,并对CCS长度进行滤过,在相似性97%的水平上对序列进行聚类(USEARCH,version 10.0),以测序所有序列数的0.005%作为阈值滤过OTU。使用Usearch软件对Tags在97%的相似度水平下进行聚类、获得OTU,并基于Silva(细菌)和UNITE(真菌)分类学数据库对OTU进行分类学注释。
3 结果与分析
3.1 半夏连作对根际土壤pH值的影响
pH是土壤重要的基本性质,直接影响土壤养分的存在状态、转化和有效性。图1给出了半夏不同连茬次数下土壤pH的变化规律。由图1可知,半夏根际土壤pH值介于7.13~7.99,不同连作茬数处理下半夏出苗期(30 d)pH较播种前均下降,且半夏块茎膨大期(60 d)和成熟期(90 d)的pH值较出苗期(30 d)的有所增加,这可能与半夏不同生长时期次生代谢产物有关。同时,随着半夏连茬次数的增加,土壤pH呈先下降后增加再下降的变化趋势。

不同小写字母表示差异显著(P<0.05)
3.2 半夏连作对根际土壤细菌群落的影响
对12个半夏根际土壤样品进行测序并通过Barcode识别后共获得细菌68 922条CCS序列,每个样品至少产生2836条CCS序列,平均产生5744条CCS序列。采用Mothur方法进行97%相似水平下的OTU分类,并使用Silva数据库对细菌OTU序列进行相似性比对。共获得OTU数1865个,分类学地位明确的细菌有21个门、38个纲、85个目、125个科、271个属、332个种。
3.2.1 根际土壤细菌α多样性指数分析 α多样性(alpha diversity)反映的是单个样品物种丰度(richness)及物种多样性(diversity)。ACE指数衡量物种丰度即物种数量的多少,ACE指数越大,表示物种丰度越大。Shannon指数则能反映样品中微生物的多样性,Shannon指数越大则种类越多,物种越丰富。图2给出了半夏不同连茬次数下根际土壤细菌ACE指数和Shannon指数的变化规律。由图2-a可知,半夏出苗期(30 d)和块茎膨大期(60 d),ACE指数随着连茬次数的增加呈现出先增加后减少的趋势;半夏成熟期,ACE指数变化规律为先降低后增加再降低。其中,ACE指数的增加在块茎膨大期连作二茬时表现尤为明显,表明连作二茬后,土壤细菌物种丰度增加。结合田间观察发现,半夏在块茎膨大期易患根腐病,这可能与该时期有害细菌物种丰度增加有关。如图2-b所示,Shannon指数随着半夏连茬次数的增加而减少,表明半夏连作后土壤细菌多样性降低。即半夏连作可导致土壤细菌物种多样性降低。

图2 半夏不同连茬次数下根际土壤细菌群落丰度(a) 和多样性指数(b)
3.2.2 根际土壤细菌β多样性分析 细菌OTU聚类结果表明(图3-a),半夏不同连作茬数,相同的生长周期多聚为一类。且随着连茬次数的增加,连茬次数越多,与正茬细菌群落的相似性越少。结合主成分分析结果(图3-b)发现,连作三茬处理的离散度最大。由此表明,半夏不同连作茬数在相同生长周期细菌多样性相似,而不同生长周期之间细菌多样性差异大,尤其是连作二茬以后。半夏不同生长周期对其细菌多样性影响较大,且随连茬次数的增加,细菌多样性差异越来越明显。
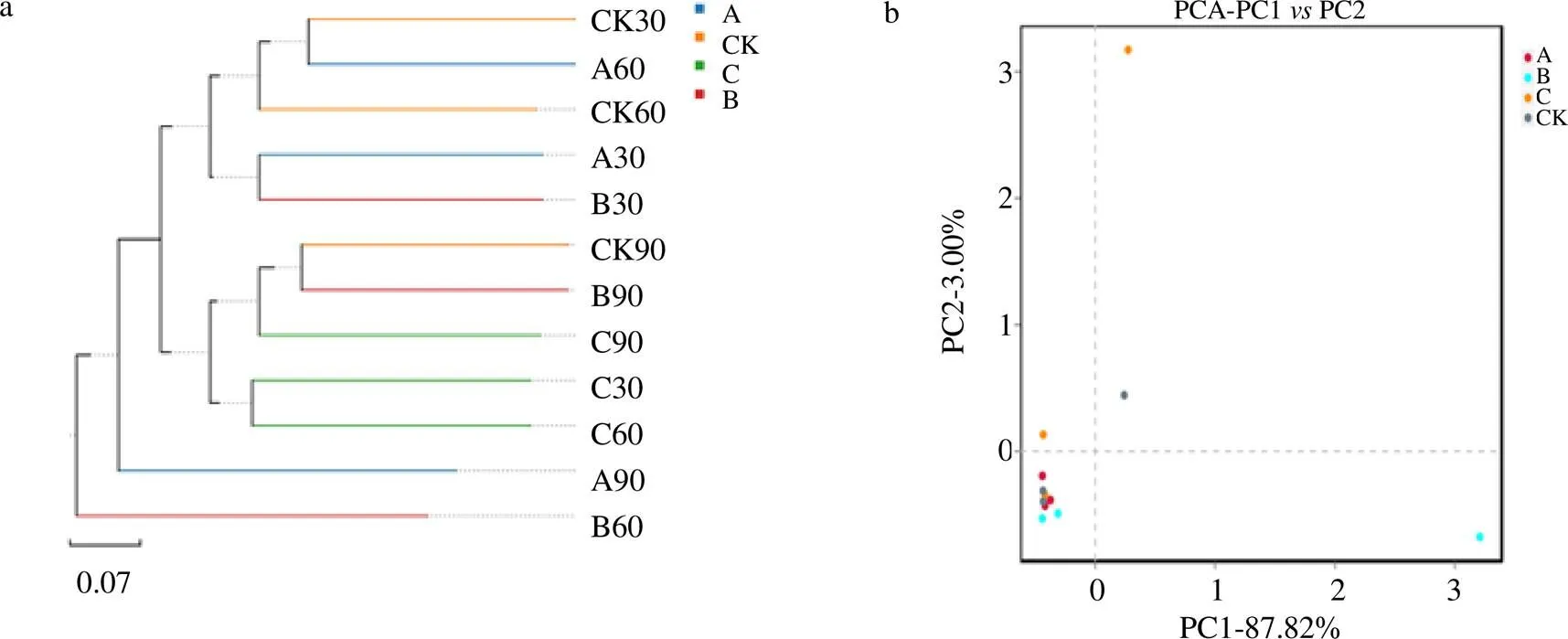
图3 半夏连作下根际土壤细菌UPGMA聚类树图(a)和PCA分析图(b)
3.2.3 根际土壤细菌组成分析 根据物种注释的结果,不同连茬次数下半夏根际土壤细菌相对丰度最高的10个细菌类相同,分别为变形菌门Proteobacteria、浮霉菌门Planctomycetes、拟杆菌门Bacteroidetes、酸杆菌门Acidobacteria、芽单胞菌门Gemmatimonadetes、疣微菌门Verrucomicrobia、硝化螺旋菌门Nitrospirae、放线菌门Actinobacteria、绿弯菌门Chloroflexi、蓝藻门Cyanobacteria。半夏连作下根际土壤细菌在门和种水平的变化规律如图4所示。由图4-a可知,正茬、连作一茬和连作三茬处理中变形菌门Proteobacteria、浮霉菌门Planctomycetes和酸杆菌门Acidobacteria为优势菌群,而连作二茬中优势菌群为变形菌门Proteobacteria、浮霉菌门Planctomycetes和拟杆菌门Bacteroidetes。随着连作茬数的增加,变形菌门Proteobacteria所占比例逐渐增加,且在不同处理中块茎膨大期和成熟期所占比例较出苗期均增加。

图4 半夏连作下根际土壤细菌在门(a) 和种(b) 水平的变化规律
细菌种水平的分析结果表明(图4-b)正茬、连作一茬处理下硫杆菌sp.和为优势菌群;连作二茬处理中硫杆菌sp.、果胶杆菌和所占比例最高。果胶杆菌在正茬中只出现在成熟期,且随着连茬次数的增加所占比例增加,在连作二茬茎膨大期所占比例最大为28.35%。
综上所述,随着半夏连茬次数的增加,细菌群落及相对丰度发生变化连作导致土壤微生物群落结构逐渐发生偏移,并且某些潜在病原菌群落如果胶杆菌在重茬半夏根际土壤中丰度增加。不同连作茬数下,半夏根际土壤微生物群落结构存在较大差异。
3.3 半夏连作对根际土壤真菌群落的影响
对12个半夏连作根际土壤样品进行测序并通过Barcode识别后共获得真菌185 251条CCS序列,每个样品至少产生11 910条CCS序列,平均产生15 438条CCS序列。不同连作年限半夏优势根际真菌群落采用Mothur方法进行97%相似水平下的OTU分类,并使用UNITE(真菌)分类学数据库对OTU序列进行相似性比对。获得真菌OTU数883个,分类学地位明确的真菌有11个门,30个纲、60个目、107个科、180个属、229个种。
3.3.1 根际土壤真菌α多样性指数分析 半夏不同连茬次数下根际土壤真菌丰度和多样性的变化规律如图5所示。由图5-a可知,连作初期(30 d),半夏根际土壤真菌ACE指数随连茬次数的增加先下降后上升,随着时间的延长(90 d),真菌丰度则逐渐增加。对于Shannon指数则随着连茬次数的增加呈现出持续下降的趋势(图5-b),表明连作导致土壤中真菌多样性降低。
3.3.2 根际土壤真菌群落β多样性 真菌OTU聚类发现,正茬和连作一茬处理下半夏出苗期和块茎膨大期的土壤真菌可聚为一类,而连作二茬和连作三茬处理可聚为另一类(图6-a)。主成分分析表明,正茬和连作一茬处理下真菌在PC1和PC2上均有相似的离散度,连作二茬和连作三茬处理离散度差异大(图6-b)。由此表明,半夏连作会影响其根际真菌群落多样性,且随连茬次数的增加真菌多样性的差异较正茬越来越明显。半夏连作过程中,真菌多样性的变化主要表现在连作一茬后。
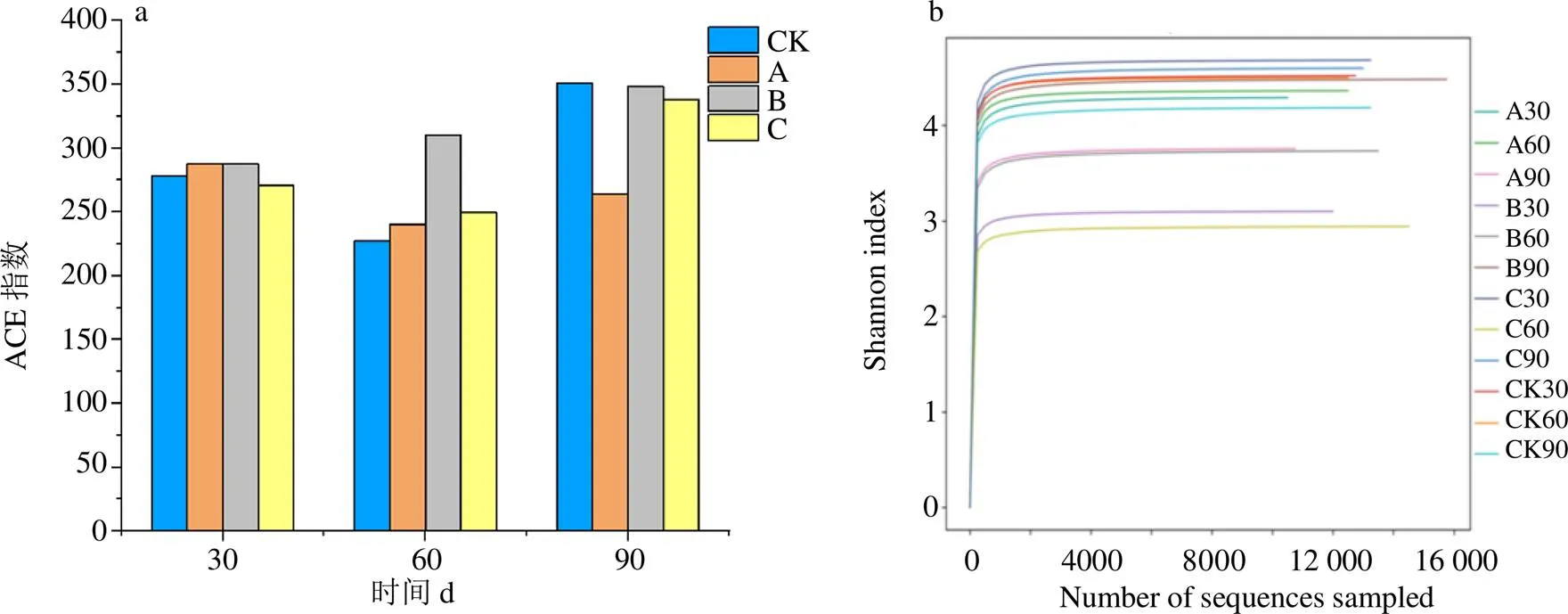
图5 半夏不同连茬次数下根际土壤真菌群落丰度(a) 和多样性指数(b)

图6 半夏连作下根际土壤真菌UPGMA聚类树(a)和PCA分析(b)
3.3.3 根际土壤真菌组成分析 根据物种注释的结果,不同连茬次数半夏根际土壤真菌相对丰度最高的10个真菌类相同,分别为子囊菌门Ascomycota、担子菌门Basidiomycota、壶菌门Chytridiomycota、毛霉门Mucoromycota、丝孢菌门Mortierellomycota、球囊菌门Glomeromycota、捕虫霉门Zoopagomycota、真菌门Cryptomycota、油壶菌门Olpidiomycota、虫孢子门Entomophthoromycota,其所占比例存在差异。门水平的分析结果表明(图7-a),与正茬相比,随着连茬次数的增加,子囊菌门Ascomycota所占比例增加,壶菌门Chytridiomycota、球囊菌门Glomeromycota和捕虫霉门Zoopagomycota则呈下降趋势。正茬处理中,子囊菌门Ascomycota、担子菌门Basidiomycota、壶菌门Chytridiomycota为优势种群。随着连茬次数的增加,优势种群逐渐演变成子囊菌门Ascomycota、担子菌门Basidiomycota和毛霉门Mucoromycota。种水平的分析结果表明(图7-b),少孢节丛孢菌、镰刀菌属真菌和瓜亡革菌所占比例随着连茬次数的增加而增加;球黑孢霉随着连茬次数的增加逐渐成为优势菌群。

图7 半夏连作下根际土壤真菌在门(a)和种(b) 水平的变化规律
综上所述,随着连茬次数的增加,半夏根际土壤中真菌群落结构发生变化,某些潜在病原菌群落如子囊菌门Ascomycota、镰刀菌属真菌和瓜亡革菌所占比例逐渐增加,有益真菌群落如球囊菌门Glomeromycota则逐渐减少。连作导致土壤真菌群落及相对丰度发生变化,是导致半夏连作障碍形成的重要原因之一。
4 讨论
土壤微生物群落与土壤理化性质紧密相关,且相互影响。大量研究发现,连作会导致土壤酸化[16],但本研究发现土壤pH随着半夏生长周期的延长呈先减少后增加的变化趋势。土壤pH的变化对根际微生物群落产生重要影响,除真菌喜酸外,细菌主要生活在酸性至中性环境,放线菌则适宜中性至碱性环境。半夏出苗后根际土壤的pH持续下降,可能与其根系分泌的有机酸如酚酸类等物质[17]有关。随着生长周期的延长,pH持续上升,这可能与半夏次生代谢产物如生物碱等物质分泌[18]增加有关。在对不同处理细菌群落进行聚类分析后发现,不同处理相同周期其细菌群落相似度高,结合不同生长周期pH的变化规律可推测根系分泌物、根际土壤pH和细菌群落结构变化具有相关性。但pH的变化是受微生物、根系分泌物的影响,还是其交互作用,具体作用机理需进一步探索。
土壤微生物结构稳定性和功能多样性对维持土壤系统健康有非常重要的作用,而土壤微生物结构和活性的稳定性取决于微生物多样性[19]。本研究结果表明,随着半夏连茬次数的增加,根际土壤细菌和真菌多样性均降低。在连作过程中,球黑孢霉随着连茬次数的增加逐渐成为优势菌群。吴琪[20]研究发现球黑孢霉可引起叶斑、叶枯、鞘腐,并侵染根和匍匐茎。半夏在连作过程中易患叶斑病,可能与球黑孢霉群落数的增加有关。镰刀属真菌是多种植物根腐病的主要致病菌[21],本研究发现镰刀属真菌作为不同连作处理中的优势菌群,且在连作二茬处理中所在比例增加最为明显。瓜亡革菌是一种寄主范围很广的病原菌,为半知菌立枯丝核菌的有性形态[22]。本研究发现随着连茬次数的增加而增加,瓜亡革菌增加。通过前期田间试验观察发现,半夏根腐病主要发生在茎膨大期及成熟期,这可能与该时期中致病菌的增加有关。
综上,本研究通过对半夏在正茬(CK)、连作一茬(A)、连作二茬(B)、连作三茬(C)处理下,在半夏出苗期(播种后30 d)、块茎膨大期(60 d)和块茎成熟期(90 d)3个生长期根际土壤微生物进行细菌16S rRNA和真菌ITS rRNA全长测序,揭示了半夏不同连作次数下不同生长期间根际土壤微生物群落变化规律。随连作茬数增加,根际土壤有益微生物丰度减少、有害微生物丰度增加,有害真菌逐渐成为优势菌群,根际土壤微生物群落多样性降低;半夏的生长时期对根际细菌和真菌多样性及pH的变化影响较大,致病菌多发生在半夏块茎膨大期和成熟期,为探索半夏连作障碍机理提供重要依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 吴立明, 程晓卫. 南阳道地药材唐半夏本草考证及资源调查 [J]. 国医论坛, 2005, 20(6): 42-43.
[2] 中国药典[S]. 一部. 2020: 123.
[3] Li X G, Ding C F, Zhang T L,. Fungal pathogen accumulation at the expense of plant-beneficial fungi as a consequence of consecutive peanut monoculturing [J]., 2014, 72: 11-18.
[4] Xu W H, Liu D, Wu F Z,. Root exudates of wheat are involved in suppression ofin watermelon in watermelon-wheat companion cropping [J]., 2015, 141(1): 209-216.
[5] 张重义, 牛苗苗, 陈婷, 等. 药用植物化感自毒作用研究对栽培技术创新的启示 [J]. 中国现代中药, 2011, 13(1): 4-7.
[6] 吴林坤, 林向民, 林文雄. 根系分泌物介导下植物-土壤-微生物互作关系研究进展与展望 [J]. 植物生态学报, 2014, 38(3): 298-310.
[7] 李孝刚, 张桃林, 王兴祥. 花生连作土壤障碍机制研究进展 [J]. 土壤, 2015, 47(2): 266-271.
[8] Zhang Z Y, Lin W X, Yang Y H,. Effects of consecutively monoculturedL. on diversity of fungal community in rhizospheric soil [J]., 2011, 10(9): 1374-1384.
[9] 刘晓波. 重迎茬大豆减产的主要原因 [J]. 现代农业, 2013(11): 39.
[10] He Z, Chen H, Liang L,. Alteration of crop rotation in continuouscropping soils profiled via fungal ITS amplicon sequencing [J]., 2019, 68(6): 522-529.
[11] 安艳. 半夏连作障碍影响因子研究 [D]. 兰州: 甘肃农业大学, 2018.
[12] 金文进. 半夏连作对土壤微生物区系的影响研究 [J]. 农业技术与装备, 2020(6): 137-138.
[13] 马小奇. 半夏的连作障碍效应研究及其缓解措施初探 [D]. 杨凌: 西北农林科技大学, 2016.
[14] 吴克宁, 赵瑞. 土壤质地分类及其在我国应用探讨 [J]. 土壤学报, 2019, 56(1): 227-241.
[15] 郭兰萍, 周良云, 莫歌, 等. 中药生态农业: 中药材GAP的未来 [J]. 中国中药杂志, 2015, 40(17): 3360-3366.
[16] 张皓, 何腾兵, 林昌虎, 等. 不同种植方式黔产半夏土壤养分分析 [J]. 江苏农业科学, 2015, 43(6): 226-230.
[17] 李菊, 李玉梅, 苟亚妮, 等. 酚酸类物质代谢及其化感效应研究进展 [J]. 黑龙江农业科学, 2019(8): 175-182.
[18] 杨媛媛. 唐半夏及其姜制品中生物碱含量分析 [J]. 国医论坛, 2019, 34(5): 59-60.
[19] 付丽娜, 汪娅婷, 王星, 等. 三七连作根际微生物多样性研究 [J]. 云南农业大学学报: 自然科学, 2018, 33(2): 198-207.
[20] 吴琪. 大连市草坪病害调查及草坪草黑孢霉叶斑病的初步研究 [D]. 长春: 吉林农业大学, 2008.
[21] 陈长卿, 闫东, 姜云, 等. 生防细菌NJ13与化学农药复配对人参镰刀菌根腐病菌的抑制作用 [J]. 中国中药杂志, 2019, 44(10): 2015-2019.
[22] 杨迎青, 杨媚, 兰波, 等. 瓜亡革菌致病机理的研究进展[J]. 中国农学通报, 2014, 30(28): 245-250.
Effects of continuous cropping ofon rhizospheric microbial community
LIU Shi-rong1, 2, WANG Hong-lan2, SUN Hui3, YANG Ping2, JIANG Shun-yuan2,JIANGGui-hua1
1. School of Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China 2. Sichuan Academy of Chinese Medicine Sciences, Chengdu 610041, China 3. Department of Environmental Science and Engineering, Sichuan University, Chengdu 610065, China
Response of continuous cropping ofto rhizospheric microbial community is of great significance for realizing the industrialized cultivation ofPacBio Sequel platform was used to conduct sequencing studies on the differences of rhizospheric microbial community and diversity ofat different growth stages under the different treatments of the first cropping (CK), the first continuous cropping (A), the second continuous cropping (B), and the third continuous cropping(C).(1) As the number of continuous cropping ofincreases, the abundance of potential pathogenic bacteria and fungi increased, such as, Ascomycota,andetc.gradually became the dominant flora as the number of consecutive stubbles increased the abundance of beneficial fungi such as Glomeromycota decreased. (2) As the number of continuous cropping ofincreases, the diversity of bacteria and fungi in the rhizosphere soil ofdecreased. (3) The different growth periods ofhave obvious effects on the pH of the rhizosphere soil, which leads to changes in the diversity and functional groups of rhizosphere bacteria and fungi. Some pathogenic fungi such asbecame dominant groups during the tuber expansion and maturity stages of.The change in the structure and biodiversity of rhizospheric microbial community caused by the increase in the number of continuous cropping of, the decrease of beneficial microbe abundance, the increase of harmful microbe abundance, and the decrease of microbial community biodiversity are important reasons for the continuous cropping obstacles of.
(Thunb.) Breit.;continuous cropping; rhizosphere soil; PacBio sequel sequencing; microbial diversity; communitystructure
R286.2
A
0253 - 2670(2022)04 - 1148 - 08
10.7501/j.issn.0253-2670.2022.04.023
2021-05-06
国家科技部重大研发计划课题(2019YFC1712305);国家科技部重大研发计划课题(2019YFC1712302);四川省社会发展重点研发项目(2018SZ0090);四川省科技厅应用基础研究项目(2020YJ0369);2019年医疗服务与保障能力提升补助资金(中医药事业传承与发展部分)(财社[2019]39号)
刘诗蓉(1995—),硕士研究生,主要从事中药资源与开发研究。E-mail: 1310520171@qq.com.
蒋桂华,教授,主要从事中药品种与质量研究。E-mail: 11469413@qq.com
王红兰,助理研究员,主要从事土壤生态环境与中药材质量研究。Tel: (028)87428339 E-mail: honglanwang2010@126.com
[责任编辑 时圣明]
