基于NOX4/ROS/p38信号通路探讨三焦祛湿方对膜性肾病小鼠的抗氧化应激作用
2022-02-23赵亚云刘海平陈静洁陈志强
赵亚云,方 敬,刘海平, 3,陈静洁, 3,杨 帆, 3,陈志强
基于NOX4/ROS/p38信号通路探讨三焦祛湿方对膜性肾病小鼠的抗氧化应激作用
赵亚云1, 2, 3,方 敬1,刘海平1, 3,陈静洁1, 3,杨 帆1, 3,陈志强2*
1. 河北中医学院,河北 石家庄 050091 2. 河北省中医院,河北 石家庄 050011 3. 河北中医学院 河北省中西医结合肝肾病证研究重点实验室,河北 石家庄 050091
研究三焦祛湿方对阳离子化牛血清白蛋白(cationic bovine serum albumin,C-BSA)诱导的膜性肾病(membranous nephropathy,MN)小鼠的作用及其对烟酰胺腺嘌呤二核苷酸磷酸氧化酶4(nicotinamide adenine dinucleotide phosphate oxidase 4,NOX4)/活性氧(reactive oxygen species,ROS)/p38信号通路的影响,以阐明其抗氧化应激的作用机制。将60只小鼠随机分为对照组10只和造模组50只,造模组尾iv 6.5 mg/kg C-BSA建立MN小鼠模型,随机分为模型组及三焦祛湿方低、高剂量(3.71、7.42 g/kg)组和盐酸贝那普利(1.3 mg/kg)组,各给药组ig相应药物干预4周,检测各组小鼠24 h尿蛋白;腹主动脉取血,检测血清丙二醛(malondialdehyde,MDA)水平和超氧化物歧化酶(superoxide dismutase,SOD)活性;取肾组织进行苏木素-伊红(HE)、Masson、过碘酸-六胺银(PASM)染色及透射电镜(TEM),观察肾组织病理形态变化,采用免疫荧光法检测肾组织免疫球蛋白G(immunoglobulin G,IgG)沉积和ROS表达情况;采用Western blotting法检测肾组织NOX4、p38和磷酸化p38(p-p38)蛋白表达情况。与对照组相比,模型组小鼠24 h尿蛋白显著升高(<0.01);血清SOD活性显著降低,MDA水平显著升高(<0.01);肾脏病理改变明显,可见肾小球体积增大,基底膜增厚,嗜复红蛋白沉积,“钉突”形成,上皮下可见电子致密物沉积,足突融合,IgG沿毛细血管襻颗粒状沉积;肾组织ROS表达显著增多(<0.01),NOX4、p-p38蛋白表达水平显著升高(<0.01)。与模型组相比,各给药组小鼠24 h尿蛋白显著降低(<0.01);血清SOD活性明显增强,MDA水平显著降低(<0.05、0.01);肾组织病理损害明显改善;肾组织ROS表达显著减少(<0.01),NOX4和p-p38蛋白表达水平显著降低(<0.05、0.01)。三焦祛湿方能够减少尿蛋白,减轻肾脏病理损伤,缓解肾组织氧化应激,其作用机制可能与调控NOX4/ROS/p38信号通路有关。
三焦祛湿方;膜性肾病;氧化应激;烟酰胺腺嘌呤二核苷酸磷酸氧化酶4;活性氧;p38
膜性肾病(membranous nephropathy,MN)是一种免疫介导的肾小球疾病,也是成人肾病综合征最常见的病理类型,其病理特征以免疫复合物沿毛细血管襻颗粒状沉积为主。发病年龄高峰在40~60岁,男女比例约2∶1,儿童少见。近10年来,我国MN患病率逐年上升,调查显示,我国三级医院原发性肾小球病患者中,MN的比例从2010年的4.5%上升至2015年的8.8%[1]。治疗方案以激素联合烷化剂为主,2021年改善全球肾脏病预后组织[2]颁布的最新指南将利妥昔单抗列入一线治疗用药,伴随着治疗效果,骨髓抑制、感染、肿瘤及心血管疾病等不良反应也逐渐显现。因此,探索更安全有效的治疗方法势在必行。
MN发病机制以上皮下免疫复合物沉积为核心环节,沉积的免疫复合物激活补体,引起足细胞损伤和基底膜改变,随后引发肾小球损伤、肾小管萎缩以及肾间质炎症细胞浸润、纤维化,最终导致整个肾脏受损。机体受到严重损伤时,氧化应激普遍参与其中,研究发现,氧化应激在MN的发病过程中发挥重要作用[3]。活性氧(reactive oxygen species,ROS)是机体氧化应激损伤过程中生成的最主要物质之一。烟酰胺腺嘌呤二核苷酸磷酸氧化酶4(nicotinamide adenine dinucleotide phosphate oxidase 4,NOX4)是催化生成ROS的关键酶,在ROS刺激下,丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)被激活,使p38磷酸化,进一步引发肾脏氧化损伤[4]。
MN以水肿、蛋白尿等为主要临床表现,中医理论中没有MN的概念,常将本病归为“水肿”“尿浊”的范畴,病位在肾,与肺、脾、三焦相关,《景岳全书·肿胀》指出:“凡水肿等证,乃肺脾肾三脏相干之病”。因三焦气化功能在水液代谢中至关重要,所以本病病位与三焦密不可分。本课题组认为本病基本病机为脾肾阳虚为本,水湿痰瘀为标,病机关键在于三焦气化,本病以水肿为主要症状,湿是主要致病因素,治当化湿利水消肿,化湿利水基于气化,故提出三焦祛湿方。本方在前期临床研究中收效显著[5],但其对MN病理模型的作用机制尚不清楚。三焦祛湿方中藿香宣通上焦,陈皮、白术、豆蔻转运中焦,茯苓、积雪草通利下焦,黄芪、淫羊藿健脾温肾,川芎、丹参、红花、水蛭活血化瘀通络,共奏宣通三焦、健脾补肾、活血通络之功。现代药理学研究表明,黄芪提取物通过抑制核转录因子(nuclear factor-κB,NF-κB)的表达,升高NF-κB抑制因子(inhibitor of NF-κB,IκB)的表达,进而减少NF-κB通路介导的炎症介质及细胞因子的释放,以延缓系膜增生性肾小球肾炎病程[6];黄芪甲苷还可以抑制高糖诱导的足细胞氧化应激及凋亡[7];淫羊藿苷通过调节核因子E2相关因子2(nuclear factor erythroid-2-related factor-2,Nrf2)/血红素加氧酶(heme oxygenase-1,HO-1)/醌氧化还原酶1(NADPH quinone acceptor oxidoreductase 1,NQO1)信号通路减轻肾缺血再灌注损伤引起的炎症和氧化应激,并能抑制细胞凋亡[8];积雪草提取物可能是通过清除细胞内ROS实现对淋巴细胞的免疫抑制作用[9];广藿香提取物可以有效改善机体的氧化应激状态,降低丙二醛(malondialdehyde,MDA)水平,提高超氧化物歧化酶(superoxide dismutase,SOD)活性[10];水蛭冻干粉可通过Janus激酶2(Janus kinase 2,JAK2)/信号转导及转录活化因子1(signal transducer and activator of transcription 1,STAT1)/STAT3信号通路抑制糖尿病肾病引起的氧化应激及炎症反应[11]。基于以上中医传统理论及现代药理学研究,三焦祛湿方对MN动物模型的作用效果可能是通过抗氧化应激实现的。因此,本研究旨在探讨三焦祛湿方是否通过NOX4/ROS/p38信号通路改善MN小鼠的肾脏氧化应激损伤,延缓疾病进展。
1 材料
1.1 动物
SPF级雌性BALB/c小鼠(6~8周龄)60只,体质量16~19 g,购自北京维通利华实验动物技术有限公司,动物许可证号SCXK(京)2016-0006,实验动物质量合格证号110011200109599757,饲养于河北中医学院实验动物中心标准化洁净动物房,温度(23±2)℃,相对湿度50%~70%,12 h光照/12 h黑暗交替,普通饲料喂养,自由饮水。所有动物实验操作均在河北中医学院动物伦理委员会批准下进行(编号DWLL2019020)。
1.2 药物
三焦祛湿方各组成药物颗粒剂购自广东一方制药有限公司,规格如下:黄芪30 g(批号012263,每袋2.0 g,相当于饮片10 g)、淫羊藿15 g(批号010049,每袋0.5 g,相当于饮片10 g)、丹参15 g(批号101123,每袋1.8 g,相当于饮片10 g)、川芎12 g(批号101149,每袋1.3 g,相当于饮片6 g)、红花10 g(批号101149,每袋0.8 g,相当于饮片5 g)、水蛭6 g(批号012028,每袋1.5 g,相当于饮片3 g)、广藿香10 g(批号004636,每袋0.5 g,相当于饮片10 g)、陈皮15 g(批号012165,每袋3.0 g,相当于饮片18 g)、白豆蔻10 g(批号009644,每袋0.5 g,相当于饮片6 g)、积雪草30 g(批号011590,每袋1.4 g,相当于饮片15 g)、炒白术15 g(批号011271,每袋3.0 g,相当于饮片10 g)、茯苓15 g(批号012347,每袋0.5 g,相当于饮片10 g)。
1.3 试剂
盐酸贝那普利片(批号H20054771)购自深圳信立泰药业股份有限公司;阳离子化牛血清白蛋白(cationic bovine serum albumin,C-BSA,批号9058)购自美国Chondrex公司;弗氏完全佐剂(批号F5881)购自美国Sigma公司;SOD、MDA试剂盒购自南京建成生物工程研究所,批号分别为A0001-3、A003-2-2;NOX4抗体(批号14347-1-AP)购自美国Proteintech公司;p38抗体(批号A14401)购自武汉爱博泰克生物科技有限公司;磷酸化p38(p-p38)抗体(批号bs-5476R)购自北京博奥森生物技术有限公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体、HRP标记的山羊抗兔免疫球蛋白G(immunoglobulin G,IgG)抗体、电镜固定液购自武汉赛维尔生物科技有限公司,批号分别为GB12002、GB23303、G1102;FITC标记的小鼠免疫球蛋白IgG抗体(批号02-18-06)购自美国SeraCare Life Sciences公司;ROS染液(批号D7008)购自美国Sigma公司;锇酸(批号18456)购自美国Ted Pella公司。
1.4 仪器
HT7700型透射电子显微镜(TEM)、7170A型全自动生化分析仪(日本Hitachi公司);BX43型免疫荧光显微镜、BX51型光学显微镜(日本Olympus公司);正置荧光拍照显微镜(日本Nikon公司);PowerPac型电泳仪(美国Bio-Rad公司);Image Quant LAS4000化学发光成像分析仪(美国GE Healthcare公司);Image-Pro Plus 6.0分析软件(美国Media Cybemetics公司);UC7型超薄切片机(德国Leica公司)。
2 方法
2.1 三焦祛湿方的制备
将黄芪、淫羊藿、丹参、川芎、红花、水蛭、广藿香、陈皮、白豆蔻、积雪草、炒白术和茯苓按原方配比混合,为控制其质量,采用薄层色谱法对颗粒剂与对照品进行定性鉴别,并采用高效液相色谱法对主要有效成分黄芪甲苷、丹酚酸B、橙皮苷进行测定,其质量分数分别为0.5、15.0、6.0 mg/g。
2.2 模型建立、分组及给药
实验小鼠共60只,适应性喂养1周,检测尿蛋白均为阴性。随机分为对照组10只和造模组50只。首先进行预免疫,0.2 mg C-BSA(2 mg/mL)加入等体积完全弗氏佐剂充分乳化制成乳化剂,造模组小鼠sc乳化剂,对照组小鼠sc等体积的完全弗氏佐剂,2周后正式免疫,造模组小鼠隔天尾iv C-BSA(6.5 mg/kg),每周3次,对照组尾iv等体积0.9%氯化钠溶液,持续6周后,测定24 h尿蛋白>60 μg提示出现异常范围蛋白尿[5],随机选取4只行肾脏免疫荧光检测,均可见IgG沿毛细血管壁颗粒样沉积,证实MN病理模型成功建立。模型建立过程中,3只小鼠死亡,3只小鼠尿蛋白阴性予以剔除,将剩余40只小鼠随机分为模型组及三焦祛湿方低、高剂量(3.71、7.42 g/kg)组和盐酸贝那普利(1.3 mg/kg)组,每组10只。三焦祛湿方中药颗粒加入热蒸馏水中溶解,分别配制成含生药量2.379、4.758 g/mL的混悬液。各给药组ig 0.2 mL相应药物,对照组和模型组ig等体积蒸馏水,1次/d,连续4周。
2.3 24 h尿蛋白定量的检测
给药结束后,将小鼠置于代谢笼中24 h后收集尿液,4000 r/min离心10 min,取上清,按照试剂盒说明书测定24 h尿蛋白水平。
2.4 血清SOD活性和MDA水平检测
给药结束后,小鼠吸入异氟烷麻醉,腹主动脉取血,取血后15 000 r/min离心10 min收集血清,按试剂盒说明书检测血清SOD活性和MDA水平。
2.5 肾脏组织病理学变化观察
小鼠麻醉取血后,打开腹腔,剖取右肾,切取1/2放入4%多聚甲醛中,室温固定24 h,脱水、透明、浸蜡后,制作石蜡切片,分别进行苏木素-伊红(HE)、Masson、过碘酸-六胺银(PASM)染色,于显微镜下观察肾组织。
另取大米粒大小新鲜肾皮质,OCT包埋,冷冻切片,丙酮固定,PBS溶液浸洗,加入FITC标记的小鼠免疫球蛋白IgG抗体,室温孵育,再次浸洗,置于荧光显微镜下观察。
另切取2 mm×2 mm×2 mm新鲜肾组织,迅速投入电镜固定液中,4 ℃固定2~4 h,1%锇酸固定,丙酮脱水,渗透,包埋,聚合,超薄切片,铀铅双染色,于TEM下观察。
2.6 免疫荧光法检测肾组织ROS的表达
快速取出左肾,投入液氮中,后放入−80 ℃冰箱中。将肾组织制成冰冻切片,组化笔画圈,圈内滴入ROS染液,避光孵育30 min,DAPI复染细胞核,避光孵育10 min,封片,于荧光显微镜下观察图像。
2.7 Western blotting检测肾组织NOX4、p38和p-p38蛋白表达
从−80 ℃冰箱中取出肾组织,放入RIPA裂解液中,匀浆后离心,取上清。检测蛋白浓度,蛋白稀释、煮沸备用。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,于脱脂牛奶中封闭,分别加入NOX4、p38、p-p38和GAPDH抗体,4 ℃孵育过夜;加入HRP标记的山羊抗兔IgG抗体,室温孵育1 h,加入ECL试剂显影,并用ImageQuant LAS4000成像系统拍照。
2.8 统计学分析
3 结果
3.1 三焦祛湿方对MN小鼠24 h尿蛋白的影响
如表1所示,与对照组比较,模型组小鼠24 h尿蛋白显著升高(<0.01);与模型组相比,各给药组小鼠24 h尿蛋白明显降低(<0.01)。
3.2 三焦祛湿方对MN小鼠血清SOD活性和MDA水平的影响
如表1所示,与对照组比较,模型组小鼠血清SOD活性显著降低(<0.01),MDA水平显著升高(<0.01);与模型组比较,各给药组小鼠血清SOD活性明显增强(<0.05),MDA水平明显降低(<0.05、0.01)。
表1 三焦祛湿方对MN小鼠24 h尿蛋白及血清SOD活性和MDA水平的影响(, n = 10)
Table 1 Effect of Sanjiao Qushi Prescription on 24 h urinary protein quantity, SOD activity and MDA level in serum of MN mice (, n = 10)
组别剂量/(gkg−1)24 h尿蛋白/μgSOD/(UmL−1)MDA/(nmolmL−1) 对照—13.71±3.11138.61±19.657.22±3.01 模型—114.69±16.14##101.80±13.12##14.89±2.85## 三焦祛湿方3.7174.80±10.41**122.97±15.66*11.46±2.63* 7.4267.78±7.53**124.46±15.10*10.95±1.47** 盐酸贝那普利0.001 368.26±11.51**125.15±13.06*10.89±2.13**
与对照组比较:##<0.01;与模型组比较:*<0.05**<0.01,下表同
##<0.01control group;*<0.05**<0.01model group, same as below tables
3.3 三焦祛湿方对MN小鼠肾组织病理学变化的影响
如图1所示,对照组小鼠肾小球结构正常,肾小球、肾小管无异常;与对照组相比,模型组小鼠肾小球体积增大、结构紊乱,上皮下可见嗜复红蛋白沉积,基底膜呈不同程度增厚,可见“钉突”形成。与模型组比较,各给药组小鼠肾小球结构改善,偶见嗜复红蛋白,基底膜增厚程度减轻。
如图2和表2所示,免疫荧光染色下,对照组小鼠肾小球未见IgG沉积;模型组小鼠肾小球可见IgG沿毛细血管襻弥漫性颗粒状沉积,较对照组肾组织IgG沉积显著增多(<0.01);各给药组小鼠肾小球可见IgG沿毛细血管襻少量沉积,荧光强度较模型组均有不同程度减弱(<0.01)。
如图3所示,电镜下,与对照组相比,模型组小鼠基底膜显著增厚,可见电子致密物沉积,足突广泛融合,为30%~40%;与模型组相比,各给药组小鼠基底膜增厚程度较模型组减轻,足突排列较整齐,少量融合,为10%~20%,偶见电子致密物沉积。
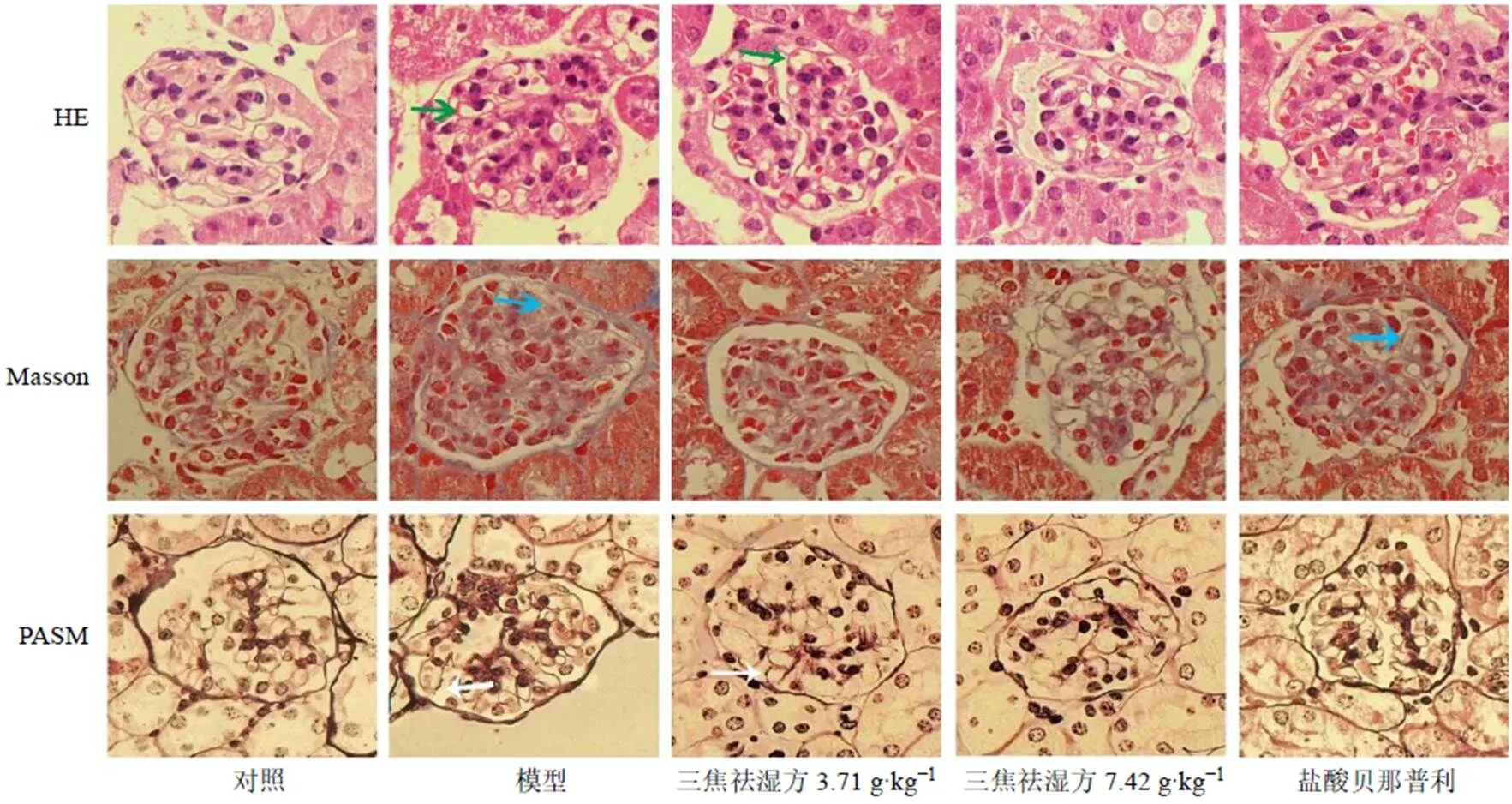
绿色箭头为基底膜增厚,蓝色箭头为嗜复红蛋白沉积,白色箭头为“钉突”形成

图2 三焦祛湿方对MN小鼠肾组织IgG沉积的影响(×400)
表2 三焦祛湿方对MN小鼠肾组织IgG沉积的影响(, n = 3)
Table 2 Effect of Sanjiao Qushi Prescription on IgG deposition in kidney of MN mice(, n = 3)
组别剂量/(gkg−1)IgG荧光强度 对照—0.009±0.001 模型—0.085±0.004## 三焦祛湿方3.710.053±0.002** 7.420.044±0.007** 盐酸贝那普利0.001 30.047±0.025**
3.4 三焦祛湿方对MN小鼠肾组织ROS表达的影响
如图4和表3所示,对照组小鼠肾组织ROS表达较少,模型组较对照组肾组织ROS表达显著增多(<0.01);各给药组肾组织ROS表达水平显著减少(<0.01)。

绿色箭头为电子致密物沉积,黄色箭头为足突融合

图4 三焦祛湿方对MN小鼠肾组织ROS表达的影响(×200)
表3 三焦祛湿方对MN小鼠肾组织ROS水平的影响(, n = 3)
Table 3 Effect of Sanjiao Qushi Prescription on ROS level in kidney of MN mice(, n = 3)
组别剂量/(gkg−1)ROS荧光强度 正常—0.02±0.01 模型—0.89±0.06## 三焦祛湿方3.710.57±0.07** 7.420.39±0.04** 盐酸贝那普利0.001 30.44±0.06**
3.5 三焦祛湿方对MN小鼠肾组织NOX4、p38和p-p38蛋白表达的影响
如图5所示,与对照组相比,模型组小鼠肾组织NOX4、p-p38蛋白表达水平显著升高(<0.01);与模型组相比,各给药组小鼠肾组织NOX4、p-p38蛋白表达水平明显降低(<0.05、0.01)。
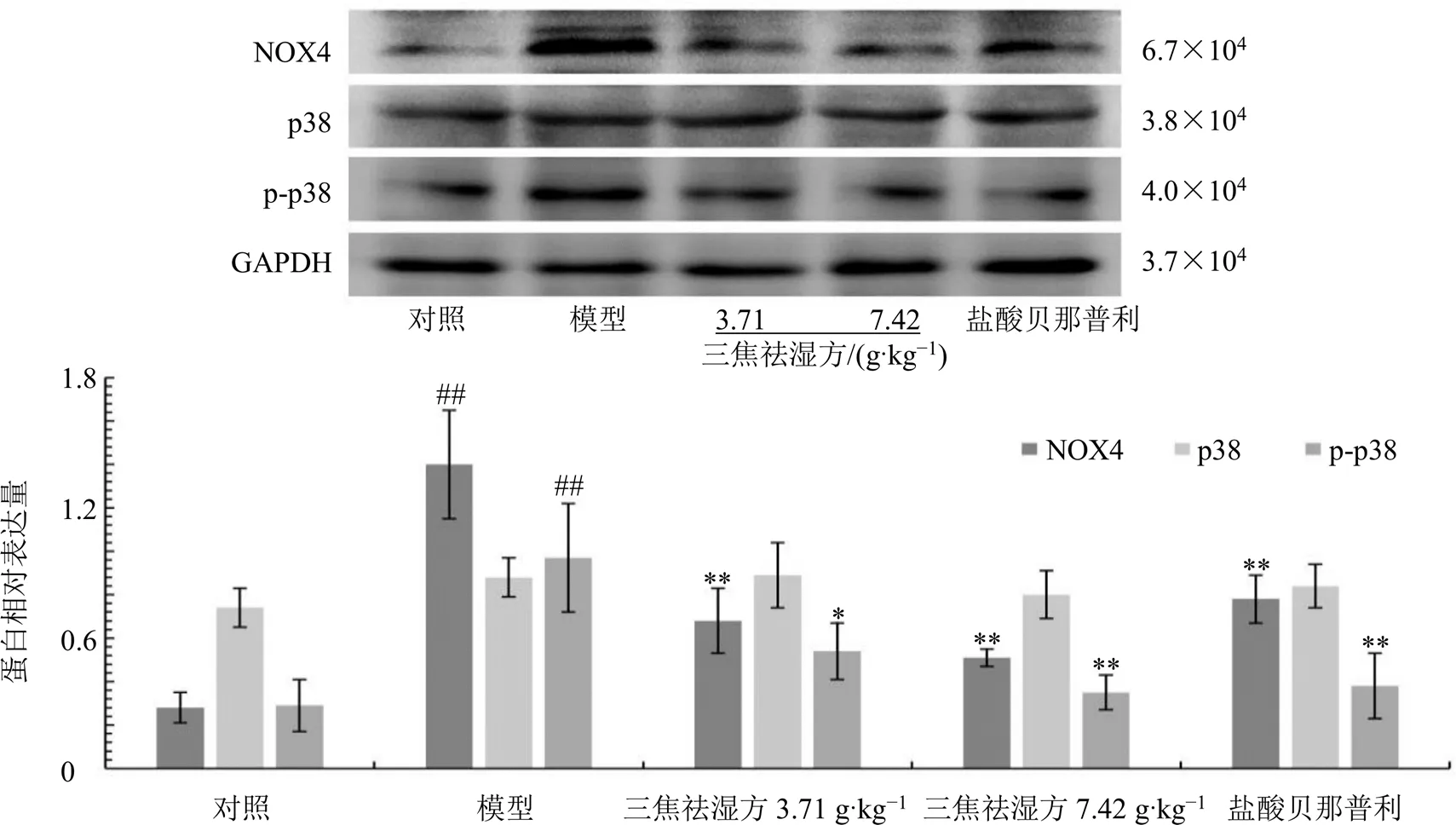
与对照组比较:##P<0.01;与模型组比较:*P<0.05 **P<0.01
4 讨论
现代医学对MN发病机制的认识尚不明确,补体激活、免疫复合物沉积等观点得到普遍认可,随后引发氧化应激、炎症反应、细胞凋亡等一系列反应。氧化应激是指机体内的氧化及抗氧化功能失调,机体内以氧化反应为主,ROS生成量超出被清理量,体内过量的ROS引发的一系列生物反应。NOX是过量ROS介导的氧化应激的重要来源酶,它将胞内电子传递给氧分子以生成ROS,其中NOX4属于NOX家族,广泛表达于肾组织,介导肾组织内的氧化应激。生理状态下,NOX4维持低水平ROS生成,机体发生缺氧、高糖时,NOX4表达上调,进而产生大量的ROS[13]。过多的ROS一方面可直接导致组织氧化损伤,另一方面可激活多个信号通路,如膜结合转运蛋白MAPK[14],作用于p38残基,使其发生磷酸化产生p-p38,p-p38作为p38通路中的关键信号分子,其表达增强是该信号通路激活的标志之一。有研究表明,芦荟苷可能通过抑制NOX4/ROS/p38信号通路发挥抗氧化应激和足细胞保护作用[15]。在本研究中,模型组小鼠肾组织内NOX4蛋白表达水平升高,ROS表达上调,p-p38蛋白表达水平升高,表明体内发生了氧化应激反应;给予三焦祛湿方干预后,肾组织内NOX4蛋白表达水平降低,ROS表达下调,p-p38蛋白表达水平降低,说明机体启动了抗氧化应激过程。SOD是细胞中的主要抗氧化酶,可以清除氧自由基,使机体免受氧化损伤侵害,其水平可以一定程度反映机体去除氧自由基的能力。MDA是ROS与其他物质发生氧化反应时脂质过氧化的产物,其水平可以一定程度反映氧化应激引起的细胞损伤程度[16]。本研究结果发现,模型组小鼠血清SOD活性显著减低,MDA水平显著升高,进一步证实机体内发生了氧化应激反应;给予三焦祛湿方干预后,小鼠血清SOD活性明显增强,MDA水平显著降低,表明三焦祛湿方推动了机体的抗氧化反应。由此可推断,三焦祛湿方干预MN小鼠模型可能是通过NOX4/ROS/p38信号通路实现其抗氧化应激作用的。
本研究采用尾iv C-BSA建立小鼠MN模型,根据文献报道[17]及预实验结果,发现预免疫后给予C-BSA 6.5 mg/kg,每周3次,持续6周,可以建立稳健的MN模型。小鼠的基因和人类相似达95%,同时人类MN以辅助T细胞2(T helper 2,Th2)介导的免疫应答为主[18],而BALB/c小鼠诱导的MN模型也是以Th2免疫应答为主[19],这为小鼠MN模型与人类MN疾病的高度相似提供了有力证据。实验证实[20-21],不同性别小鼠其生化指标、病理状态表现出较明显差异,基于本病理模型的原始文献选用雌性小鼠,故本研究也选用了雌性小鼠建立病理模型,以保证病理模型的稳定性。结果显示,模型组小鼠24 h尿蛋白明显升高,肾脏病理损害明显;给予三焦祛湿方干预后,小鼠24 h尿蛋白明显降低,肾脏病理损害呈现不同程度的减轻。
综上所述,三焦祛湿方对MN小鼠干预后效果明显,通过减少NOX4表达,使ROS产生减少,降低p38磷酸化水平,改善氧化应激程度,进而减缓肾脏组织损害,减少蛋白尿,从而发挥肾脏保护作用,延缓疾病进展。
利益冲突 所有作者均声明不存在利益冲突
[1] Li J N, Cui Z, Long J Y,. Primary glomerular nephropathy among hospitalized patients in a national database in China [J]., 2018, 33(12): 2173-2181.
[2] Kidney Disease: Improving Global Outcomes (KDIGO) Glomerular Diseases Work Group. KDIGO 2021 clinical practice guideline for the management of glomerular diseases [J]., 2021, 100(4S): S1-S276.
[3] Liu Y Y, Xu X H, Xu R S,. Renoprotective effects of isoliquiritin against cationic bovine serum albumin-induced membranous glomerulonephritis in experimental rat model through its anti-oxidative and anti-inflammatory properties [J]., 2019, 13: 3735-3751.
[4] 程闰夏, 杨琳琳, 林云, 等. p38 MAPK信号通路与肾小球疾病关系的研究进展 [J]. 山东医药, 2018, 58(14): 98-101.
[5] 张芬芳, 艾雨, 赵炳武, 等. 宣通三焦、活血通络方治疗特发性膜性肾病的临床疗效观察 [J]. 中华中医药杂志, 2020, 35(3): 1596-1598.
[6] 顾叶云, 胡莹杰, 徐蕾, 等. 黄芪、水蛭有效组分对经脂多糖诱导增生的大鼠肾小球系膜细胞IκB、NF-κB、PDGF-BB表达的影响 [J]. 中华中医药杂志, 2020, 35(2): 866-868.
[7] Xing L N, Fang J, Zhu B B,. Astragaloside IV protects against podocyte apoptosis by inhibiting oxidative stress via activating PPARγ-Klotho-FoxO1 axis in diabetic nephropathy [J]., 2021, 269: 119068.
[8] 陈明霞, 张恩, 刘芳, 等. 淫羊藿苷通过调节Nrf2/HO-1信号通路减轻大鼠肾缺血再灌注损伤 [J]. 中国免疫学杂志, 2020, 36(22): 2721-2725.
[9] 贺惠娟, 李菁, 朱伟杰, 等. 积雪草提取物的抗氧化及免疫调节作用研究 [J]. 中国病理生理杂志, 2010, 26(4): 771-776.
[10] 郭洁, 杨振, 黄伟. 广藿香酮通过下调NF-κB表达和抑制氧化应激减轻非酒精性脂肪性肝病 (NAFLD) 大鼠的肝损伤 [J]. 细胞与分子免疫学杂志, 2021, 37(2): 146-151.
[11] 杨帆, 曹晨, 方敬, 等. 水蛭冻干粉对糖尿病肾病大鼠肾组织损伤的保护作用 [J]. 中草药, 2021, 52(4): 1020-1025.
[12] 秦川. 实验动物学 [M]. 北京: 人民卫生出版社, 2010: 419.
[13] Zhang Y, Mao X D, Cao A L,. Astragaloside IV prevents endothelial dysfunction by improving oxidative stress in streptozotocin-induced diabetic mouse aortas [J]., 2021, 22(5): 1197.
[14] Ton T T, Kovi R C, Peddada T N,. Cobalt-induced oxidative stress contributes to alveolar/bronchiolar carcinogenesis in B6C3F1/N mice [J]., 2021, 95(10): 3171-3190.
[15] 马冰沁, 钱唯韵, 罗振国, 等. 芦荟苷对糖尿病肾病大鼠NOX4/ROS/p38 MAPK信号通路及足细胞功能的影响 [J]. 中国比较医学杂志, 2020, 30(9): 1-7.
[16] Zheng S L, Zhu J R, Li J,. Leonurine protects ischemia-induced brain injury via modulating SOD, MDA and GABA levels [J]., 2019, 6(2): 197.
[17] Wu C C, Chen J S, Lin S H,. Experimental model of membranous nephropathy in mice: Sequence of histological and biochemical events [J]., 2008, 42(3): 350-359.
[18] Hirayama K, Ebihara I, Yamamoto S,. Predominance of type-2 immune response in idiopathic membranous nephropathy. Cytoplasmic cytokine analysis [J]., 2002, 91(2): 255-261.
[19] Chen J S, Chen A, Chang L C,. Mouse model of membranous nephropathy induced by cationic bovine serum albumin: Antigen dose-response relations and strain differences [J]., 2004, 19(11): 2721-2728.
[20] 黎桂玲, 刘科, 黎雄才, 等. 不同生理阶段及性别SPF级BALB/c小鼠和C57BL/6小鼠血液生理生化指标测定与比较 [J]. 广东农业科学, 2019, 46(12): 102-109.
[21] Silva-Santana G, Bax J C, Fernandes D C S,. Clinical hematological and biochemical parameters in Swiss, BALB/c, C57BL/6 and B6D2F1 Mus musculus [J]., 2020, 3(4): 304-315.
Mechanism of Sanjiao Qushi Prescription on anti-oxidative sress of mice with membranous nephropathy based on NOX4/ROS/p38 signaling pathway
ZHAO Ya-yun1, 2, 3, FANG Jing1, LIU Hai-ping1, 3, CHEN Jing-jie1, 3, YANG Fan1, 3, CHEN Zhi-qiang2
1. Hebei University of Chinese Medicine, Shijiazhuang 050091, China 2. Hebei Hospital of Traditional Chinese Medicine, Shijiazhuang 050011, China 3. Hebei Key Laboratory of Integrative Medicine of Liver-Kidney Patterns, Hebei University of Chinese Medicine, Shijiazhuang 050091, China
To study the effects of Sanjiao Qushi Prescription (三焦祛湿方) on cationic bovine serum albumin (C-BSA) induced membranous nephropathy (MN) mice model and nicotinamide adenine dinucleotide phosphatase oxidase4 (NOX4)/reactive oxygen species (ROS)/p38 signaling pathway, and elucidate the mechanism of anti-oxidative stress.Sixty mice were randomly divided into control group (= 10) and model group (= 50), mice were iv C-BSA (6.5 mg/kg) by tail to establish MN model, which were randomly divided into model group, low-, high-dose Sanjiao Qushi Prescription (3.71, 7.42 g/kg) groups and benazepril hydrochloride (1.3 mg/kg) group. Mice were ig corresponding drugs for four weeks, 24 h urine protein were detected. Serum was collected, superoxide dismutase (SOD) activity and malondialdehyde (MDA) level were measured. Renal tissue was collected, pathological morphology changes were observed by light microscope with hematoxylineosin (HE), Masson and periodic acid-silver metheramine (PASM) staining and transmission electron microscope (TEM). Deposition of immunoglobulin G (IgG) and ROS expression in renal tissue was observed by fluorescence immunoassay. Western blotting was used to detect NOX4, p38 and p-p38 protein expressions in renal tissue.Compared with control group, 24 h urine protein of mice in model group was significantly increased (< 0.01), SOD activity was decreased and MDA level was increased (< 0.01) in model group; Kidney exhibited enlarged volume of glomerular, significantly thickened glomerular basement membrane, polymyoglobin deposition and spike formation from the light microscope, epithelium deposition of electron dense, foot process fusion were observed from transmission electron microscope; Granular deposition of IgG along the capillary wall was observed by immunofluorescence staining; ROS expression in kidney was significantly increased (< 0.01); NOX4 and p-p38 protein expressions were significantly increased (< 0.01). Compared with model group, 24 h urine protein in each administration group was significantly decreased (< 0.01), SOD activity was obviously increased and MDA level was decreased (< 0.05, 0.01); pathological damages of renal were alleviated; ROS expression in renal tissue was significantly decreased (< 0.01); NOX4 and p-p38 protein expressions in renal tissue were significantly decreased (< 0.05, 0.01).Sanjiao Qushi Prescription can decrease 24 h urine protein, ameliorate renal pathological damages, alleviate oxidative stress in kidney, its mechanism may be possibly related to the regulation of NOX4/ROS/p38 signaling pathway.
Sanjiao Qushi Prescription; membranous nephropathy; oxidative stress; nicotinamide adenine dinucleotide phosphate oxidase 4; reactive oxygen species; p38
R285.5
A
0253 - 2670(2022)04 - 1076 - 08
10.7501/j.issn.0253-2670.2022.04.014
2021-11-03
河北省政府资助省级临床医学优秀人才项目(2016034829);河北省中医药管理局科研计划项目(2021039);河北省研究生创新资助项目(XCXZZBS2021021)
赵亚云(1989—),女,主治医师,博士研究生,从事慢性肾脏病的中医药治疗及机制研究。E-mail: DoctorCindy2020@126.com
陈志强(1962—),男,教授,博士生导师,从事慢性肾脏病的中医药治疗及机制研究。E-mail: chenzhqiang2011@163.com
[责任编辑 李亚楠]
