参枣滴丸质量标准研究
2022-02-22胡涛刘渠曾霞梁生旺王淑美汤丹张陆勇
胡涛,刘渠,曾霞,梁生旺,王淑美,汤丹,张陆勇
(1.广东药科大学中药学院,广东 广州 510006;2.国家中医药管理局中药数字化质量评价技术重点研究室,广东 广州 510006;3.广东省中药质量工程技术研究中心,广东 广州 510006;4.广东药科大学药学院,广东 广州 510006;5.广东药科大学新药研发中心,广东 广州 510006)
参枣滴丸是本课题组在研的中药复方新药,由广枣、丹参、人参、降香、苏合香、冰片六味药组成,具有理气止痛、活血化瘀等功效。本品另辟蹊径,以理气止痛治标、活血化瘀达血脉通畅为本,标本兼治,可久服,不伤正气,用于气滞血瘀型胸痹,西医病症为冠心病。方中广枣和丹参为君药,其中广枣具有行气活血、养心、安神之功,多用于气滞血瘀、胸痹作痛、心悸气短、心神不安。从目前临床上比较推崇的“双心治疗”法来看,广枣不仅能够行气活血,治疗生理学上的心脏病变,也具有养心安神功效,可对患者术后的心理进行辅助治疗,从而达到双心治疗的效果。
广枣中富含没食子酸和有机酸,文献报道没食子酸可抑制心肌梗死后的心肌纤维化[1],总有机酸对心肌缺血再灌注损伤具有保护作用[2],且广枣中总黄酮具有抗心律失常作用、抗结肠癌细胞Caco‑2增殖、抗氧化、抗炎[3‑7]等药理作用。2020年版《中国药典》中将没食子酸作为含量测定和薄层鉴别的指标成分,因此本文将没食子酸作为参枣滴丸的含量测定指标,参考《中国药典》2020年版一部制定了广枣[8]45、丹参[8]1311、人参[8]8、苏合香[8]172、冰片[8]615味药的薄层鉴别方法和没食子酸[8]45的含量测定方法,为参枣滴丸成品的质量控制提供科学依据。
1 仪器与材料
1.1 仪器
LC‑20AT岛津高效液相色谱分析仪(日本岛津株式会社);SQP电子分析天平[赛多利斯科学仪器(北京)有限公司];ME104电子分析天平[梅特勒‑托利多仪器(上海)有限公司];JJ500电子天平(常熟市双杰测试仪器厂);KQ‑300DZ超声波清洗机(昆山市超声仪器有限公司);Linomat 5‑卡玛薄层半自动点样仪(瑞士CAMAG公司);默克硅胶G60板(德国默克有限公司);青岛海洋硅胶G板(青岛海洋化工厂分厂);黄海硅胶GF254板(烟台江友硅胶开发有限公司)。
1.2 试药
广枣对照药材(批号:121334‑200401)、人参对照药材(批号:120917‑201712)、丹参对照药材(批号:120923‑201615)、苏合香对照药材(批号:120931‑201804)、龙脑对照品(批号:110881‑201709,质量分数99.6%)、没食子酸对照品(批号:110831‑201906,质量分数91.5%)、人参皂苷Rg1(批号:110703‑201933,质量分数92.4%)、人参皂苷Re(批号:110754‑202028,质量分数93.4%)、人参皂苷Rb1对照品(批号:110704‑201827,质量分数91.2%)、肉桂 酸 对 照 品(批 号:110786‑201604,质 量 分 数98.8%)、丹参素钠对照品(批号:110855‑201915,质量分数97.8%)均购于中国食品药品检定研究院;参枣滴丸中试样品(批号20201011)、参枣滴丸中试滴丸成品样品(批号:20201208、20201209、20201210)、参枣滴丸阴性样品均为自制。
2 方法与结果
2.1 薄层鉴别
2.1.1 广枣薄层鉴别 取参枣滴丸适量,研细,取粉末1 g,5 mL纯化水溶解,15 mL乙酸乙酯萃取2次,合并上层溶液,蒸干,甲醇定容至1 mL,即得供试品溶液。取缺广枣阴性滴丸1 g,同法制成参枣滴丸缺广枣阴性供试品溶液。取广枣对照药材1 g,加70%(体积分数,下同)乙醇30 mL,加热回流1 h,滤过,滤液蒸干,5 mL纯化水溶解,其余步骤同供试品溶液制备方法,得广枣对照药材溶液。取没食子酸对照品适量,加甲醇,制得质量浓度为1 mg/mL的对照品溶液。照《中国药典》2020版[8]通则0502试验,吸取上述溶液各2μL,点于默克G60板上,使点样斑点成条带状,置于展开剂(三氯甲烷‑丙酮‑甲酸,体积比7∶2∶1)中,展开,取出晾干,置双槽展开缸中,以氨蒸气为显色剂,熏至黄色斑点清晰。供试品色谱中,供试品与对照药材、对照品相同高度的位置上,显相同黄色条带斑点,缺广枣阴性样品无该条带斑点,结果见图1。
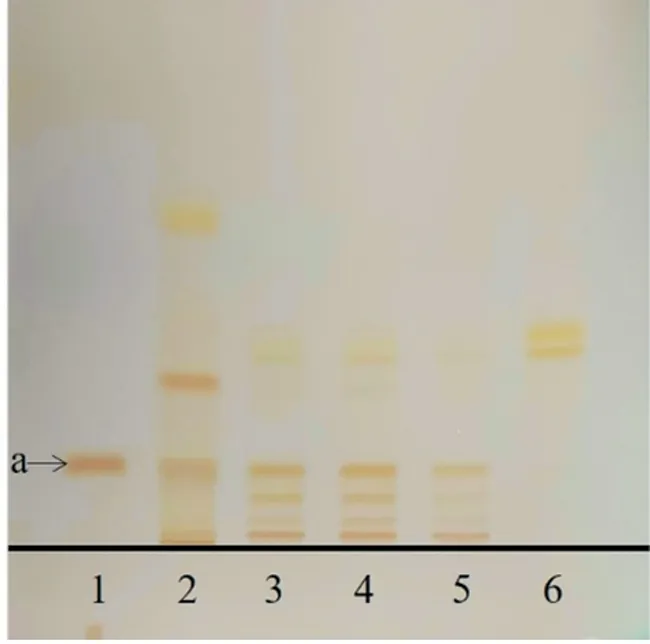
图1 广枣的薄层鉴别Figure 1 TLCidentification of Choerospondiatis Fructus
2.1.2丹参薄层鉴别 取参枣滴丸适量,研细,取粉末1 g,加纯化水30 mL,超声30 min,加浓盐酸2滴,调pH小于2,20 mL乙酸乙酯萃取2次,合并上层溶液,蒸干,甲醇定容至1 mL,得供试品溶液。取参枣滴丸缺丹参阴性样品1 g,同法制成参枣滴丸缺丹参阴性供试品溶液。取丹参对照药材1 g,加纯化水30 mL,加热回流30 min,加浓盐酸2滴,调pH小于2,其余步骤同供试品溶液制备方法,得丹参对照药材溶液。取丹参素钠对照品适量,加甲醇,制得质量浓度为1 mg/mL的对照品溶液。照《中国药典》2020版[8]通则0502试验,吸取供试品溶液和阴性溶液5μL、对照品和对照药材溶液2μL,点于青岛海洋G板上,使点样斑点成条带状,置于展开剂(三氯甲烷‑丙酮‑甲酸,体积比25∶10∶4)中,展开,取出,晾干,以氨蒸气为显色剂,熏蒸5 min,呈淡黄色条带,105℃加热5 min后,取出在紫外光灯(365 nm)下观察,显荧光条带。供试品色谱中,供试品与对照药材、对照品相同高度的位置上,显相同黄色条带或天蓝色荧光条带,缺丹参阴性样品无该条带斑点,结果见图2。
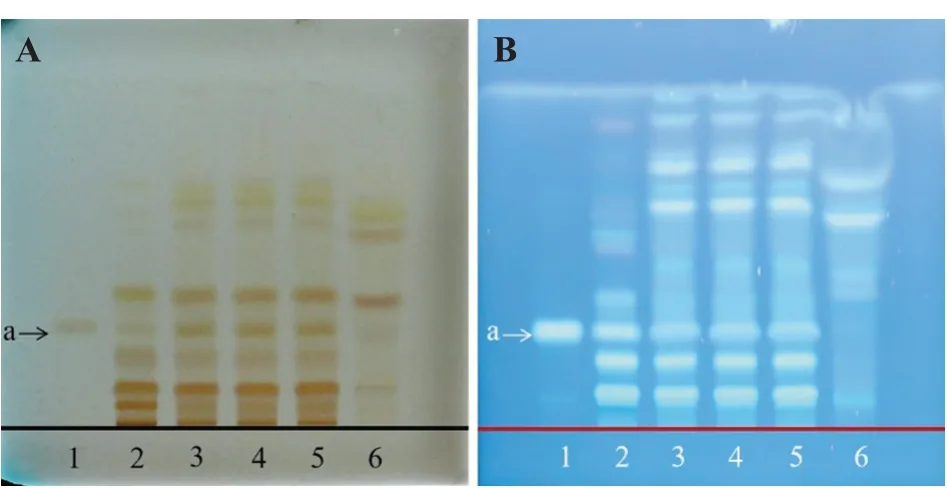
图2 丹参的薄层鉴别Figure 2 TLC identification of Salviae miltiorrhizae Radix et Rhizome
2.1.3 苏合香薄层鉴别 取参枣滴丸适量,研细,取粉末1 g,加乙醚10 mL,超声10 min,滤过,滤液挥干,甲醇定容至1 mL,得供试品溶液。取参枣滴丸缺苏合香阴性样品1 g,同供试品溶液方法制成参枣滴丸缺苏合香阴性供试品溶液。取苏合香对照药材1 g,与供试品同法制备,得苏合香对照药材溶液。取肉桂酸对照品适量,加甲醇,制得质量浓度为2 mg/mL的对照品溶液。照《中国药典》2020版[8]通则0502试验,吸取上述溶液,各2μL,点于黄海GF254板上,置于展开剂[石油醚(30~60℃)‑正己烷‑甲酸乙酯‑甲酸,体积比10∶30∶15∶1]中,展开,取出,晾干,置紫外光灯(254 nm)下观察。供试品色谱中,供试品与对照药材和对照品相应的位置上,显相同高度的暗斑,缺苏合香阴性样品无暗斑,结果见图3。
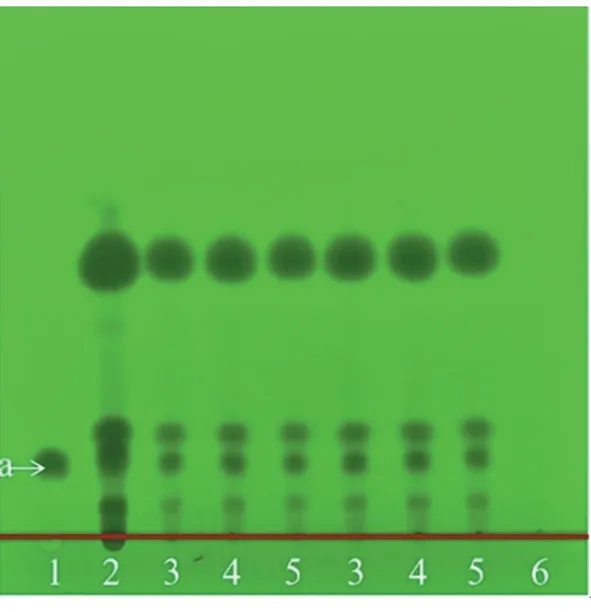
图3 苏合香的薄层鉴别Figure 3 TLCidentification of Styrax
2.1.4 人参薄层鉴别[9]取参枣滴丸适量,研细,取粉末4 g,加纯化水20 mL,超声30 min,乙酸乙酯萃取2次,每次20 mL,弃去上层溶液,水饱和正丁醇提3次,每次20 mL,合并上层溶液,用1%NaOH碱水洗涤2次,每次20 mL,弃去下层,正丁醇饱和水萃取2次,每次20 mL,弃去下层,取上层蒸至1~2滴溶液,甲醇定容至1 mL,得供试品溶液。取参枣滴丸缺人参阴性样品1 g,同法制成参枣滴丸缺人参阴性供试品溶液。取人参对照药材1 g,加甲醇30 mL,加热回流1 h,放冷,滤过,滤液蒸干,残渣加纯化水20 mL溶解,用乙酸乙酯萃取2次,其余步骤同供试品制备,得人参对照药材溶液。取人参皂苷Rb1对照品、人参皂苷Re对照品及人参皂苷Rg1对照品,加甲醇,制得质量浓度为2 mg/mL的混合溶液,作为人参混标对照品溶液。照《中国药典》2020版[8]通则0502试验,吸取上述溶液各2µL,点于默克G60板上,使点样斑点成条带状,置于展开剂(三氯甲烷‑乙酸乙酯‑甲醇‑水,体积比15∶40∶22∶10,10℃以下放置的下层溶液)中,展开,取出,晾干,以10%硫酸乙醇溶液为显色剂显色,在105℃加热至斑点显色清晰,分别置日光和紫外光灯(365 nm)下观察。供试品色谱中,供试品与对照药材和对照品相应位置上,显相同砖红色斑点或荧光斑点,缺人参阴性样品无该斑点,结果见图4。
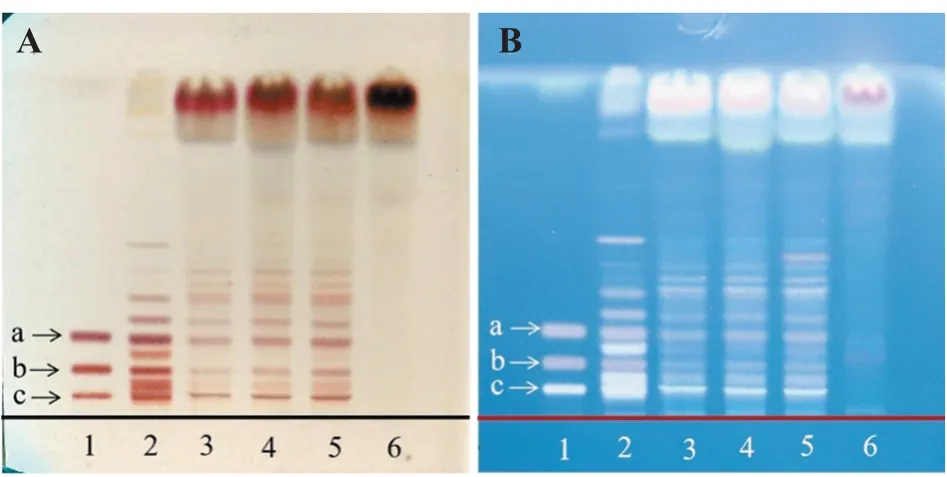
图4 人参的薄层鉴别Figure 4 TLC identification of Ginseng Radix et Rhizoma
2.1.5 冰片薄层鉴别 取参枣滴丸适量,研细,取粉末1 g,加乙醚10 mL,超声10 min,滤过,滤液挥去乙醚,甲醇定容至1 mL,得供试品溶液。取参枣滴丸缺冰片阴性样品1 g,同法制成参枣滴丸缺冰片阴性供试品溶液。取冰片对照品龙脑适量,加甲醇,制得质量浓度为1 mg/mL的作为对照品溶液。照《中国药典》2020版[8]通则0502试验,分别吸取上述溶液各2µL,点于青岛海洋G板上,置于展开剂(乙酸乙酯‑正己烷,体积比3∶7)中,展开,取出,取出,晾干,以1%香草醛硫酸液为显色剂显色,于105℃下加热至各斑点清晰。供试品色谱中,与对照药材相应的位置上,显相同颜色的斑点,缺冰片阴性样品无该斑点,结果见图5。
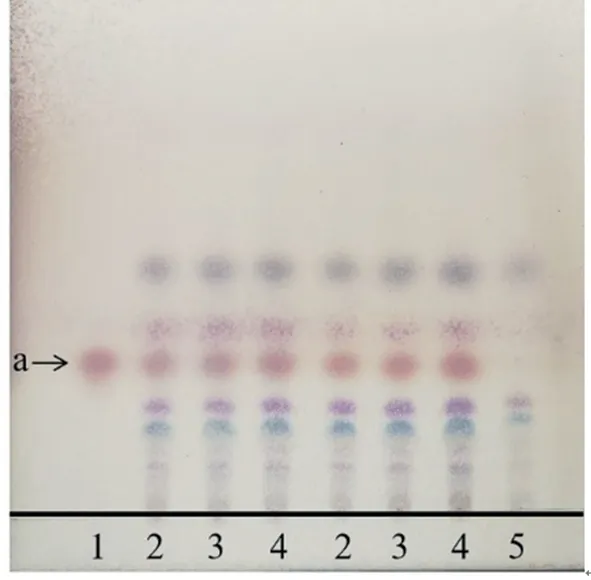
图5 冰片的薄层鉴别Figure 5 TLCidentification of Borneol
2.2 含量测定
2.2.1 色谱条件与系统适用性试验 采用FeiniGe‐nXPeonyx AQ‑C18(4.6 mm×250 mm,5μm)色谱柱,柱温设为25℃,流动相:甲醇‑0.3%冰乙酸(体积比1∶99)等度洗脱,检测波长:270 nm,流速:1.0 mL/min,进样量:10μL。
在上述色谱条件下,没食子酸基本上可达到基线分离,分离度>1.5。理论塔板数以没食子酸峰计算应不低于3 000。
2.2.2 对照品溶液的制备 精密称取没食子酸14.53 mg,于10 mL容量瓶中,甲醇定容,得储备液。精密吸取储备液1.0 mL于10 mL量瓶,稀释10倍,为中间稀释液。精密吸取中间稀释液0.5 mL,于10 mL容量瓶中,甲醇定容,摇匀,即得质量浓度为7.265μg/mL的对照品溶液。
2.2.3 供试品溶液的制备 取适量滴丸,研细,精密称取l g,精密称定,置具塞锥形瓶中,精密加入70%甲醇50 mL,称定质量,加热回流1 h,放冷,再称定质量,用70%甲醇补足减失的质量,摇匀,滤过,取续滤液,即得。
2.2.4 阴性对照溶液的制备 按参枣滴丸的处方配比和工艺制备缺广枣阴性对照样品,按“2.2.3”项方法制备广枣阴性供试品溶液。
2.2.5 专属性试验 分别精密吸取对照品溶液、供试品溶液和阴性样品溶液各10 mL,按“2.2.1”项方法条件进样测定,记录色谱图,结果见图6。可见,参枣滴丸没食子酸测定供试品和没食子酸对照品在对应的位置上,可以检测相同的色谱峰,光谱吸收行为基本一致;同时,在参枣滴丸缺广枣阴性样品色谱图与指标成分没食子酸相对应位置上,未检测到干扰成分,表明该方法专属性良好。

图6 没食子酸对照品、参枣滴丸供试品及参枣滴丸广枣阴性供试品HPLC色谱图Figure 6 HPLC chromatograms of Gallic acid,Shenzao drip‐ping pills sample,Shenzao dripping pills Choerospondiatis Fructus negativesample
2.2.6 线性关系考察 精密称定没食子酸对照品10.34 mg,加甲醇定容至10 mL,摇匀,作为没食子酸母液,精密吸取母液适量,甲醇稀释定容,配得质量浓度为0.437 5、2.068 0、6.204 0、10.340 0、12.408 0μg/mL的系列对照品溶液,进样量为10μL,进行液相分析得峰面积,以质量浓度为横坐标(X)、对照品峰面积为纵坐标(Y),进行线性回归分析,得回归方程Y=26 625X-5 813.3,r=0.999 9。结果表明,没食子酸质量浓度在0.437 5~12.408 0μg/mL范围内与峰面积线性关系良好。
2.2.7 精密度试验 取“2.2.2”项没食子酸对照品溶液1份,进样量为10μL,进行液相分析,连续进样6次,测定没食子酸的峰面积,计算峰面积RSD值。结果显示,没食子酸的峰面积RSD值为0.47%,表明仪器精密度良好。
2.2.8 稳定性试验 取一份参枣滴丸中试样品(批号20201011),按按“2.2.3”项方法制备供试品溶液,于0、1、2、4、8、12、24 h进样测定,计算峰面积RSD值。结果显示,没食子酸的峰面积RSD值为0.92%,表明供试品溶液在24 h内稳定性良好。
2.2.9 重复性试验 精密称取同一批参枣滴丸中试样品(批号20201011)共6份,按“2.2.3”项方法制备供试品溶液,按照“2.2.1”项条件进样,记录其峰面积,分别计算其质量分数和RSD值。结果显示,没食子酸的RSD值为0.76%,表明方法重复性良好。
2.2.10 加样回收率试验 精密称取同一批参枣滴丸中试样品(批号20201011)共6份,每份精密加等量的对照品溶液,按照“2.2.3”项方法制备供试品溶液,按照“2.2.1”项条件进样,计算回收率,结果如表1。可见,6份供试品中没食子酸的加样回收率在95.32%~97.87%之间,RSD值为1.08%,表明方法准确度良好。
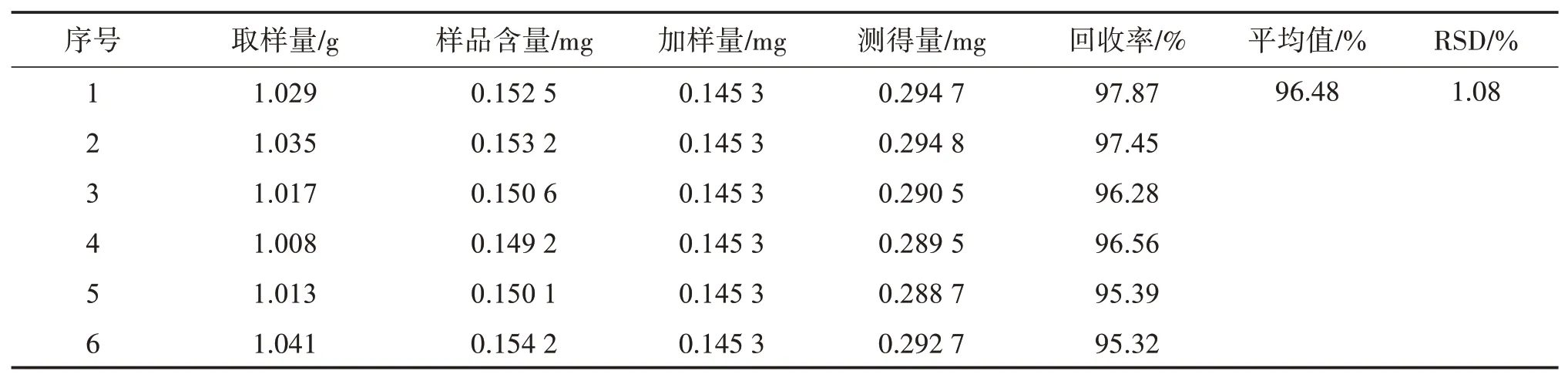
表1 参枣滴丸中试样品没食子酸加样回收率性试验结果Table 1 Recoveries of gallic acid in Shenzao dripping pills pilot finished product(n=6)
2.2.11 样品质量分数的测定 3批中试参枣滴丸(批号20201208、20201209、20201210,规 格2 g/袋)每批各取2份样品,按照“2.2.1”项条件进样,并计算样品质量分数,结果测得3批样品的质量分数分别为337.21、360.45、339.27μg/袋,平均值为345.64μg/袋。
3 讨论
本研究参考2020年版《中国药典》[8]和文献[9‑10],采用TLC法对参枣滴丸中五味药材进行定性鉴别。对广枣和丹参的薄层色谱研究过程中,发现点样形状呈点状的分离效果较差,而成条带状的分离效果较好;丹参的定性鉴别参考《中国药典》中复方丹参滴丸的薄层鉴别方法,并进行了优化,发现丹参素钠与氨气反应后的黄色斑点,经105℃烘烤5 min后在紫外365 nm下荧光效果最强,因而确定该显色条件。在苏合香薄层色谱中,阴性样品在紫外254 nm照射下未见暗斑,因样品乙醚提取后,仅苏合香中成分在紫外254 nm产生暗斑。在人参薄层鉴别中,萃取步骤较多,人参皂苷易在提取过程中损失,需对溶液进行充分振摇、静置过夜或离心分离,以达到更好的提取效果。本研究前期对薄层展开温度和不同厂家薄层板进行了考察,发现人参在4℃条件下薄层展开效果最好;烟台黄海GF254板相比于默克G60和青岛海洋硅胶G板,能够更好地对肉桂酸干扰斑点进行分离,无需控温。
采用HPLC法对没食子酸进行测定,通过查阅2020年版《中国药典》[8]和文献[11‑13],比较了4种没食子酸含量测定的前处理方法,考察不同浓度甲醇、不同提取方式、不同提取时间对没食子酸的含量影响,发现相对于超声提取、加热回流0.5 h和50%甲醇提取,70%甲醇加热回流提取1 h的前处理方法没食子酸含量最高。最终采用70%甲醇加热回流1 h为本品的前处理方法。
通过查阅2020年版《中国药典》和文献[14‑15],对降香进行了多次薄层展开试验,但均未显现特异性斑点,未能完成参枣滴丸中降香的薄层鉴别,后期考虑采用HPLC法对其质量控制进行研究,以完善参枣滴丸的质量控制体系。本研究作为初步的参枣滴丸质量控制研究,将君药广枣作为滴丸质量控制的一个重点,为临床前研究的滴丸质量控制提供依据,在后续研究中,将继续对滴丸中人参、丹参等贵重药材进行质量控制,在满足药物疗效的同时,对企业的质量控制成本进行合理分析,以此确定最终的质量控制标准。
本文通过对参枣滴丸的君药广枣进行定性和定量鉴别,并制定了参枣滴丸中丹参、人参、冰片和苏合香薄层鉴别方法,质量可控,分离度较好,重现性高,可以作为参枣滴丸的质量控制标准,为参枣滴丸的制剂提供了质量控制依据,为临床用药的有效性和合理性提供了质量保障。
