雷公藤内酯醇通过调控miR-194的表达诱导肝癌HepG2细胞凋亡和自噬
2022-02-22李春雨
李春雨,杨 航
(1.深圳市龙华区中心医院 广东医科大学附属龙华中心医院,广东 深圳 518110;2.武汉市中西医结合医院肿瘤科,湖北 武汉 430000)
传统中药雷公藤(Tripterygium wilfordii Hook F.)属于卫矛科雷公藤属植物,又名断肠草,主要分布在浙江、江西、安徽、湖南等长江以南地区[1]。雷公藤的主要化学成分包括糖类、二萜类、倍半萜类等[2],其中雷公藤内酯醇(TPL)是目前研究较为充分的一种二萜类化合物,又名雷公藤甲素、雷公藤内酯[3]。据古籍记载,TPL被用于治疗自身免疫性疾病和炎性反应相关疾病,如类风湿关节炎和系统性红斑狼疮等已有上百年历史,已有雷公藤多苷片、雷公藤片和雷公藤总萜片等被开发成中成药,其良好的治疗效果得到临床上的一致认可。近年来研究表明,TPL对肝癌、肺癌、乳腺癌、结肠癌等多种癌症细胞均有良好的增殖抑制效果[4-7]。miRNAs是一类小的内源性非编码RNA,一般通过与靶向mRNA的3′UTR结合来抑制mRNA翻译或诱导mRNA降解,其被认为是调节癌症进展的关键癌基因或抑癌基因,能够广泛参与到肿瘤的发生发展过程[8-9]。最近的研究表明,miR-194能够抑制肝癌细胞和黑色素瘤细胞的增殖和侵袭,且miR-194的表达在肝癌肝细胞中显著下调[10-11]。然而TPL抑制肝癌细胞增殖是否通过调节miR-194的表达以及其作用机制尚不得知。本文旨在探究TPL抑制肝癌HepG2细胞是否通过影响miR-194的表达以及其具体作用机制,为TPL抗肝癌进一步提供理论依据。
1 材料与方法
1.1实验材料:HepG2细胞购自美国典型培养物保藏中心(ATCC);RPMI-1640培养基和Lipofectamine 2000试剂盒(Invitrogen);雷公藤内酯醇( 南京泽朗生物科技有限公司,纯度为99%) ; 胎牛血清(Gibco);MTT 试剂盒(碧云天生物科技有限公司);PCR反转录试剂盒和TaqMan MicroRNA Assays 试剂盒[大连宝生物工程(大连)有限公司];鼠抗人 LC3-Ⅰ、LC3-Ⅱ、Beclin-1、Bax、Bcl-2和Caspase-3 单克隆抗体(CST);辣根过氧化酶标记的兔抗鼠酶标的二抗(碧云天生物科技有限公司);miR-194 和 U6 引物[生工生物工程(上海) 股份有限公司];ABI 7500 型PCR仪(Applied Biosystems);凝胶成像分析仪(Bio-Rad)。本次研究经过本院医学伦理委员会同意。
1.2细胞培养和分组:将HepG2细胞从液氮罐中取出、复苏,在含10%血清、1×105U/L青霉素和100 mg/L链霉素的RPMI-1640培养基中培养,条件为37℃、5%二氧化碳及饱和湿度。
1.3MTT实验:将对数生长期的HepG2细胞以6 000个/孔的密度接种于96孔板中,于37℃、5%二氧化碳及饱和湿度条件下培养。待细胞贴壁后,将培养基替换为含10 nmol/L、20 nmol/L、40 nmol/L、80 nmol/L TPL的含药培养基,空白组替换为新鲜空白培养基,分别培养24 h和48 h,每孔加10 μl MTT,继续培养4 h,弃去上清,每孔加入150 μl DMSO,振板器振动10 min,用酶标仪检测490 nm波长处的吸光度。
1.4RT-qPCR实验:当70%~80%细胞融合时,将细胞分为3组,分别给予不同浓度(0、20和40 nmol/L)TPL处理细胞48 h后,采用TRIzol法提取细胞总mRNA,采用TaqMan MicroRNA逆转录试剂盒反转录为cDNA,反应总体系为10 μl用TaqMan MicroRNA Assays试剂盒检测miR-194 的 表达,以U6作为内参照,miR-194的上游引物序列为5′-GAGTTTGATCATGGCTCAGAGAGTTTGATCCTG-3′,下游引物序列为5′-CGACGGCCAGTCTTACCAGGAAACAGCTATG-3′;U6的上游引物序列为5′-CTCGCTTCGGCAGCACA-3′,下游引物序列为5`-AACGCTTCACGAATTTGCGT-3′,每组设3个重复,根据各样本的平均Ct值,以2-△△Ct表示miRNA相对表达水平,所有反应均在 ABI 7500实时定量PCR仪完成。
1.5Western印迹实验:当70%~80%细胞融合时,将细胞分为三组,分别给予不同浓度(0、20和40 nmol/L)TPL处理细胞48 h后,提取各组细胞总蛋白。用BCA蛋白定量试剂盒对提取的蛋白进行定量测定。调整每个样本的蛋白量一致,进行聚丙烯酰胺凝胶电泳,电泳结束后将蛋白转移至NC膜上,用含5 %脱脂奶粉的TBST溶液封闭2 h,加入相应的一抗,封闭过夜,TBST洗膜3次,10 min/次,再加入相应的二抗,封闭1 h,TBST洗膜3次,10 min/次。将ECL发光液(A液∶B液=1∶1)混合均匀后滴加于NC膜上,用FluorChem FC3凝胶成像仪显影拍照,并用Quantity One软件进行半定量分析,以目的蛋白与GAPDH条带的荧光强度比值,来表示目的蛋白的相对表达量。
1.6细胞转染实验:当细胞融合至70%~80% 时,将细胞分成5组:对照组、miR-194 mimic转染 (miR-194 mimic)组、miR-194 mimic阴性对照转染(miR-194 NC)组、TPL组和 miR-194 mimic转染+TPL(miR-194 mimic+TPL)组。将 miR-194 mimic和阴性对照分别转染至HepG2 细胞,室温中放置 20 min 后, 分别加入培养孔,继续孵育4 h。其中对照组不做任何处理;TPL处理组用 40 nmol/L TPL处理细胞24 h;miR-194 mimic转染 + TPL组在转染后, 更换含有血清的完全培养基, 再用40 nmol/L TPL处理24 h。转染按照 Lipofectamine 2000 试剂盒说明,将目的细胞按5×105/孔接种在24孔板中,于第2天使用Lipofectamine 2000将50 nmol/L miR-194 mimic转染目的细胞。提取细胞总 RNA 进行荧光定量 PCR 检测 miR-194,提取总蛋白检测相关蛋白的表达,方法同1.4和1.5。
1.7统计学分析:采用SPSS22.0 统计学软件进行单因素方差分析、t检验。
2 结果
2.1TPL抑制HepG2细胞的增殖:由图1可知,与Control组相比,各浓度TPL处理HepG2细胞后,其中20 nmol/L、40 nmol/L、80 nmol/L TPL处理组在24 h和48 h均能够显著抑制HepG2细胞的增殖,差异有统计学意义(P<0.05),且呈浓度和时间依赖性。
2.2TPL促进HepG2细胞凋亡和自噬:由图2可知,与Control组相比,各浓度TPL处理HepG2细胞48 h后,凋亡标志蛋白Bax/Bcl-2的比值和Caspase-3蛋白的表达均明显上调,差异有统计学意义(P<0.05),自噬标志蛋白 LC3-Ⅱ/LC3-Ⅰ的比值和 Beclin-1蛋白的表达均显著上调,差异有统计学意义(P<0.05),且呈浓度依赖性。
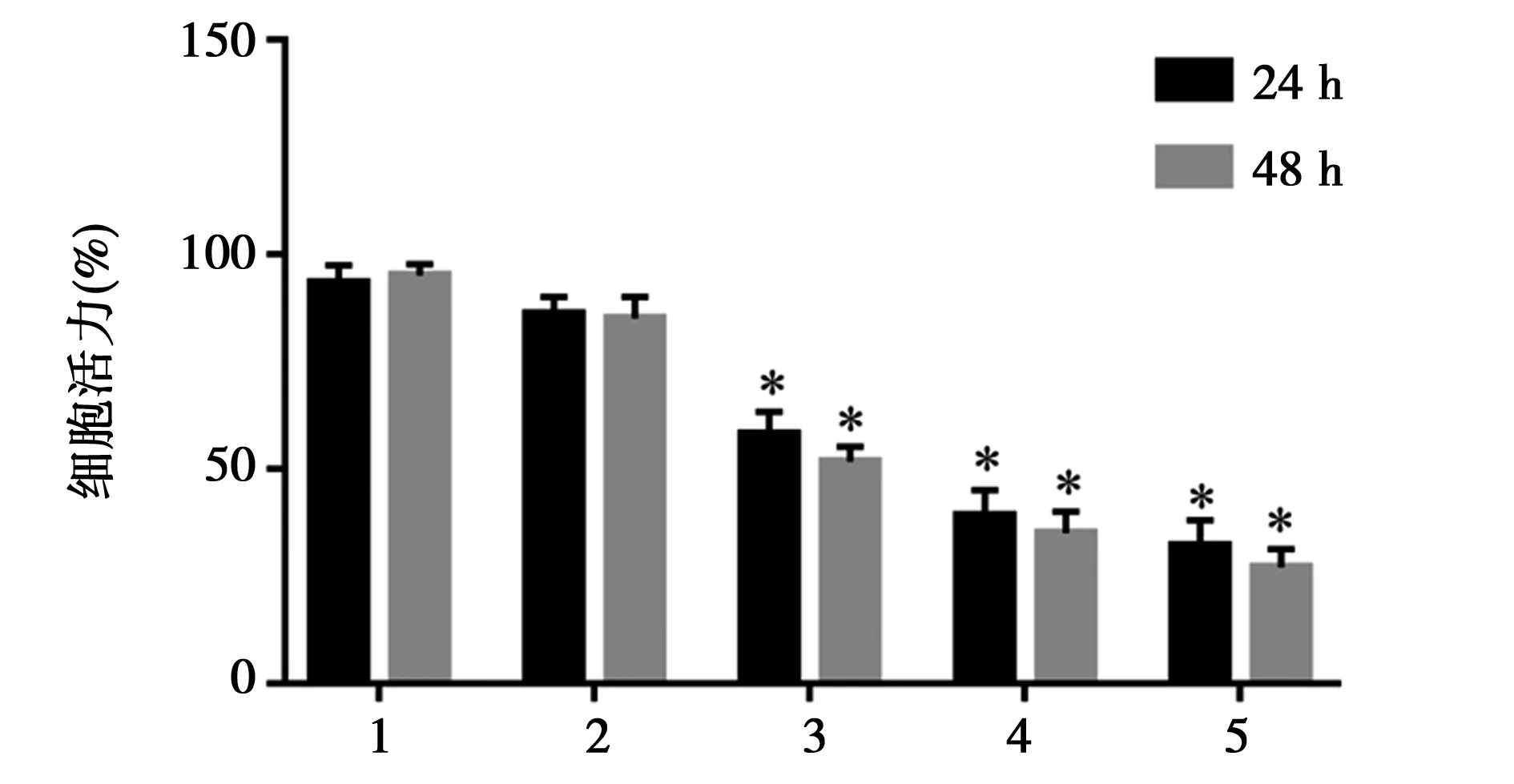
1~5:对照组、10 nmol/L TPL组、20 nmol/L TPL组、40 nmol/L TPL组、80 nmol/L TPL组;与对照组比较,*P<0.05图1 不同浓度TPL在不同时间点对HepG2细胞增殖的影响
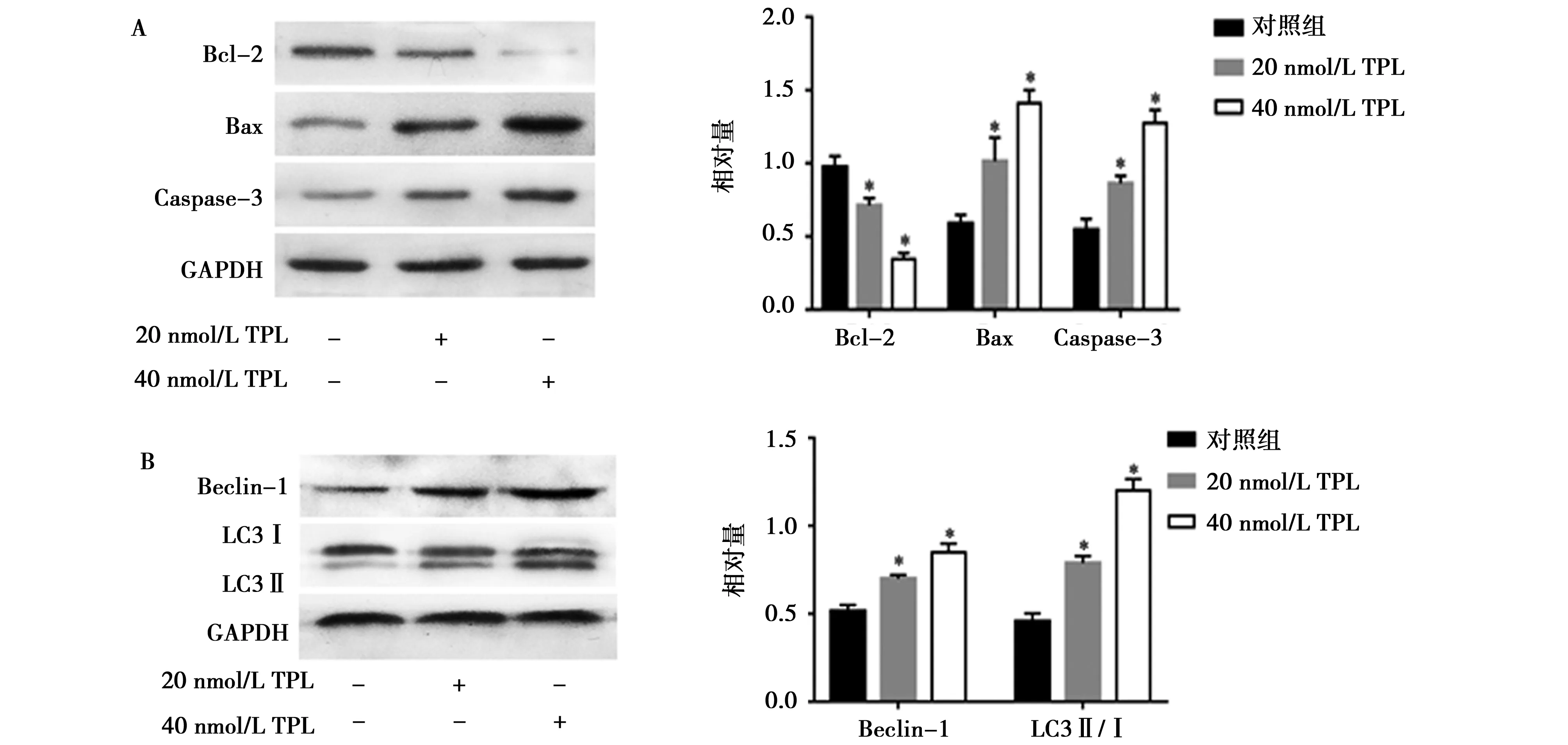
注:与对照组比较,*P<0.05图2 不同浓度TPL对HepG2细胞凋亡和自噬的影响
2.3TPL上调miR-194的表达:由图3可知,与对照组相比,不同浓度的 TPL处理HepG2细胞后,细胞内miR-194的表达均显著升高,差异有统计学意义(P<0.05)。
2.4miR-194 转染对HepG2细胞的活力、凋亡和自噬的影响:由图4和图5可知,与 miR-194 mimic NC 组及对照组比较, miR-194 mimic 组、TPL处理组以及 miR-194 mimic+TPL处理组的细胞活力明显降低,差异有统计学意义(P<0.05),细胞内miR-194的表达明显升高,差异有统计学意义(P<0.05),凋亡标志蛋白Bax/Bcl-2的比值和Caspase-3蛋白的表达均明显上调,差异有统计学意义(P<0.05),自噬标志蛋白 LC3-II /LC3-I 的比值和Beclin-1蛋白的表达均显著上调,差异有统计学意义(P<0.05),且 miR-194 mimic+TPL处理组与单独 miR-194 mimic 组和单独TPL组相比其抑制细胞活力作用更强,凋亡和自噬程度更明显,差异有统计学意义(P<0.05)。
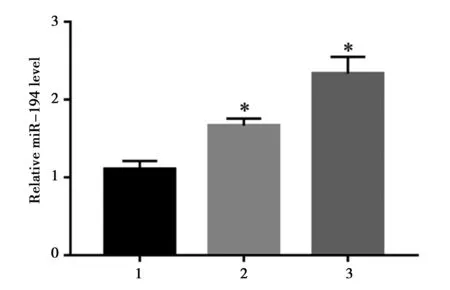
1~3:对照组、20 nmol/L TPL组、40 nmol/L注:与对照组比较,*P<0.05图3 不同浓度TPL对HepG2细胞中miR-194的影响
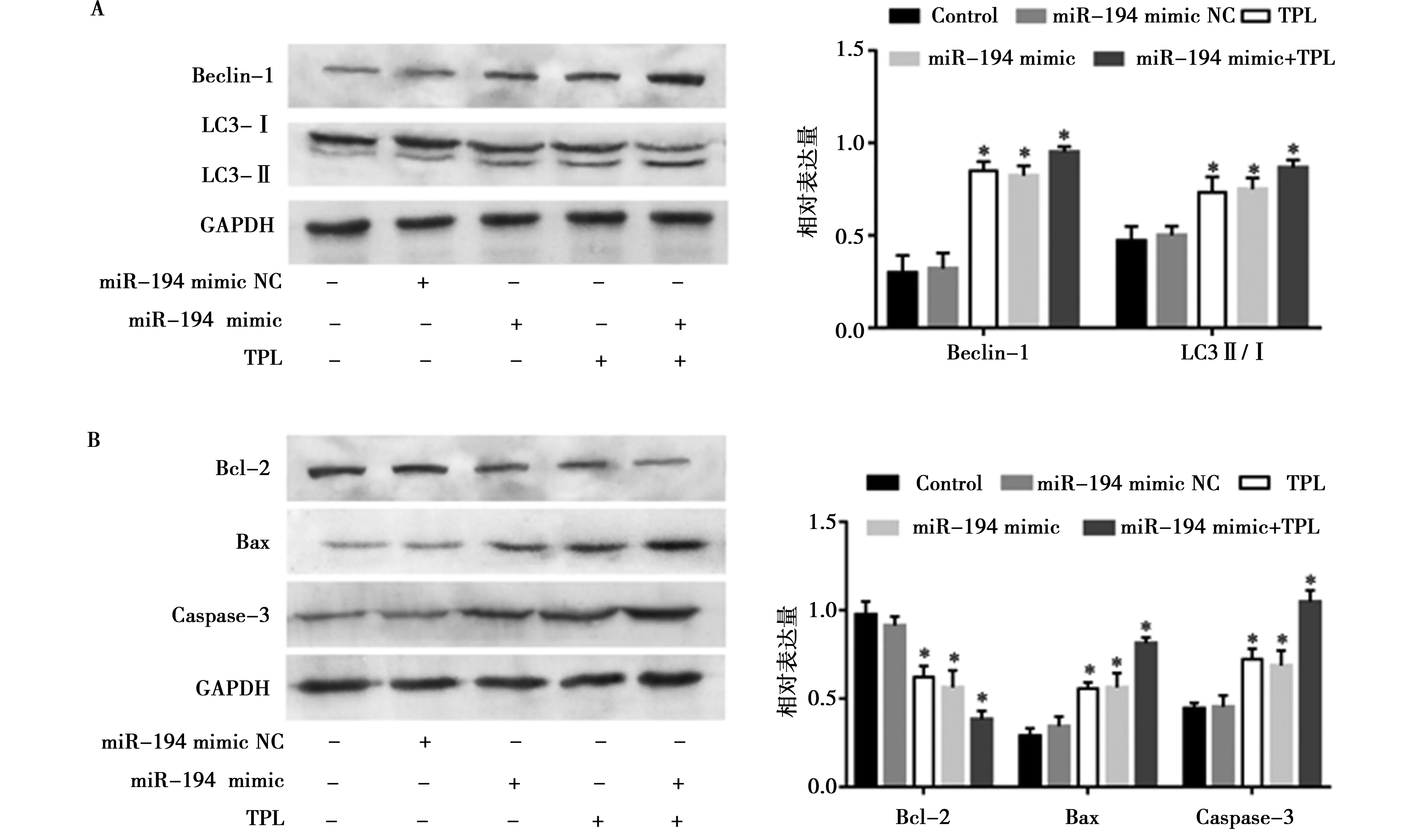
与对照组比较,*P<0.05图4 过表达miR-194对HepG2细胞凋亡和自噬的影响
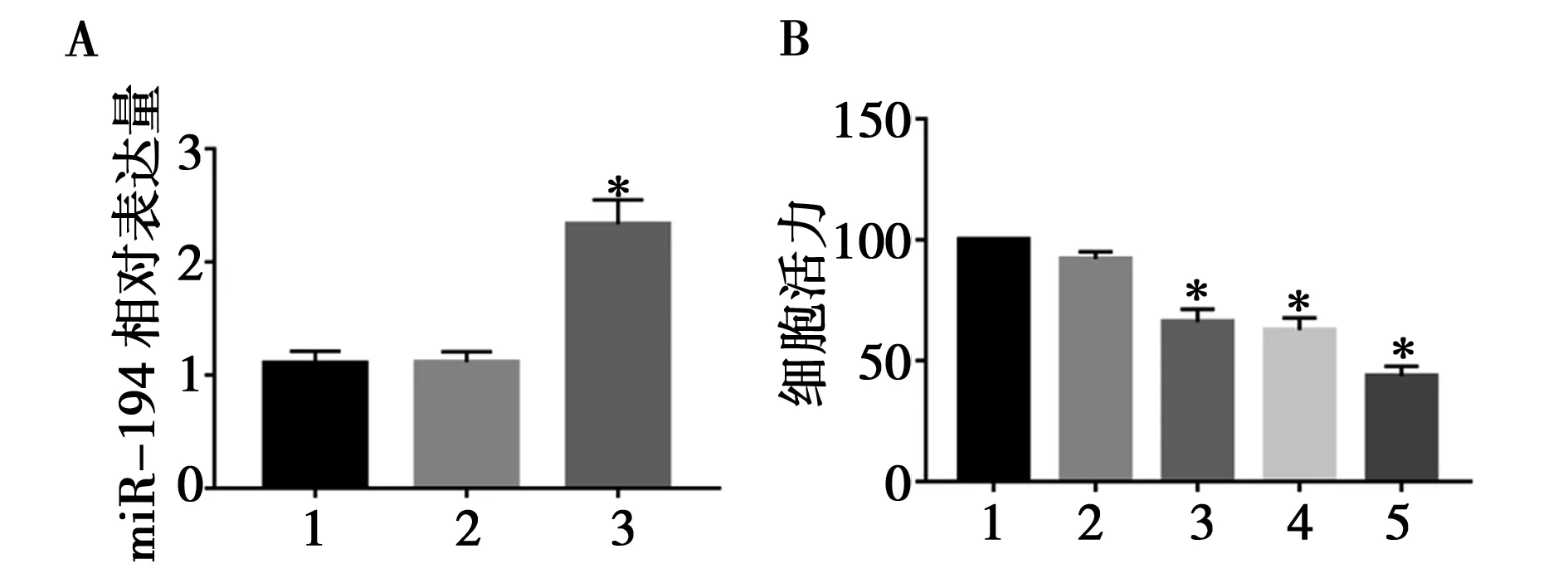
A:1~3:对照组、miR-194 mimic NC组、miR-194 mimic组;B:1~5:对照组、miR-194 mimic NC组、TPL组、miR-194 mimic组、miR-194 mimic+TPL组;与对照组比较,*P<0.05图5 过表达miR-194对HepG2细胞增殖的影响
3 讨论
肝癌是消化系统中最常见的恶性肿瘤之一,死亡率高,在全球范围内,肝癌是第二常见的癌症死亡原因,每年有70多万人死于肝癌[12-13]。肝癌的主要危险因素是乙型肝炎病毒感染、丙型肝炎病毒感染、饮酒、黄曲霉毒素B1和代谢紊乱。肝癌通常是一种恶性肿瘤,预后差,5年生存率估计低于9%[14]。越来越多的证据表明,许多中药及其活性成分是预防和治疗肝癌的潜在来源,如红豆杉、人参、灵芝、黄芪、茯苓、半枝莲等。这些传统中药及其活性成分可通过抑制肿瘤细胞生长和转移、预防肝癌、免疫调节和增强化疗药物的作用等多种途径影响肝癌的发生和发展。TPL是从雷公藤分离出来的环氧二萜内酯单体,具有抗肿瘤、抗炎、抗免疫抑制作用和抗神经性退变等药理作用[1]。有研究表明,miR-194 在卵巢癌癌、非小细胞肺癌、前列腺癌等恶性肿瘤中低表达[15-17],发挥抑癌基因的作用,抑制肿瘤的发生发展,在肝癌中同样也发现了 miR-194 低表达,因此本文推测 miR-194 在肝癌中可能也通过参与调节肿瘤细胞的某些活动来发挥抑癌基因的作用,调控肿瘤的发生发展。
本实验首先证实了不同浓度的TPL对肝癌HepG2细胞生长的抑制作用,且随着浓度的升高抑制效果逐渐增强。细胞凋亡和细胞自噬是细胞程序性死亡的两种主要表现,在凋亡过程中,Bcl-2是抗细胞凋亡基因,Bax是促细胞凋亡基因,Bcl-2通过与Bax结合抑制凋亡并促进细胞存活,它们共同协调作用,激活下游基因,发挥调节作用[18]。Caspase-3 是发挥凋亡功能最主要的蛋白酶之一,位于 Caspase 级联反应的最下游。通常认为 Caspase-3 是细胞凋亡蛋白酶级联反应的必经之路,它的活化标志着凋亡进入不可逆阶段[19]。本研究发现,TPL能上调凋亡标志蛋白Bax/Bcl-2的比值和Caspase-3蛋白的表达,结果表明,TPL能通过诱导HepG2细胞凋亡来抑制HepG2细胞的生长。LC3和Beclin-1是常用的自噬小体标志物,用于评价细胞自噬的水平,LC3主要包括LC3-Ⅰ和LC3-Ⅱ两种,LC3-Ⅰ主要分布于细胞质内,当自噬体形成时,自噬基因Atg7可以活化LC3-Ⅰ,活化的LC3-Ⅰ经Atg3泛素化修饰后形成LC3-Ⅱ。Beclin1参与自噬的机制主要是通过与PI3K形成复合物参与招募其他蛋白质,促进自噬体膜的形成[20]。研究发现,TPL能上调自噬标志蛋白 LC3-Ⅱ/LC3-Ⅰ的比值和 Beclin-1蛋白的表达,结果表明,TPL能通过诱导HepG2细胞自噬来抑制HepG2细胞的生长。
本文推测TPL可以通过调节 miR-194 来促进 HepG2 细胞的凋亡和自噬,从而抑制HepG2细胞的增殖。为了深入研究这种内在调控联系,笔者将miR-194模拟物与阴性对照分别转染至HepG2细胞中,再用 40 nmol/L TPL处理,检测 HepG2 细胞的活力,凋亡和自噬的变化。结果显示与未经处理的 HepG2 细胞及 miR-194 模拟物阴性对照组比较,miR-194 模拟物、TPL以及 miR-194 模拟物 + TPL均可明显抑制HepG2细胞的活力,并促进凋亡和自噬标志蛋白表达上调;但与TPL组以及 miR-194 模拟物组比较,miR-194 模拟物 + TPL组可明显增加 TPL 或 miR-194 模拟物的抗肿瘤作用,细胞增殖的抑制作用更强,凋亡和自噬标志蛋白的表达更显著增加,提示TPL可能通过上调 miR-194 抑制 HepG2 细胞的生长并促进凋亡和自噬。
综上所述,TPL可能通过上调 miR-194 来抑制肝癌 HepG2 细胞的活力,并促进其凋亡和自噬。然而,miR-194通过调控哪些蛋白的表达,从而影响HepG2细胞的增殖,且这种调控作用是否有其他miRNA参与尚不清楚,还需要课题组进一步研究。
