番茄叶霉病菌对氟唑菌酰羟胺敏感基线的建立及氟唑菌酰羟胺田间防病效果评价
2022-02-22李秀环禾丽菲李北兴
李秀环, 禾丽菲, 李北兴, 姜 林, 刘 峰, 慕 卫*,
(1. 山东农业大学 植物保护学院/山东省蔬菜病虫生物学重点实验室/山东省高校农药毒理与应用技术重点实验室,山东 泰安 271018;2. 山东农业大学 化工与材料科学学院,山东 泰安 271018)
番茄叶霉病由真菌黄枝孢菌Passalora fulva(Cooke) U. Braun & Crous (syn.Cladosporium fulvum) 侵染叶片引起[1],是危害番茄生产的世界性重要病害[2-4]。该病在保护地和露地均有发生,尤其是近年来随着中国保护地番茄种植面积的增加,为该病发生和传播提供了有利条件,对番茄产量和品质带来了严重威胁[5-6]。
化学防治是目前防治番茄叶霉病的主要手段,但国内外已报道多种药剂的防效不断降低。如番茄叶霉病菌对代森锰锌、多菌灵等药剂均已产生不同程度的抗性[7-8],辽宁省番茄叶霉病菌己经对氟硅唑产生了不同程度的抗性[9],在山东部分地区该菌对嘧菌酯等产生了抗性[10-11]。因此,亟待筛选新的防治药剂。
由先正达作物保护公司开发的氟唑菌酰羟胺(图式1) 作为首个苯基-乙基-吡唑-芳酰胺类琥珀酸脱氢酶抑制剂 (SDHI) 类杀菌剂的代表品种[12],主要通过抑制呼吸链复合物II 中的泛醌还原反应,进而影响三羧酸循环以及菌体的呼吸作用而发挥效果。氟唑菌酰羟胺具有广谱、内吸和环境安全性高等优点,对多种植物病原菌具有很好的抑制活性[13-14],尤其是对大豆灰斑病菌Cercospora sojina、多主棒孢菌Corynespora cassiicola和油菜菌核菌Sclerotinia sclerotiorum等[12,15-16]防效优异。该药剂与苯醚甲环唑的混剂在中国于2020 年获得登记,用于番茄叶霉病等的防治[17],但目前尚未见关于番茄叶霉病菌对氟唑菌酰羟胺敏感性水平的相关报道。为此,本研究拟建立番茄叶霉病菌对氟唑菌酰羟胺的敏感基线,明确氟唑菌酰羟胺对番茄叶霉病菌的作用方式及田间防病效果,为指导合理使用该药剂防治番茄叶霉病和进一步开展抗性监测提供依据。
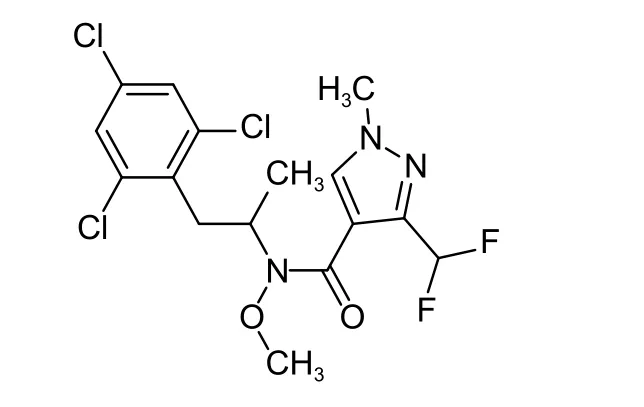
图式 1 氟唑菌酰羟胺化学结构式Scheme 1 The structural formula of pydiflumetofen
1 材料与方法
1.1 材料
药剂:98%氟唑菌酰羟胺 (pydiflumetofen) 原药和200 g/L 氟唑菌酰羟胺悬浮剂(pydiflumetofen SC),瑞士先正达作物保护有限公司;41.7%氟吡菌酰胺悬浮剂 (fluopyram SC),拜耳作物科学(中国) 有限公司;70% 甲基硫菌灵可湿性粉剂(thiophanate-methyl WP),江苏龙灯化学有限公司。其中,氟唑菌酰羟胺原药用二甲基亚砜溶解,配制成10000 mg/L 的母液,备用。
供试培养基:PDA 培养基 (马铃薯200 g,葡萄糖20 g ,琼脂粉15 g,用去离子水定容至1000 mL);WA 培养基 (水琼脂培养基:琼脂粉15 g,葡萄糖20 g,用去离子水定容至1000 mL)。
1.2 氟唑菌酰羟胺对番茄叶霉病菌的抑制活性
在所有供试菌株中随机选择3 株采自不同地区的番茄叶霉病菌[18],用于测定氟唑菌酰羟胺对病原菌菌丝生长、分生孢子萌发和芽管伸长的抑制活性。
1.2.1 对菌丝生长的抑制活性 采用菌丝生长速率法[19]测定。将10000 mg/L 的氟唑菌酰羟胺母液用二甲基亚砜稀释,与加热冷却至45~55 ℃、已灭菌的PDA 培养基混合,配制成氟唑菌酰羟胺质量浓度为0.01、0.05、0.1、0.5、1、5 和10 μg/mL 的含药平板。将培养20 d 的菌株用打孔器在菌落边缘打取直径5 mm 的菌饼,菌丝面朝下接种在含药平板上,以含相同体积的二甲基亚砜与培养基混合作为空白对照。于25 ℃下培养20 d 后,用十字交叉法测量菌落直径,每处理重复3 次,根据公式 (1) 计算各药剂处理对菌丝生长的抑制率 (Id,%)。
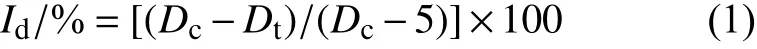
式中:Dc为对照菌落直径;Dt为药剂处理菌落直径。
1.2.2 对分生孢子萌发和芽管伸长的抑制活性
采用孢子萌发法[18]测定。供试菌株培养30 d后,用无菌去离子水将分生孢子洗下,用双层纱布过滤得到孢子悬浮液,在显微镜下调节孢子浓度至1 × 105个/mL,备用。用无菌去离子水稀释氟唑菌酰羟胺母液,与加热冷却至45~55 ℃的WA 培养基混匀,配制成药剂质量浓度为0.01、0.05、0.1、0.5、1、5 和10 μg/mL 的含药平板。移取100 μL 孢子悬浮液均匀涂布在培养基表面,置于25 ℃生化培养箱中黑暗培养,以含相同体积的二甲基亚砜为空白对照,每处理重复3 次。于培养16 h (20 h) 后在显微镜下观察孢子萌发情况 (以芽管长度大于孢子短半径视为萌发),待空白对照组萌发率达到90%以上时,记录各处理孢子萌发情况 (芽管长度),每重复随机调查100 个孢子。根据公式 (2) 和 (3) 计算各处理的孢子萌发抑制率(Ig,%) 和芽管伸长抑制率 (Ie,%),并计算相应的EC50值。
Topping和Ehly[6]把同伴协助学习定义为地位相等或水平相配的同伴共同帮助和支持来获得知识和技能。这一广义的定义让我们更好地理解由Foot和Howe[7]做出的阐述:“总之,在教学实践中协作学习和同伴指导(peer tutoring)进一步巩固了同伴协助学习过程中实际使用的相关技巧。”Smith和Mac-Gregor[8]进一步解释了“合作学习体现出了协作学习精心构架的最终目的”。合作学习在范围上从属于协作学习,而协作学习和相对独立的同伴指导又从属于同伴协助学习。
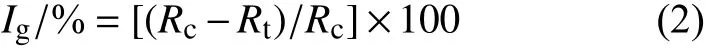
式中:Rc为空白对照孢子萌发率;Rt为药剂处理孢子萌发率。

式中:Ec为空白对照芽管长度;Et为药剂处理芽管长度。
1.3 不同地区番茄叶霉病菌对氟唑菌酰羟胺的敏感性
采用菌丝生长速率法[19]测定。参照1.2 节中的方法,对采集自山东省的106 株番茄叶霉病菌测定其对氟唑菌酰羟胺的敏感性,计算氟唑菌酰羟胺对各地区菌株的菌丝生长抑制率。采用DPS 7.05 软件分析敏感性数据的异常值,剔除后建立敏感基线。
1.4 氟唑菌酰羟胺对番茄叶霉病的田间防效
参照《农药田间药效试验准则》中关于番茄叶霉病的部分进行[20]。试验分别于2018 年5 月和2019 年4 至5 月在泰安市岱岳区东大吴村蔬菜大棚进行。供试番茄Solanum lycopersicum品种为金鹏11-8。供试药剂为200 g/L 氟唑菌酰羟胺SC,设有效成分 100、150、200 g/hm23 个施药剂量,对照药剂为41.7%氟吡菌酰胺SC 有效成分 200 g/hm2和70%甲基硫菌灵WP 有效成分 540 g/hm2,以清水处理为空白对照。每小区28 m2,每个处理4 个小区,处理小区按照随机区组设计并且设置保护行。使用WS-16 农用背负式喷雾器施药。
保护作用试验于发病前开始施药,施药两次,施药间隔期7 d,于末次施药后7 d 调查各处理病级,计算病情指数。治疗作用试验于发病初期开始施药,施药前调查各处理病级并计算病情指数,施药3 次,于末次施药后6 d 再调查各处理病级并计算病情指数。
病级调查方法:每小区取样3 个点,每点调查5 株,每株调查上中下3 片复叶,以复叶上每张小叶片病斑面积占整个小叶片面积的百分率分级,分级标准[20]为:0 级,无病斑;1 级,病斑面积占整个小叶面积的5%以下;3 级,病斑面积占整个小叶面积的>5%~10%;5 级,病斑面积占整个小叶面积的>10%~20%;7 级,病斑面积占整个小叶面积的>20%~50%;9 级,病斑面积占整个小叶面积的50%以上。按公式 (4)~(6) 计算各处理病情指数 (Di) 及田间防效 (Ep或Ec,%)。

式中:Na为各级病叶数;a为相对级数值(1,2,3,…,9);n为叶片数。
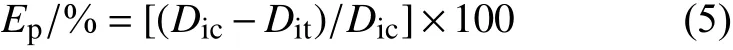
式中:Ep为保护作用防治效果;Dic为对照区病情指数;Dit为处理区病情指数。
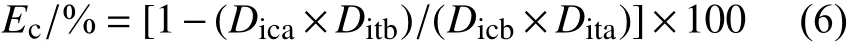
式中:Ec为治疗作用防治效果;Dica为空白对照药前的病情指数;Dicb为空白对照药后的病情指数;Dita为药剂处理药前的病情指数;Ditb为药剂处理药后的病情指数。
田间防效数据通过反正弦转换后,用Tukey法进行差异显著性分析。
2 结果与分析
2.1 不同发育阶段番茄叶霉病菌对氟唑菌酰羟胺的敏感性
如图1 所示,氟唑菌酰羟胺对3 株番茄叶霉病菌菌株的不同发育阶段抑制活性均较高。其中,孢子萌发和芽管伸长阶段相对较为敏感,EC50平均值分别为0.13 和0.09 μg/mL,在0.1 μg/mL 时的抑制率均达50%以上;而对菌丝生长的抑制活性相对较弱,平均EC50值为 0.66 μg/mL,在1.0 mg/L 时抑制率为60.3% 。

图1 氟唑菌酰羟胺对番茄叶霉病菌不同发育阶段的抑制活性Fig. 1 Inhibition activity of pydiflumetofen on P. fulva at different development stages
2.2 山东省不同地区番茄叶霉病菌对氟唑菌酰羟胺的敏感性
采自山东省8 个地区的106 株番茄叶霉病菌对氟唑菌酰羟胺的敏感性均较高,EC50值范围为0.04~3.90 μg/mL,平均EC50值为0.72 μg/mL。其中淄博菌株对氟唑菌酰羟胺敏感性最低,平均EC50值为1.59 μg/mL,显著高于其他地区,其最大EC50值为3.90 μg/mL;聊城菌株的敏感性最高,平均EC50值为0.57 μg/mL,但与其他敏感地区并无显著差异;在所有菌株中,最敏感菌株来自泰安,其EC50值为0.04 μg/mL,与最大值相差90.84 倍 (图2)。
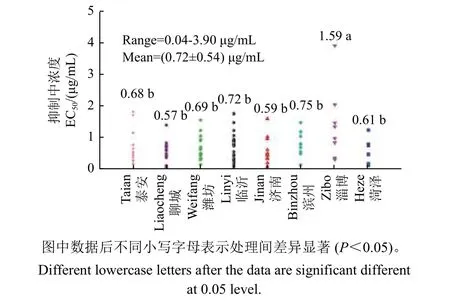
图2 山东省不同地区的番茄叶霉病菌对氟唑菌酰羟胺的敏感性Fig. 2 The sensitivity of P. fulva isolates collected from different regions of Shandong Province to pydiflumetofen
2.3 番茄叶霉病菌对氟唑菌酰羟胺的敏感基线
利用菌丝生长速率法测定了106 株番茄叶霉病菌对氟唑菌酰羟胺的敏感性,经分析剔除3 个异常值,选择其他103 株绘制敏感性频率曲线。结果显示:敏感性频率分布呈单峰曲线,其EC50值分布范围为0.04~1.74 μg/mL,平均值为 (0.67 ±0.41) μg/mL (图3),可以之作为山东地区番茄叶霉病菌对氟唑菌酰羟胺的敏感基线。
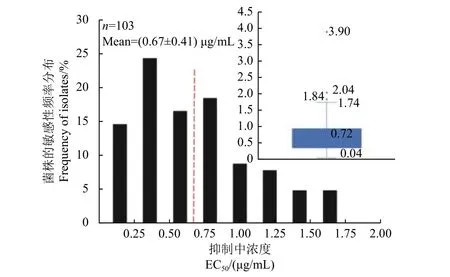
图3 番茄叶霉病菌对氟唑菌酰羟胺的敏感性频率分布Fig. 3 Sensitivity frequency distribution of P. fulva to pydiflumetofen
2.4 氟唑菌酰羟胺对番茄叶霉病的田间防治效果
2018 年的试验结果显示 (表1):保护作用测定中,处理组氟唑菌酰羟胺和对照药剂氟吡菌酰胺对番茄叶霉病的防效均达70%以上,显著高于对照药剂甲基硫菌灵的防效,其中200 g/L 氟唑菌酰羟胺SC 有效成分200 g/hm2施药剂量下,防效为89.55%,显著高于100 g/hm2下的防效,稍高于对照药剂氟吡菌酰胺的防效,但差异并不显著;而在治疗作用测定中,最高剂量氟吡菌酰胺的防效显著高于对照药剂。

表1 氟唑菌酰羟胺对番茄叶霉病的田间防效Table 1 The field efficacy of pydiflumetofen in controlling tomato leaf mold
2019 年的试验结果 (表1) 显示:保护作用中,200 g/L 氟唑菌酰羟胺SC 有效成分150、200 g/hm2和对照药剂氟吡菌酰胺150 g/hm2的防效均在80%以上,同等剂量下200 g/L 氟唑菌酰羟胺SC 与对照药剂氟吡菌酰胺的防效差异不显著;治疗作用中,氟唑菌酰羟胺在最高剂量下的防效显著高于其他处理组防效,且在同等剂量下,氟唑菌酰羟胺的防效显著高于对照药剂氟吡菌酰胺。由于第二年的治疗作用试验施药后发病较重,致使所有处理组的防效普遍低于第一年的防效。
综合两年的试验结果表明,氟唑菌酰羟胺的保护性防效高于治疗性防效,且在安全剂量下,其防效与剂量呈正相关,并显著高于对照药剂甲基硫菌灵有效成分540 g/hm2的防效。
3 结论与讨论
氟唑菌酰羟胺作为一种新型SDHI 类杀菌剂,对多种植物叶部病原菌(如小麦禾谷镰刀菌、大豆叶斑病菌、多主棒孢、番茄灰霉病菌、苹果黑星病菌等) 均有很好的活性[12-14,21-22]。本研究首次明确了该药剂对番茄叶霉病菌有很高的毒力,其中对孢子萌发和芽管伸长的活性稍高于对菌丝生长的,并且该药剂对不同生长阶段番茄叶霉病菌的抑制活性存在一定差异,可能与不同发育阶段对能量代谢的需求存在差异有关[18]。这与前人关于氟吡菌酰胺和吡唑萘菌胺等SDHI 类杀菌剂对番茄叶霉病菌具有较好抑制活性的研究结果一致[21]。
本研究结果显示,在供试菌株中,氟唑菌酰羟胺对淄博地区番茄叶霉病菌的平均EC50值显著高于对其他地区的,而这些采集地均未曾使用过该药剂,因此推测这可能与不同地理来源菌株的遗传背景差异有关[18,23]。在相同的用药条件下,淄博地区的菌株是否对该药剂或同类药剂更容易产生抗性有待进一步研究,实际生产过程中应重视对菌株的抗性监测。
由于作用位点单一,病原菌容易发生抗性突变,SDHI 类药剂已被国际杀菌剂抗性行动委员会(FRAC) 列为中等抗性风险药剂[24]。而氟唑菌酰羟胺杀菌谱广,未来应用广泛,因此建立其敏感基线对监测病原菌的敏感性变化和抗药性治理具有重要价值。目前已有啶酰菌胺、氟唑菌酰胺、氟吡菌酰胺等SDHI 类药剂登记并应用在番茄上防治番茄灰霉病、早疫病、叶霉病以及番茄根结线虫等[17],这在一定程度上增加了SDHI 类药剂对田间番茄叶霉病菌的选择压,使得田间容易出现抗性菌株。因此在建立杀菌剂的敏感基线时,菌株来源、药剂使用背景、菌株数和测定敏感性的试验方法等非常关键[25]。本研究中使用的103 株番茄叶霉病菌来自山东省的8 个地区,分布相对均匀且采集地未曾使用过SDHI 类药剂,具有一定的代表性,其平均EC50值 (0.67 ± 0.41) μg/mL 可以作为山东地区番茄叶霉病菌对氟唑菌酰羟胺的敏感基线,用于未来田间的抗性监测。
He 等建立了山东省番茄灰霉病菌对氟唑菌酰羟胺的敏感性基线,认为氟唑菌酰羟胺防治灰霉病具有潜在的抗性风险[21]。Hou 等建立了禾谷镰刀菌对氟唑菌酰羟胺的敏感性基线,并指出氟唑菌酰羟胺与苯并咪唑类杀菌剂之间无交互抗性[13]。由于SDHI 类药剂独特的作用方式,与其他类型药剂间通常不存在交互抗性,且有研究表明即使同为SDHI 类品种,部分药剂之间也可能不存在交互抗性,如啶酰菌胺和氟吡菌酰胺[26-27]。王晓坤等报道,多种三唑类杀菌剂对叶霉病的毒力很高[28]。因此,将氟唑菌酰羟胺与苯醚甲环唑复配[17]防治番茄叶霉病是可行的,同时对番茄灰霉病、灰叶斑病可能具有较好的兼治作用。
多数研究往往只注重杀菌剂的保护作用或者治疗作用,而杀菌剂的保护和治疗作用在田间应用时很难得到严格控制和设计,因此,在杀菌剂的应用中同时研究保护和治疗作用非常重要[29]。两年的田间防治试验结果表明,氟唑菌酰羟胺的施用剂量越大,防效越高,且在发病前施药的保护作用效果远高于发病后再施药的治疗效果,且发病越重,防效也会降低,这可能与氟唑菌酰羟胺对叶霉病菌的孢子萌发和芽管伸长具有较强的抑制活性,能够有效阻止病原菌入侵和扩散有关,因此,建议在发病前或发病初期施药。与对照药剂氟吡菌酰胺相比,同等剂量下,氟唑菌酰羟胺的防效稍高但并不显著;而甲基硫菌灵防效很低,因此不建议以单剂形式使用。
