磁共振成像(MRI)及肿瘤分子标记物对乳腺癌新辅助化疗腋窝淋巴结疗效的评估与预测
2022-02-22梁春雨马伶玉徐志渊杨国辉沈新平
梁春雨 马伶玉 徐志渊杨国辉 沈新平,*
1.香港大学深圳医院放射科(广东 深圳 518009)
2.香港大学深圳医院临床肿瘤中心(广东 深圳 518009)
乳腺癌为女性最常见的恶性肿瘤,并且发病率逐年增高,近年来,新辅助化疗(neoadjuvant chemotherapy,NAC)越来越多地被应用于局部进展期乳腺癌的治疗,当前研究表明NAC不仅可使原本无法切除的肿瘤缩小,增加手术切除率及保乳机会,并且可以实现腋窝淋巴结降期,甚至约有40%的患者可达病理完全缓解[1]。腋窝淋巴结疗效是NAC疗效评估及预测的一部分,但目前为止乳腺癌NAC后腋窝淋巴结疗效的研究相对较少。因此,本研究拟利用磁共振成像(magnetic resonance imaging,MRI)联合肿瘤分子标记物对NAC后腋窝淋巴结疗效进行评估,并对其预测价值进行初步探讨,为临床判断NAC疗效提供更多的信息。
1 资料与方法
1.1 研究对象收集香港大学深圳医院2015年1月至2020年12月首诊为局部进展期乳腺癌伴腋窝淋巴结转移,并行NAC治疗后手术的80例患者的MRI影像资料及相关临床、病理资料。所有患者行NAC前均经穿刺活检证实为乳腺癌伴腋窝淋巴结转移,且患者经CT、B超、PET/CT等检查排除其他部位转移,所有患者均有至少两次完整的乳腺增强MRI影像学资料(NAC前,NAC第4周期后的2周内)。
患者年龄介于24~76岁,平均年龄(46±11)岁。所有患者行NAC前均经病理证实伴腋窝淋巴结转移。根据2010年NCCN指南(V.2.2010)的cTNM分期标准:T1期10例,T2期36例,T3期16例,T4期18例;N1期41例,N2期19例,N3期20例;所有患者均未发现其他部位转移灶,M分期均为M0期。患者病理类型包括浸润性导管癌74例,浸润性小叶癌3例,粘液腺癌2例,乳头状癌1例。45例采用AC方案(多柔比星联合环磷酰胺)化疗,27例采用TCHP方案(多西他赛+卡铂+曲妥珠单抗+帕妥珠单抗)化疗,5例采用EC方案(环磷酰胺联合表柔比星),3例采用AC-T方案(联合多柔比星、紫杉醇及环磷酰胺)。
1.2 MRI扫描及测量MRI检查:采用我院Siemens 3.0T Skyra磁共振和双侧乳腺表面线圈,MRI造影剂为顺磁性造影剂钆喷酸葡胺 (Gd-DTPA)。患者俯卧,双乳自然下垂,使用加压器。所有患者均行双侧乳腺MRI平扫和动态增强成像。增强扫描前先扫描蒙片,动态增强扫描采用轴位抑脂T1WI序列,增强前及增强后共连续6~7次采集。
本研究主要观察NAC前后腋窝淋巴结地改变,以MRI三维重建图像中最大淋巴结短径代表淋巴结大小,测量NAC前后最大淋巴结的短径,NAC前短径为D1, NAC后短径为D2,并计算其变化值(△D)变化率(△D%):△D=D1-D2,△D%=(D1-D2)/D1×100%。同时测量NAC前后最大淋巴结的表观扩散系数(apparent diffusion coeficient,ADC)值,NAC前为ADC1,NAC后为ADC2,并计算其变化值(△ADC)变化率(△ADC%):△ADC=ADC2-ADC1,△D%=(ADC2-ADC1)/ADC1×100%。
1.3 病理及免疫组化检测所有患者行NAC前均行乳腺肿块及腋窝淋巴结粗针穿刺活检,石蜡固定切片、HE染色,再以免疫组化法检测其雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体2(Her2)、Ki-67表达情况。ER、PR阳性标准参照2010年美国临床肿瘤学会(ASCO)/美国病理学医师学院(CAP)指南[2],Her2阳性标准参照2007年(ASCO)关于Her2检测指南[3]。Ki-67采用免疫组化方法,在高倍显微镜下计算最密集处阳性细胞所占视野内细胞总数的百分比,按照2011年国际乳腺癌会议关于乳腺癌分子分型共识[4]:将Ki-67表达<14%判断为阴性表达,Ki-67表达≥14%判断为阳性表达。
所有患者行NAC后均行手术切除及腋窝淋巴结清扫手术,术后标本行免疫组化检查,根据NAC后腋窝淋巴结是否残留肿瘤细胞分为腋窝淋巴结病理完全缓解(pCR)与腋窝淋巴结非完全缓解(non-PCR)两组,将术前MRI及分子标记物表达情况与最终术后病理结果比较,评估术前MRI及分子标记物表达对腋窝淋巴结病理完全缓解(pCR)的预测价值。
1.4 统计学方法采用 SPSS 25.0软件(SPSS, version 25.0,IBM Software) 和R3.6.3进行统计分析。采用Kolmogorov-Smirnova法评估计量资料分布特征,符合正态分布、方差齐性的计量资料以(±s)表示,对非正态分布计量资料进行Box-Cox正态变换,以中位数(范围)表示,所有计量资料采用Student's t检验进行组间比较。计数资料以频数(%)表示,应用卡方检验比较,影响NAC腋窝淋巴结疗效的MRI及分子标记物表达采用多因素Logistic回归分析,P<0.05为差异有统计学意义。
2 结 果
2.1 腋窝淋巴结NAC疗效80例患者均完成了4个周期的NAC,NAC前最大淋巴结短径范围为3~32(11.18±5.47)mm,NAC后最大淋巴结短径范围为1~26(5.53±3.56)mm,NAC前淋巴结最低ADC值范围为0.412~1.374(0.791±0.155)×10-3mm2/s,NAC后淋巴结最低ADC值范围为0.624~2.300(1.249±0.326)×10-3mm2/s。与NAC前比较,NAC后淋巴结短径缩小、ADC值升高,NAC前后差异有显著性(P<0.05)。
所有患者行NAC后均行手术切除及腋窝淋巴结清扫手术,术后标本行免疫组化检查,37例患者术后腋窝淋巴结无残留肿瘤细胞,腋窝淋巴结病理完全缓解率为46.25%(37/80);43例患者术后腋窝淋巴结仍见残留肿瘤细胞,腋窝淋巴结病理未完全缓解率为53.75%(43/80)。
2.2 NAC前后腋窝淋巴结MRI表现与病理对照根据术后腋窝淋巴结是否残留肿瘤细胞分为病理完全缓解(pCR)与非完全缓解(non-PCR)两组,对比两组患者的MRI参数,包括NAC前淋巴结最大短径(D1)、NAC后淋巴结的最大短径(D2)、最大短径变化值(△D)变化率(△D%),同时测量NAC前后最大淋巴结的ADC值,NAC前为ADC1, NAC后为ADC2,并计算其变化值(△ADC)变化率(△ADC%)。结果显示,两组间腋窝淋巴结短径(D1、D2、△D、△D%)无显著差异(P>0.05),两组间NAC前及NAC后最大淋巴结的ADC值(ADC1、ADC2)差异有统计学意义(P<0.05),其变化值(△ADC)变化率(△ADC%)差异无统计学意义(P>0.05),见表1、图1~图2。

图1 女,54岁,浸润性导管癌(Ⅱ级)。图1A、图1B为NAC前增强扫描MRI及ADC图;图1C、图1D为NAC后增强扫描MRI及ADC图,患者NAC前左腋下肿大淋巴结短径约17mm(箭头),ADC值约0.793×10-3mm2/s,患者完成4周期NAC后,淋巴结短径缩小至2mm(箭头),ADC值约1.123×10-3mm2/s,术后病理证实为腋窝pCR。

表1 NAC前后腋窝淋巴结MRI表现与病理对照
2.3 分子标记物表达与病理对照全组80例均可获得ER、PR、Her2、P63、Ki-67等分子标记物表达情况,并结合术后病理情况进行统计分析。其中ER阳性NAC后腋窝pCR率为21.25%,阴性NAC后腋窝pCR率为25.00%,P=0.000,PR阳性NAC后腋窝pCR率为15.00%,阴性NAC后腋窝pCR率为31.25%,P=0.000,Her2阳性NAC后腋窝pCR率为21.25%,阴性NAC后腋窝pCR率为25.00%,P=0.008,此三个指标均具有统计学意义。Ki-67不具有统计学意义,见表2。

表2 乳腺癌分子标记物表达与腋窝淋巴结NAC疗效的关系
单因素分析中有意义的变量进行多因素Logistic回归分析,规定自变量入选标准为0.05,剔除标准为0.10,结果显示:PR(OR=7.0781,95%CI:1.104~45.384,P=0.039)和Her2(OR=0.186,95%CI:0.05~0.687,P=0.012)是新辅助化疗后腋窝pCR的独立预测因子(表3)。
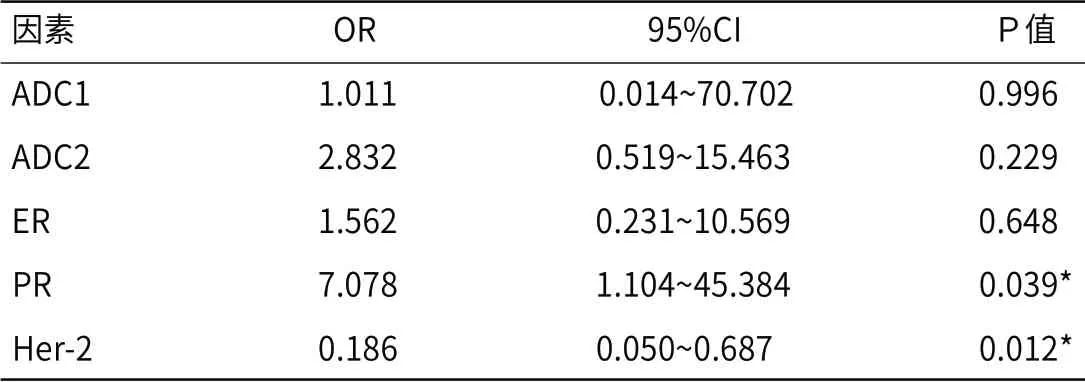
表3 新辅助化疗腋窝淋巴结疗效的多因素Logistic回归分析
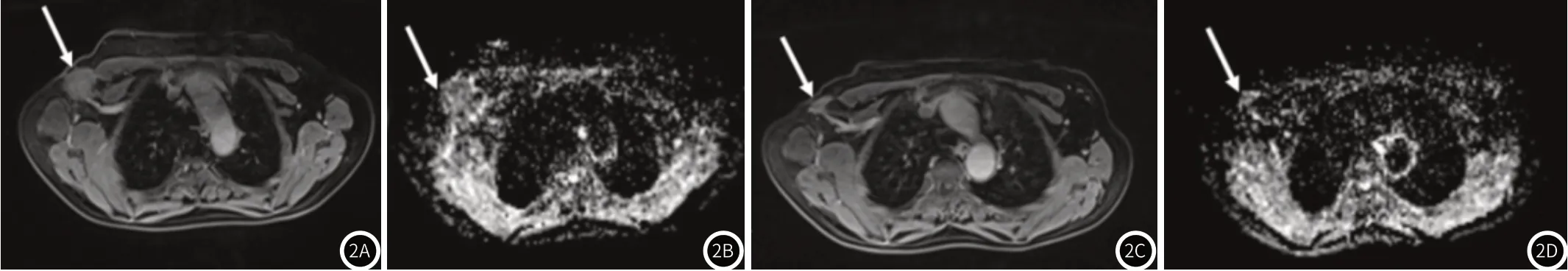
图2女,68岁,浸润性导管癌(Ⅲ级)。图2A、图2B为NAC前增强扫描MRI及ADC图;图2C、图2D为NAC后增强扫描MRI及ADC图,患者NAC前右腋下肿大淋巴结短径约30mm(箭头),ADC值约0.722×10-3mm2/s,患者完成4周期NAC后,淋巴结短径缩小至12mm(箭头),ADC值约0.923×10-3mm2/s,术后病理证实为腋窝non-pCR。
3 讨 论
NAC是进展期乳腺癌的有效治疗手段,NAC后腋窝淋巴结状态评估对全面评估NAC疗效及决定腋窝淋巴结外科处理策略具有重要作用。MRI是NAC疗效评估的最重要手段, MRI不仅可以通过NAC前后肿瘤大小的变化评估肿瘤形态学改变,还可以通过观察NAC前后ADC、DCE-MRI半定量或定量参数等方面改变, 从而评估肿瘤功能学变化。目前已有相当多研究应用MRI评估乳腺癌新辅助化疗疗效[5],但这些研究基本集中在肿块本身,事实上,NAC后腋窝淋巴结也会发生改变,季晓昕等[6]发现NAC后腋窝淋巴结清扫所检出的淋巴结总数和阳性淋巴结数均较NAC前减少, 腋窝淋巴结疗效是NAC疗效评估及预测的一部分,但目前为止利用MRI评估乳腺癌NAC前后腋窝淋巴结改变及预测腋窝淋巴结疗效的研究相对较少,同时,关于肿瘤生物学指标对NAC疗效的预测作用,也一直是乳腺癌研究的热点。因此,本研究利用MRI联合肿瘤分子标记物评估NAC后腋窝淋巴结疗效,并初步研究其预测价值, 旨在更全面、精准地评价NAC疗效,进一步指导乳腺癌的个体化治疗。
本研究发现淋巴结短径与NAC后病理缓解没有显著相关性,NAC前后腋窝pCR及non-pCR两组的淋巴结短径没有显著差异(P>0.05)。淋巴结ADC值与腋窝pCR有显著相关性,腋窝pCR及non-pCR两组NAC前及NAC后的淋巴结ADC值差异均有统计学意义(P<0.05)。该结果与文献报道的乳腺癌NAC后的MRI改变基本一致[7-8]。淋巴结短径是利用形态学表现来判断淋巴结的缓解程度,有一定的局限性,而ADC值的最大优势是通过描述水分子扩散运动,间接反映病灶内组织细胞密集程度,兼顾淋巴结的功能学特点。研究证实,恶性肿瘤细胞密度高,细胞外空间减少,水分子活动受限制,ADC值下降;化疗后部分肿瘤细胞坏死,因此细胞外间隙增大,使水分子得到充分扩散,ADC值能在化疗后早期即升高,且多早于形态学改变[9],因此,肿瘤细胞密度与ADC值间存在很好的相关性,可以通过ADC值大小对肿瘤细胞密度进行量化。除了ADC值,18F-FDG PET/CT作为另一功能学手段也在评估NAC后腋窝淋巴结缓解情况方面具有一定的价值[10]。本研究中,共有80例患者在行NAC前、NAC疗程中以及NAC全部结束后接受了PET/CT检查,NAC后所有患者接受腋窝淋巴结清扫手术。以腋窝淋巴结最大标准摄取值即SUV作为评价指标,并与最终的病理结果对比分析,本研究结果发现pCR患者的SUV较non-pCR患者相对下降差值较大。本研究中pCR组NAC前及NAC后淋巴结ADC值均较non-pCR组高,结果显示,化疗药物对于细胞密度相对较低的淋巴结疗效更好,功能影像学手段较形态学改变更为敏感。
肿瘤的分子标记物与NAC疗效的关系一直是乳腺癌研究的热点。本研究对ER、PR、Her2、Ki-67这4种分子标志物与腋窝淋巴结疗效相关性进行分析,发现ER阴性、PR阴性、Her2阳性与腋窝PCR显著相关。Ki-67与腋窝淋巴结疗效无相关性,回归分析提示PR阴性、Her2阳性是腋窝淋巴结疗效的独立预测因子。既往有相当多文献研究肿瘤的分子标记物对NAC疗效的预测作用[11-13],却未能形成一致意见。比如Ki-67抗原是细胞增殖相关蛋白,Ki-67阳性指数一直是判断乳腺癌肿瘤细胞增殖活性的主要指标,有研究发现Ki-67高表达的肿瘤对新辅助化疗反应较敏感[14-15],但也有研究显示,Ki-67阳性指数对乳腺癌患者的化疗疗效并无预测价值[16],在本研究中,Ki-67阳性指数与腋窝淋巴结病理缓解并没有相关性。ER、PR属于核受体超家族中的甾体类激素受体,与乳腺癌的治疗及预后息息相关。研究发现ER、PR阳性表达率与乳腺癌细胞分化程度呈正相关,并且与腋窝淋巴结转移率呈负相关[17]。另有研究发现ER阴性表达可导致乳腺癌患者5年生存率降低[18]。研究表明,Her2与化疗缓解显著相关, Her2过表达的患者缓解率低, Her2阴性新辅助化疗组无病生存率显著高于过表达组[19]。但也有报道未发现化疗疗效与Her2表达有明显关系[20]。本研究发现ER阴性、PR阴性、Her2阳性与腋窝PCR显著相关,且PR阴性、Her2阳性是腋窝淋巴结疗效的独立预测因子,可以为临床制定个体化治疗方案提供依据。
对于NAC后腋窝淋巴结处理,无论术前评估是否发生NAC后病理完全缓解,均采取腋窝淋巴结清扫手术,如果能有可靠的依据预测腋窝淋巴结NAC疗效,则腋窝PCR患者有机会保留腋窝,实现最小创伤及最大获益。因此,NAC后腋窝淋巴结疗效评估及预测具有重要临床意义,本研究拟利用MRI联合肿瘤分子标记物对NAC后腋窝淋巴结疗效进行评估,并对其预测价值进行初步探讨,为NAC后腋窝淋巴结处理提供参考,由于受试验时间和患者依从性限制,本试验整体例数较少,本研究结果与文献报道不完全统一,接下来需进一步增加病例数,细化实验方案,以期能为NAC后腋窝淋巴结外科处理提供有价值的依据。
