基于纵向驰豫时间成像技术定量评估新生儿高胆红素血症脑损伤*
2022-02-22孟小丽晴王晓虎任转勤
黎 星 孟小丽 张 雷 张 坤 张 伟 范 晴王晓虎 任转勤,*
1.陕西省陕西中医药大学医学技术学院(陕西 咸阳 712046)
2.陕西省宝鸡市中心医院影像科(陕西 宝鸡 721008)
3.陕西省空军军医大学西京医院核医学科(陕西 西安 710032)
4.陕西省宝鸡高新医院影像科(陕西 宝鸡 721006)
新生儿高胆红素血症(neonatal hyperbilirubinemia,NHB)在我国并不少见,目前NHB占我国新生儿住院病因中第一位[1],严重的高胆红素血症(约4.8%)有可能引起胆红素脑病(bilirubin encephalopathy,BE),50%~70%的BE严重者死于胆红素脑病急性期,而75%~90%幸存者可有脑瘫、视听障碍和智力障碍等严重的神经系统后遗症[2]。既往关于高胆红素血症的研究中,人们认为T1WI苍白球高信号可作为评价新生儿胆红素脑病的客观指标,但这主要依靠研究者观察苍白球的信号,主观性较强,易受多种因素的影响,故需要找到一种能够正确量化苍白球信号强度的方法。T1mapping成像是一种新的磁共振技术,能直接测量组织T1值,反映细胞内含水量情况,以往该技术主要用于心脏及肝脏相关疾病,针对新生儿高胆红素血症的研究甚少。本研究旨在运用3.0T磁共振新技术T1mapping成像测量高胆红素血症新生儿各脑区T1值,精准量化其脑损伤的程度,观察其随血清总胆红素(total bilirubin,TBil)峰值的变化趋势,为临床提供客观的影像学依据。
1 资料与方法
1.1 临床资料选择2017年9月至2018年5月入住我院新生儿科且诊断为新生儿高胆红素血症或胆红素脑病的新生儿为研究对象,分为高胆组和脑病组。另选取同期生理性黄疸新生儿为对照组。
纳入标准:临床诊断符合分组标准;胎龄≥35周;检查日龄≤28d;有完整的临床资料,包括TBil、出生胎龄、体重、头围和身长;有完整的影像学资料,包括T1WI、T2WI和T1mapping,且图像质量较好,可用于诊断及测量。排除标准:颅内占位;中枢神经系统感染史;先天畸形;发育迟缓,小于胎龄儿;临床诊断为新生儿缺氧缺血性脑病者;磁共振检查与胆红素峰值检测时间间隔超过5d的新生儿。
共纳入新生儿93例,其中对照组27例,平均TBil水平为(150.089±70.917)μmol/L;高胆组40例,平均TBil水平为(250.617±41.574)μmol/L;脑病组26例,平均TBil水平为(391.146±84.791)μmol/L。本研究通过伦理委员会批准,新生儿家属均知情同意且签署知情同意书。
1.2 MR检查方案所有受试者均采用GE MR 750w进行扫描。检查前严格评估新生儿生命体征,询问监护人有无磁共振检查禁忌证,去除新生儿及监护人身上的一切金属异物。进行检查前15~30min,对新生儿进行10%水合氯醛(30~40mg/kg)口服或灌肠处理,待其安稳入睡后进行检查。扫描前将软耳塞置于患儿外耳道以保护听力,并使用塑性海绵垫固定头部,扫描时严格监护新生儿的呼吸变化,保证其检查过程的安全。
扫描时定位线对准听眦线。扫描序列:轴位T1WI、T2WI和T1mapping。T1mapping采用基于反转恢复序列:4mm层厚无间隔扫描,相位编码FOV为1,频率编码FOV为22,矩阵为128×128,带宽62.5Hz,TR 3500ms,TE 25.2ms,6个不同的反转时间(TI),分别为200ms、400ms、600ms、800ms、1000ms、1200ms,成像时间7min6s。
1.3 图像处理与测量使用GE AW4.6工作站将原始数据导入后处理软件FuncTool得到T1mapping图(阈值设为70,可信度为1)。对脑内双侧苍白球、壳核、尾状核头、背侧丘脑、内囊前肢和内囊后肢这6对脑区进行测量,在各脑区最大层面手动设置ROI,同一部位测量3次获取T1均值,记录每个ROI的T1值。
1.4 统计学方法采用IBM公司的SPSS 25.0进行数据处理和分析,对于胆红素值、各脑区T1值及检查日龄等计量资料以(±s)进行表示。将数据导入SPSS软件中,对各变量进行适当的编码和设置。因样本量较小,正态性检验采用Shapiro-Wilk法。方差齐性检验采用Levene's法。多组间各脑区T1值比较采用单因素方差分析,若有差异,则采用LSD-t检验进行两两比较;胆红素值与各脑区T1值的相关性分析采用Pearson相关。所有统计数据均采用双侧检验,P<0.05为差异有统计学意义。
2 结 果
2.1 三组间不同脑区T1值的单因素方差分析统计学分析结果显示,苍白球和内囊后肢T1值在各组间有显著的统计学差异[(F=5.979,P=0.005);(F=6.943,P=0.003)];壳核、尾状核头、背侧丘脑和内囊前肢T1值在各组间的差异无统计学意义(表1、图1~3)。各脑区T1值由大到小排列为对照组、高胆组、脑病组。苍白球及内囊后肢T1值均在对照组和脑病组(P=0.002、P=0.008)及高胆组与脑病组(P=0.023,P=0.028)之间有明显的统计学差异(表2)。
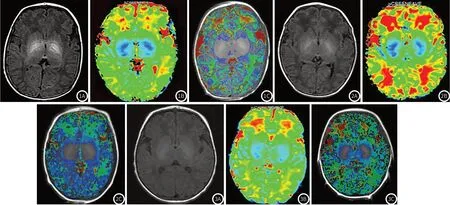
图1~3 依次为脑病组、高胆组及对照组新生儿的典型MRI图像,图1A、2A及3A分别是新生儿的T1WI、T1 mapping伪彩图及T1 mapping与T1WI的融合图。图1:胆红素脑病患儿,女,胎龄38周,生后第3天出现皮肤黄染,MRI检查日龄第5天,TBil峰值571μmol/L(检测日龄第4天)。T1WI像双侧苍白球呈对称性高信号;T1 mapping伪彩图可见双侧苍白球深度蓝染;在融合图中3次勾画苍白球,其T1均值为842.581ms。图2:高胆红素血症患儿,男,胎龄40周+4天,MRI检查日龄第7天,TBil峰值327.6μmol/L(检测日龄第6天)。T1WI像双侧苍白球呈对称性稍高信号;T1 mapping伪彩图可见双侧苍白球中度蓝染;在融合图中3次勾画苍白球,其T1均值为974.891ms。图3:生理性黄疸新生儿,女,胎龄39周+1天,MRI检查日龄第9天,TBil峰值87.5μmol/L(检测日龄第7天)。T1WI像双侧苍白球呈等信号;T1 mapping伪彩图可见双侧苍白球轻度蓝染;在融合图中3次勾画苍白球,其T1均值为1078.472ms。
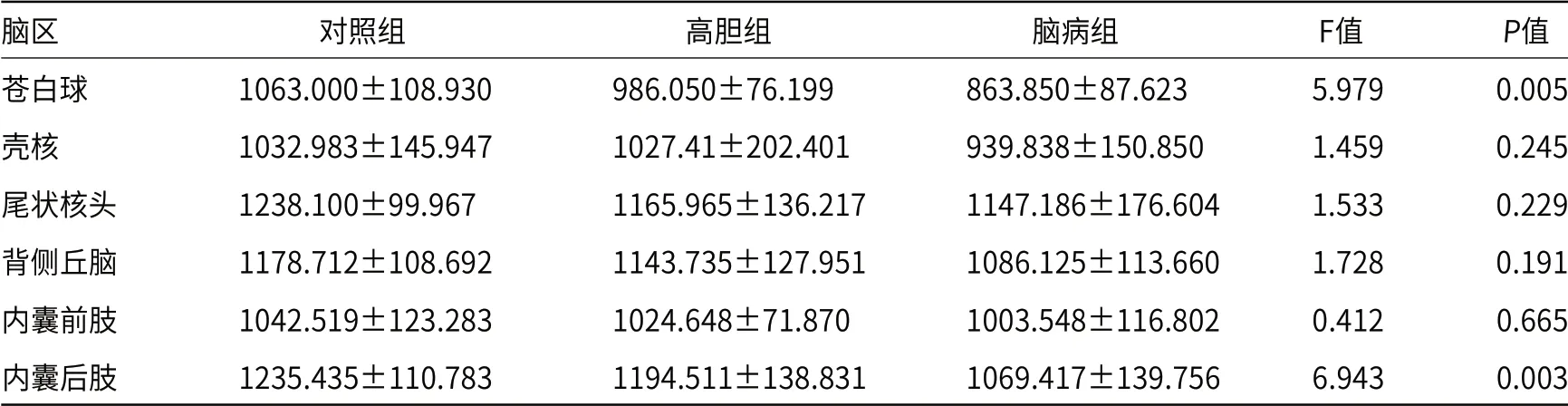
表1 三组间不同脑区T1值比较结果
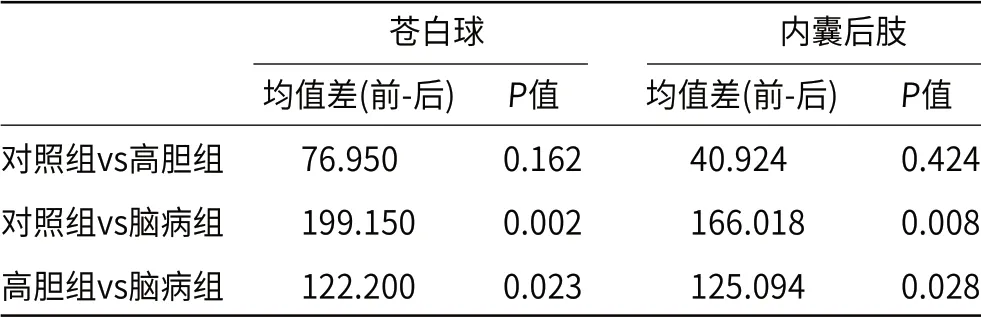
表2 苍白球和内囊后肢T1值的两两比较结果
2.2 各核团T1值与胆红素水平的相关性分析直线相关分析结果显示,苍白球(r=-0.388,P=0.011)、壳核(r=-0.414,P=0.006)及内囊后肢(r=-0.352,P=0.022)T1值与胆红素水平呈负相关,即随着胆红素值的增高,这三对脑区的T1值呈减少趋势(表3、图4)。
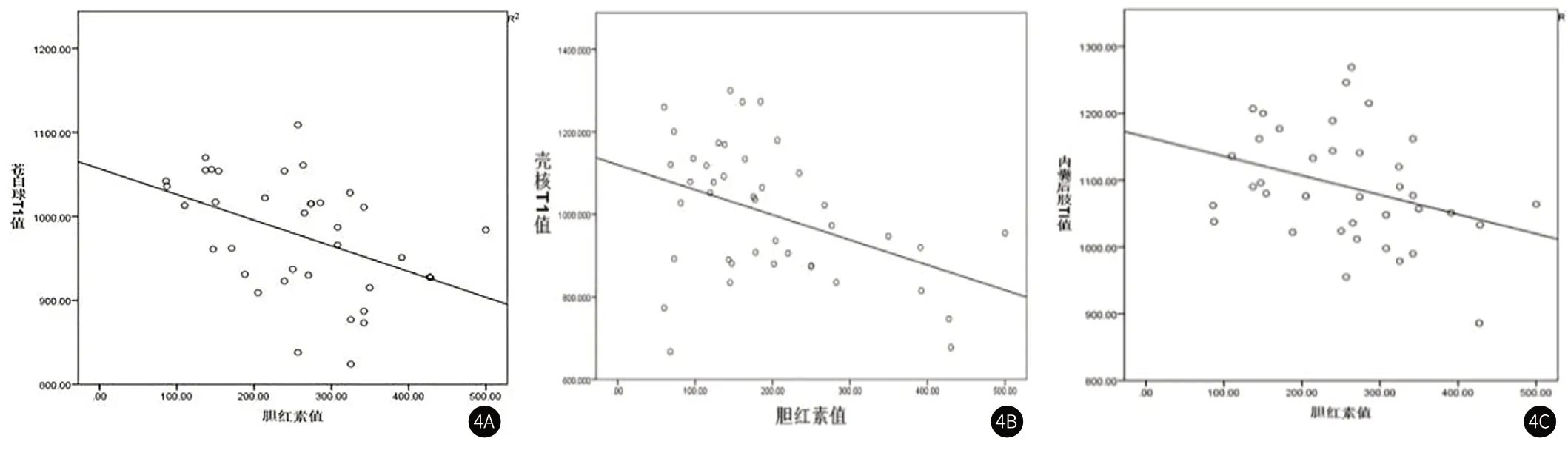
图4 苍白球(图4A)、壳核(图4B)及内囊后肢(图4C)T1值与胆红素值呈负相关
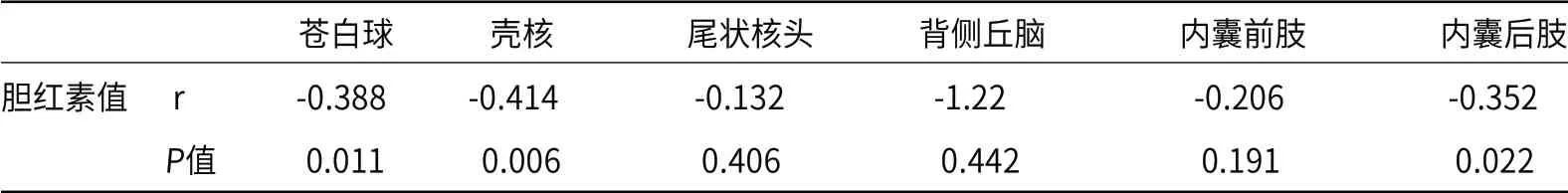
表3 各脑区T1值与胆红素水平的相关性分析
3 讨 论
黄疸是新生儿期常见的一种临床表现,分为生理性和病理性,严重的病理性黄疸可进展为胆红素脑病,治疗不及时可对患儿中枢神经系统造成不可逆性的损伤,导致不同程度的后遗症[3]。以往对胆红素脑病的研究多集中在对苍白球信号强度的观察上,多数学者认为胆红素脑病急性期时表现为磁共振T1WI双侧苍白球对称性高信号[4-5],但也有学者指出,在新生儿苍白球T1WI信号升高不仅见于胆红素脑病,低血清胆红素水平、部分缺血缺氧性脑病患儿、羊水污染及母亲患有妊娠期糖尿病也可出现该征象[6]。因此苍白球T1WI对称性高信号不能成为胆红素脑病患儿的特异性征象。而且,仅凭肉眼观察苍白球信号会存在主观差异,已有许多学者对胆红素脑病新生儿的苍白球信号强度进行间接量化[7],但检查设备的不同和参数设置的细微区别均可导致T1WI信号强度的差异,故仅凭苍白球T1WI高信号诊断胆红素脑病仍不够客观。
T1mappping是一种新的磁共振定量技术,可直接测量组织的T1弛豫值。纵向驰豫时间就是该组织的T1值,即纵向磁化矢量以零为起点,恢复到其激发前最大值63%所需的时间。除温度和场强外,T1值还受多种生物因素的影响,如大分子浓度、水分子结合状态及组织含水量的多少,这些因素在不同的疾病状态下会发生改变,这也是T1mappping用于疾病诊断和评估的基础[8]。T1mapping成像主要采用三种方法实现,如基于反转恢复的序列、基于不同翻转角的序列[9]和基于MR指纹分析的序列[10]等。其中,基于反转恢复的序列是T1mapping的经典方法,本研究即采用该方法,但扫描时间较长。在反转恢复序列[11]中,t时刻纵向磁化矢量M的表达式为M=M0[1-2e(-t/T1)],其中M0为稳定状态的信号强度;取t=TI时,上式变为M=M0[1-2e(-TI/T1)],得出T1计算公式T1=-TI/ln[(1-M/M0)/2]。测出稳定状态时的信号强度M0,然后再测得TI时刻纵向磁化矢量M的信号强度,即可计算出组织的T1值,对不同TI时刻的T1值取均值,即可得到组织的平均T1值。T1mapping现已用于多发性硬化[12]、颈动脉斑块[13]、心脏相关疾病[14-15]及肝功能的评估[16],但关于其在新生儿高胆红素血症脑损害中的应用报道较少。本研究采用T1mapping对高胆红素血症新生儿不同脑区的T1值进行测量,比较三组间各脑区T1值有无差异,了解血清总胆红素值与各脑区T1值的相关性,为新生儿高胆红素血症的诊断和预测提供更多的参考依据。本研究结果显示,苍白球和内囊后肢T1值在各组间具有统计学差异,而丘脑和壳核无明显差异,表明苍白球及内囊后肢是胆红素易损的部位,其中苍白球是高胆红素血症最易受损伤的部位已得到国内外学者的一致认可,但内囊后肢在高胆红素血症中受侵犯的报道较少,分析原因可能与肉眼难以分辨常规磁共振图像中内囊后肢信号的异常,且内囊后肢相对其它脑区范围较局限,受部分容积效应影响大,给测量带来一定困难,将导致测量结果的不准确。Yan等[17]通过弥散张量成像(diffusion tensor imaging,DTI)技术在高胆红素血症新生儿中的应用研究,观察到其内囊后肢的FA值明显高于正常新生儿,且FA值随胆红素水平的增高而增高,表明胆红素对内囊后肢也是有损伤的。本研究结果表明,胆红素缩短了内囊后肢的弛豫时间,T1值降低,推测胆红素沿着某特定的神经通路沉积,造成通路中相应脑区的纵向驰豫时间变短。
本研究结果显示,新生儿苍白球、壳核及内囊后肢T1值与胆红素值呈负相关,提示这些脑区受胆红素影响较明显,这与仪晓立等[18]的研究结果不一致。这可能是由于本研究的样本量较大且胆红素值选择了血清总胆红素峰值而不是间接胆红素峰值。苍白球与肢体的肌张力及姿势反射有关,壳核参与对学习及运动的调节,内囊是大脑半球内部的重要结构,含有大量的上行及下行纤维束,其中皮质脊髓束、视辐射及听辐射通过内囊后肢[19]。本研究结果显示,胆红素使得苍白球、壳核及内囊后肢的纵向驰豫时间变短,相应脑区的功能减弱或消失,这与胆红素诱导的神经功能障碍相符合。但是胆红素使得这些脑区T1值降低的原因并不明确,Bin-Nun等[20]认为胆红素能够破坏神经细胞膜,使钙颗粒沉积在受损神经元内,从而缩短T1弛豫时间;而Hansen等[21]认为胆红素引起神经元和神经胶质细胞受损时,神经纤维可出现一定程度髓鞘化不良或髓鞘磷脂的破坏、丢失,使这些脑区的大分子变少,因此T1值变小。T1mapping可监测高胆红素血症新生儿的各脑区T1值变化,提示胆红素对不同脑区的损伤及其引起相应神经功能改变的可能性。
本研究的局限性在于,样本量较少,需要在未来的研究中加大样本量。这项研究中的儿童都生活在相同的地理区域,因此,本研究不是多中心研究,结果可能不是一概而论的。由于T1值测量对场强及频率的依赖性较高,不同情况下所测T1值不同,本研究只能确定磁场为3.0T时各脑区T1值的参考值范围。本研究仅比较了正常新生儿和高胆红素血症新生儿的各脑区T1值差异,没有进一步研究高胆红素血症新生儿的特异性。在随后的研究中,将增加一到两组患有其他脑部疾病的新生儿,以确认高胆红素血症新生儿各脑区T1值的特异性。
总之,本研究检测了本地区正常新生儿在3.0T磁场时各脑区T1值,建立了参考值范围,为新生儿某些脑部疾病的诊断和治疗提供了可靠、客观的标准。本研究结果表明,苍白球、壳核及内囊后肢的T1值与胆红素值呈负相关;胆红素脑病及高胆红素血症新生儿各脑区T1值均低于正常新生儿。
